От Медицински факултет на Шарите (S.E., J.B., K.G., J.J., M.B., F.C.L.), Клиника Франц Волхард и Център за молекулярна медицина Макс Делбрюк, HELIOS-Klinikum, Берлин, Германия; Институт по клинична химия и лабораторна медицина (P.S.), Университет в Регенсбург, Германия; Катедра по медицина (A.M.S.), Университет Макмастър, Хамилтън, Онтарио, Канада.
От Медицински факултет на Шарите (S.E., J.B., K.G., J.J., M.B., F.C.L.), Клиника Франц Волхард и Център за молекулярна медицина Макс Делбрюк, HELIOS-Klinikum, Берлин, Германия; Институт по клинична химия и лабораторна медицина (P.S.), Университет в Регенсбург, Германия; Катедра по медицина (A.M.S.), Университет Макмастър, Хамилтън, Онтарио, Канада.
От Медицински факултет на Шарите (S.E., J.B., K.G., J.J., M.B., F.C.L.), Клиника Франц Волхард и Център за молекулярна медицина Макс Делбрюк, HELIOS-Klinikum, Берлин, Германия; Институт по клинична химия и лабораторна медицина (P.S.), Университет в Регенсбург, Германия; Катедра по медицина (A.M.S.), Университет Макмастър, Хамилтън, Онтарио, Канада.
От Медицински факултет на Шарите (S.E., J.B., K.G., J.J., M.B., F.C.L.), Клиника Франц Волхард и Център за молекулярна медицина Макс Делбрюк, HELIOS-Klinikum, Берлин, Германия; Институт по клинична химия и лабораторна медицина (P.S.), Университет в Регенсбург, Германия; Катедра по медицина (A.M.S.), Университет Макмастър, Хамилтън, Онтарио, Канада.
От Медицински факултет на Шарите (S.E., J.B., K.G., J.J., M.B., F.C.L.), Клиника Франц Волхард и Център за молекулярна медицина Макс Делбрюк, HELIOS-Klinikum, Берлин, Германия; Институт за клинична химия и лабораторна медицина (P.S.), Университет в Регенсбург, Германия; Катедра по медицина (A.M.S.), Университет Макмастър, Хамилтън, Онтарио, Канада.
От Медицински факултет на Шарите (S.E., J.B., K.G., J.J., M.B., F.C.L.), Клиника Франц Волхард и Център за молекулярна медицина Макс Делбрюк, HELIOS-Klinikum, Берлин, Германия; Институт за клинична химия и лабораторна медицина (P.S.), Университет в Регенсбург, Германия; Катедра по медицина (A.M.S.), Университет Макмастър, Хамилтън, Онтарио, Канада.
От Медицински факултет на Шарите (S.E., J.B., K.G., J.J., M.B., F.C.L.), Клиника Франц Волхард и Център за молекулярна медицина Макс Делбрюк, HELIOS-Klinikum, Берлин, Германия; Институт за клинична химия и лабораторна медицина (P.S.), Университет в Регенсбург, Германия; Катедра по медицина (A.M.S.), Университет Макмастър, Хамилтън, Онтарио, Канада.
От Медицински факултет на Шарите (S.E., J.B., K.G., J.J., M.B., F.C.L.), Клиника Франц Волхард и Център за молекулярна медицина Макс Делбрюк, HELIOS-Klinikum, Берлин, Германия; Институт по клинична химия и лабораторна медицина (P.S.), Университет в Регенсбург, Германия; Катедра по медицина (A.M.S.), Университет Макмастър, Хамилтън, Онтарио, Канада.
Преглеждате най-новата версия на тази статия. Предишни версии:
Резюме
Системата ренин-ангиотензин-алдостерон е причинена от хипертония, свързана със затлъстяването. Изследвахме влиянието на затлъстяването и намаляването на теглото върху циркулиращата и мастната тъкан ренин-ангиотензин-алдостеронова система при жени в менопауза. Кръвните проби бяха анализирани за ангиотензиноген, ренин, алдостерон, ангиотензин-конвертираща ензимна активност и ангиотензин II. В проби от биопсия на мастна тъкан анализирахме експресия на ангиотензиноген, ренин, ренин-рецептор, ангиотензин-конвертиращ ензим и експресия на рецептор за ангиотензин II тип-1. Затлъстелите жени (n = 19) имат по-висок циркулиращ ангиотензиноген, ренин, алдостерон и ангиотензин-конвертиращ ензим, отколкото слабите жени (n = 19), и по-ниска експресия на ангиотензиногенен ген в мастната тъкан. Седемнадесет жени успешно участваха в протокол за намаляване на теглото в продължение на 13 седмици, за да намалят дневния калориен прием с 600 kcal. Телесното тегло бе намалено с -5%, както и нивата на ангиотензиноген с -27%, ренин с -43%, алдостерон с -31%, ангиотензин-конвертираща ензимна активност с -12% и експресия на ангиотензиноген с -20% в мастната тъкан (всичко P 1,2 Ренин-ангиотензин-алдостероновата система (RAAS) е замесена от няколко автори. 3 При хора се съобщава за повишена циркулираща ангиотензиноген (AGT), ренин, алдостерон и ангиотензин-конвертиращ ензим (ACE) активност при затлъстели пациенти. 4-10 Освен това, повишената експресия на ген RAAS е описана в мастната тъкан, особено при модели на затлъстяване при гризачи. 3,11–15 Връзката между експресията на гена AGT на мастната тъкан и кръвното налягане наскоро беше документирана при 2 модела мишки. Целевата експресия на AGT в адипоцити на диви и AGT нокаутиращи мишки повишава нивата на AGT в кръвообращението и кръвното налягане. 16 Целенасочена експресия на 11β-хидроксистероидна дехидрогеназа-1 в адипоцити повишава кръвното налягане, плазмената AGT и експресията на AGT на мастната тъкан при мишки с генетичен произход от див тип. 17,18 Връзката между кръвното налягане и RAAS при затлъстели хора идва предимно от наблюдения, а не от интервенционни проучвания. Влиянието на загуба на тегло върху активността на RAAS, особено върху плазмените нива на AGT и RAAS на мастната тъкан, не е изследвано.
Методи
Изолирахме и обработихме иРНК за полимеразна верижна реакция в реално време (технология TaqMan от PE Biosystems, Weiterstadt, Германия), както е описано подробно по-рано. 13 Използван е стандартният метод на кривата за целевите гени (AGT, ренин, ренин-рецептор, ACE, ангиотензин II тип-1 [AT1] рецептор) и гена за вътрешен контрол (човешка глицералдехид-3-фосфат дехидрогеназа, GAPDH) РНК проби. Експресията на целевите гени се нормализира чрез експресия на GAPDH във всяка проба и се дава в произволни единици. Експресията на рениновия рецепторен ген в изолирани човешки адипоцити е открита от нашата група (данните не са показани) и не е докладвана преди. Последователностите, използвани за верижна реакция на полимераза в реално време, бяха: праймер, 5′CCAGGACTCGCAGTGGGTAA3 ′; обратен грунд, 5′CACTCCCTTCACCATCACCAT3 ′; флуоресцентно маркирана сонда, 6-FAM-5′TGTTTCATCGTCCTCGGGCTACCG3′-TAMRA. Коефициентите на вариация на взаимодействие са 1,8% за GAPDH, 6,7% за AGT, 6,4% за ренин, 3,1% за рениновия рецептор, 6,6% за АСЕ и 6,8% за AT1 рецептора.
Проби от плазма и серум на гладно се събират след 30 минути почивка в легнало положение. AGT на плазмата се определя чрез радиоимуноанализ след разцепването до Ang I чрез екзогенно добавяне на човешки ренин, както е описано. 19 Серумът Ang II се измерва чрез ензимен имуноанализ след екстракция с ледено студен етанол, като се използва комплект Ang II EIA (Bachem, Германия). Активността на АСЕ в серума се определя чрез калориметричен анализ (Sigma Diagnostics, Deisenhofen, Германия). Плазмената концентрация на ренин и активиран проренин се определя чрез имунохимилуминометричен анализ (Nichols Institute Diagnostics, Advantage Direct Renin Assay, San Clemente, Calif). Серумният алдостерон се определя чрез твърдофазен радиоимуноанализ (DPC Biermann, Bad Nauheim, Германия). Коефициентите на вариация на взаимодействие са 3,4% за AGT, 17% за Ang II, 7,2% за АСЕ активност, 6,1% за ренин и 5,6% за алдостерон.
Данните бяха анализирани от SPSS 11.5.1 (SPSS Inc, Чикаго, Илинойс). Всички променливи (средно ± SD) бяха нормално разпределени. Студент т тестът е използван за групови сравнения. Сдвоена проба т тестът е използван за изходни данни и данни за загуба на тегло. Коефициентът на корелация на Пиърсън описва връзките между променливите. Резултатите се считат за статистически значими при P
ТАБЛИЦА 1. Клинични променливи от изследването в напречно сечение (средно ± SD)
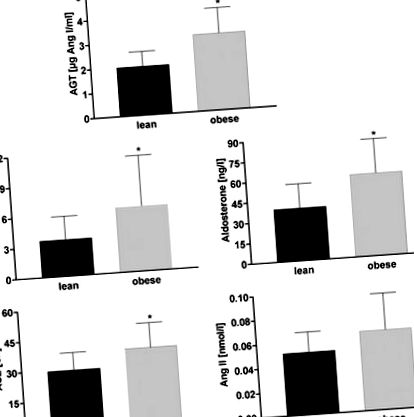
Фигура 1. Сравнение на циркулиращата система ренин-ангиотензин-алдостерон между 19 слаби и 19 жени със затлъстяване в постменопауза. Данните са дадени като средно ± SD. Групово сравнение по студент т тест за независими проби. *P
Фигура 2. Сравнение на експресията на мастна тъкан на гени на ренин-ангиотензиновата система между 19 слаби и 19 жени със затлъстяване в постменопауза. Данните са дадени като средно ± SD. Групово сравнение по студент т тест за независими проби. *P
Загуба на тегло от 5% в рамките на 16 седмици е постигната от 17 от 30 жени. Тези жени са били на възраст 59 ± 7 години и са загубили 5,6 ± 1,0% телесно тегло по време на 13 ± 2 седмици. Таблица 2 обобщава промените в клиничните променливи, състава на диетата и екскрецията на електролити с намаляване на теглото. Тези данни показват, че жените със затлъстяване в проучванията за напречно сечение и загуба на тегло са сходни, което позволява систематично проучване на RAAS при затлъстяване и загуба на тегло. Освен антропометрични променливи, се наблюдават промени в средното дневно измерване на систолично амбулаторно кръвно налягане, инсулин на гладно и в индекса HOMA. Загубата на тегло е постигната чрез намаляване на общата консумация на храна; не се наблюдават големи промени в състава на храната. Приемът и екскрецията на натрий и калий не са значително намалени в края на проучването.
ТАБЛИЦА 2. Промени с намаляване на теглото (средно ± SD)
Установени са намалени нива за циркулиращ AGT, ренин, алдостерон и АСЕ след загуба на тегло (Фигура 3). В мастната тъкан е намерена намалена експресия за AGT (Фигура 4). Разликите между средните стойности на изходното ниво и загубата на тегло не са отразени от връзките между степента на загуба на тегло и степента на намаляване на експресията на AGT, циркулиращата AGT, ренин, алдостерон или ACE (коефициент на корелация на Пиърсън, данните не са показани). Загубата на тегло обаче е неспецифична, докато намаляването на обиколката на талията е ценен заместител за загубата на висцерална мастна тъкан. Открихме много значима връзка между спада в плазмените нива на AGT и обиколката на талията, която не зависи от намаляването на телесното тегло или индекса на телесна маса (ИТМ) (r= 0,71; P= 0,004; след корекция за отслабване и намаляване на ИТМ; Фигура 5). Освен това, намаляването на циркулиращия AGT беше силно корелирано с намаляването на експресията на AGT гена в мастната тъкан (Фигура 5). Намаляването на систоличното кръвно налягане е корелирано с двете плазмени AGT (r= 0,61; P= 0,006) и експресия на AGT ген в мастната тъкан (r= 0,51; P
Фигура 3. Циркулиращата система ренин-ангиотензин-алдостерон преди и след 5% загуба на тегло при 17 жени със затлъстяване в постменопауза. Данните са дадени като средно ± SD. Групово сравнение по т тест за сдвоени проби. *P
Фигура 4. Експресия на мастна тъкан на гени на ренин-ангиотензиновата система преди и след 5% загуба на тегло при 17 жени със затлъстяване в постменопауза. Данните са дадени като средно ± SD. Групово сравнение по т тест за сдвоени проби. *P
Фигура 5. Връзка между намаляването на обиколката на талията или експресията на AGT на мастната тъкан и спада на плазмените нива на AGT при 17 жени в постменопауза в проучването за отслабване; 95% поверителни интервали са дадени за регресионния анализ.
Дискусия
По-високите нива на активност на AGT, ренин, алдостерон и АСЕ при затлъстели в сравнение с постните жени в менопауза предполагат, че RAAS е бил активиран при нашите затлъстели пациенти. Това активиране е намалено с 5% намаляване на телесното тегло, което е придружено от 7 mm Hg намаляване на систолното 24-часово амбулаторно кръвно налягане. В мастната тъкан експресията на AGT гена е намалена при затлъстели жени и е намаляла още повече със загуба на тегло. Освен затлъстяване, всички жени бяха здрави, с леко повишени нива на холестерол. Никой не е имал признаци и симптоми на свързано със затлъстяването увреждане на крайните органи.
Повишените циркулиращи нива на AGT в плазмата при затлъстяване са описани преди. 4–7,21 Потвърдихме тази констатация и за първи път демонстрираме на нашето знание, че повишените плазмени нива на AGT при затлъстели лица могат да бъдат намалени с 5% загуба на тегло, близо до нивата при слаби субекти. Освен това, намаляването на обиколката на талията, заместител на намалената телесна мастна маса, е по-добър предиктор за намалените нива на AGT в плазмата, отколкото загубата на тегло само по себе си. Това откритие директно води до въпроса дали мастната секреция на AGT участва в определянето на плазмените нива на AGT, както се предполага от проучвания върху животни. 16,22 Този въпрос е труден за изучаване при хората. Микродиализата не може да се използва поради молекулния размер на AGT и артериовенозните разлики на AGT спрямо депата на мастната тъкан никога не са били измервани. Вместо това изследването на генната експресия на AGT даде противоречиви резултати.
Открихме намалена експресия на AGT в подкожната мастна тъкан на затлъстели лица, потвърждавайки нашите по-ранни резултати. 13 Намалени или непроменени нива на експресия на AGT в мастната тъкан на пациенти със затлъстяване или хипертония също са публикувани от други. 14,15,23 Освен това, секрецията на AGT от изолирани подкожни адипоцити не се различава при слаби и затлъстели донори. 24 Само 1 група съобщава за повишена експресия на гена AGT в подкожната и висцералната мастна тъкан с повишен ИТМ или увеличена обиколка на талията. 11,12 За разлика от данните при животни, 16–18,22,25–27 повечето проучвания при хора не поддържат повишена експресия на AGT на мастната тъкан при затлъстяване. Намалена експресия на AGT на мастната тъкан след загуба на тегло не е докладвана по-рано. Въпреки че секрецията на AGT от адипоцитите е добре документирана, не можем да изключим възможността други видове клетки освен адипоцитите (напр. Ендотелни клетки, лимфоцити, моноцити/макрофаги) да допринесат за намаленото образуване на AGT в мастната тъкан. Освен това не можем да изключим възможността секрецията на AGT от черния дроб да намалява със загуба на тегло в нашето проучване. Данните при животни обаче категорично предполагат, че секрецията на AGT от черния дроб не се влияе от затлъстяването или загубата на тегло. 22,27
Ако адипоцитите допринасят за циркулиращите нива на AGT при хората, тогава увеличената маса на мастната тъкан сама по себе си би била достатъчна за увеличаване на плазмените нива на AGT при затлъстелите. Повишената експресия на AGT на ниво адипоцити не е необходимо изискване. Намалената експресия на AGT в мастните клетки по време на периода на отслабване, заедно с намалената маса на мастната тъкан, може да допринесе за спада на плазмената AGT със загуба на тегло. В нашето проучване е установена силна връзка между намаляването на експресията на AGT в мастната тъкан и нивата на циркулиращ AGT. По този начин ние предлагаме верига за отрицателна обратна връзка, която контролира експресията на AGT на адипоцитите в ситуацията на увеличаване на плазмените нива на AGT при затлъстелите. Загубата на тегло може да добави регулаторен механизъм, който допълнително намалява експресията на AGT в мастната тъкан. Намалените плазмени нива на AGT могат след това да стимулират пониженото кръвно налягане. Този модел се основава на предположението, че AGT на мастната тъкан навлиза в системното кръвообращение. При мишките това е така. 16.
Механизмите, които могат да контролират експресията на AGT при затлъстяване и да намалят експресията на AGT по време на загуба на тегло, не са известни. Не са установени убедителни хормонални регулатори на гена AGT в човешки или животински адипоцити. 3 Няколко проучвания предполагат значението на AGT генотипите за връзката между телесното тегло и кръвното налягане. 28–31 Как тези варианти (AGT-6, AGT-20, AGT174, AGT235) могат да контролират експресията на AGT и нивата на AGT в плазмата не е известно. Освен това са получени отрицателни резултати за генотипа AGT235 и фенотипите със затлъстяване. 5,32 AGT секрецията от изолирани човешки адипоцити не е повлияна от генотипа AGT235. 24 По отношение на загубата на тегло, генотипите AGT-6 са свързани с намаляването на кръвното налягане, но не и със самата загуба на тегло. 33
Перспективи
Затлъстяването е свързано с повишени нива на циркулиращия RAAS (AGT, ренин, алдостерон, ACE). Тези повишени нива са значително намалени с 5% загуба на телесно тегло. Пониженото регулиране на експресията на AGT в мастната тъкан в отговор на загуба на тегло подкрепя предположението, че плазмените нива на AGT са свързани с експресията на AGT гена в мастната тъкан. Освен това, намаляването на експресията на AGT в мастната тъкан и циркулиращия AGT са свързани с намаляването на систолното кръвно налягане. Тези данни предполагат, че намалената маса на телесните мазнини може да намали RAAS активността в плазмата и мастната тъкан, находка с терапевтични последици.
Германският проект за човешки геном (BMBF 01KW0011) подкрепи това проучване. Благодарим на Iris Gottschalk, Gritt Stoffels и Anke Strauß за помощта им с доброволците и Henning Damm и Irene Strauss за тяхната експертна техническа помощ.
- Загуба на тегло и нормализиране на кръвното налягане значението на ранните интервенции при хипертония
- Отслабване и ендокринната система Бъдещо обучение за фитнес
- Хормон за отслабване активира мозъчните пътища, които инструктират тялото да изгаря мазнините; Централна нервна система
- Ефектите върху загубата на тегло от използването на патентована система за доставка на орален серотонин
- TLS система за отслабване - New Life Chiropractic