Резюме
Язвената болест (PUD) е често срещано състояние, с което се сблъскват както доставчиците на първична медицинска помощ, така и гастроентеролозите. Симптомите на язвена болест са променливи и могат да включват коремна болка, гадене, повръщане, загуба на тегло и кървене или перфорация със сложно заболяване. Идентифицирането на рисковите фактори и механизми, които водят до развитието на PUD, помага да се разбере подходът, стоящ зад диагностичните и лечебните стратегии.
Пептичните язви често се срещат в условията на първична помощ и разбирането на свързаните рискови фактори е от ключово значение за профилактиката и управлението на заболяванията.
Определение и епидемиология
Пептичните язви са киселинно-индуцирани лезии, открити в стомаха и дванадесетопръстника, характеризиращи се с оголена лигавица с дефект, простиращ се в субмукозата или muscularis propria.1 Лезии, които не достигат тази дълбочина, се наричат ерозии (Фигура 1). В Съединените щати разпространението на самоотчетената от лекар диагностицирана язвена болест е 10% през 1990 г., а приблизителната честота е около 500 000 нови случая годишно. 2, 3 Като цяло обаче рискът от смъртност и нуждата от хоспитализациите поради PUD намаляват в световен мащаб. Това е най-вероятно вторично вследствие на спад в инфекциите с Helicobacter pylori (H. pylori) поради лечение и подобрена хигиена.4, 5 По-голямо използване на лекарства, отпускащи лекарства без рецепта и без рецепта и по-голямо внимание при нестероидни анти- възпалителните лекарства (НСПВС) също могат да обяснят частично тази тенденция
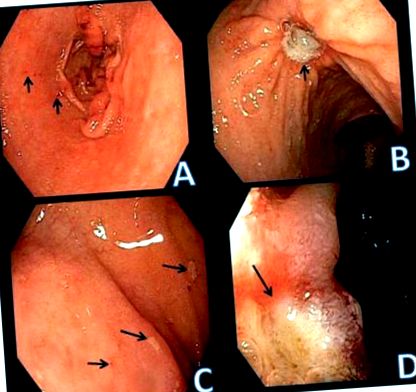
Пептични ерозии и язви в стомаха и дванадесетопръстника. А. малки ерозии в стомашния антрум. Стрелките идентифицират счупванията на лигавицата с фокален кръвоизлив. Б. Доброкачествена пептична язва в тялото на стомаха (стрелка). В. Дуоденални ерозии, идентифицирани чрез фокални области на прилепнал ексудат (стрелки). Г. Язва на дванадесетопръстника. Дефектът на лигавицата има дълбочина и границата се идентифицира със стрелката. Околната лигавица е оточна.
Етиология и патофизиология
Основните рискови фактори за PUD са употребата на H. pylori и НСПВС, но не всички индивиди, заразени с H. pylori или приемащи НСПВС, развиват PUD.1, 7 Почти половината от световното население е колонизирано от H. pylori. 8 Организмът обикновено се придобива в детска възраст и се запазва до лечение. Рисковите фактори за придобиване на инфекцията включват по-нисък социално-икономически статус и нехигиенични условия или пренаселеност. Разпространението на H. pylori е по-високо в развиващите се страни и по-често при определени етноси. През последните пет години в Съединените щати се наблюдава спад в разпространението на H.pylori във всички възрасти. И все пак има разлики въз основа на етническа принадлежност с проценти на инфекция, които са над 60% при мексиканските американци спрямо 30% в неиспанското бяло население.
H. pylori причинява възпалителен отговор с неутрофили, лимфоцити, плазмени клетки и макрофаги в лигавичния слой и причинява дегенерация и нараняване на епителните клетки. Гастритът обикновено е по-тежък в антрума, с малко или никакво възпаление в корпуса. Всички пациенти, за които е установено, че имат пептични язви, трябва да бъдат изследвани за H. pylori. Съществуват както инвазивни, така и неинвазивни методи за тестване, които са обобщени в таблица 1. От всички неинвазивни методи тестът за дишане на урея и тестовете за антиген на изпражненията са най-осъществими и са по-точни от серологичните тестове.10 Въпреки че инвазивната ендоскопия позволява биопсия и включва разнообразни методи за изследване като хистология, култура или бързо тест за уреаза. Всички методи, различни от серологията, са засегнати от използването на лекарства, потискащи киселината, като инхибитори на протонната помпа и могат да доведат до фалшиви негативи.
маса 1
Диагностични тестове за H. pylori
| Серология | 85–92% | 79–83% | Само тест, който не се влияе от ИПП или употребата на антибиотици | Не може да се потвърди излекуването |
| Тест за дишане на урея | 95% | 96% | Потвърждава излекуването | Точност, повлияна от ИПП и употребата на антибиотици |
| Тестване на фекален антиген | 95% | 94% | Потвърждава излекуването | Точност, повлияна от ИПП и употребата на антибиотици |
| Бърз тест за уреаза | 98% | 99% | Евтино, потвърждава излекуването | Изисква ендоскопия, по-малко точна след лечение или след употреба на ИПП |
| Хистология | > 95% | > 95% | Позволява визуализация, потвърждава излекуването | Изисква ендоскопия, засегната от ИПП и употребата на антибиотици |
| Култура | 70–90% | 100% | Позволява определяне на антимикробната чувствителност, потвърждава излекуването | Изисква ендоскопия, резултатът отнема няколко дни, повлиян от ИПП и употребата на антибиотици |
PPI, инхибитор на протонната помпа
НСПВС се използват широко при различни състояния, за да помогнат за намаляване на болката и възпалението; много потребители обаче развиват стомашно-чревни странични ефекти. НСПВС представляват над 90% от всички язви и приблизително 25% от потребителите на НСПВС ще развият язвена болест.11 Потребителите на аспирин също са два пъти по-склонни да развият пептични язви, отколкото общата популация.12, 13 Други развиват по-лека степен на локално увреждане, което се разглежда като лигавични кръвоизливи и ерозии и се нарича гастропатия на НСПВС. Тези множество малки ерозии обикновено се намират в антрума, но могат да се видят и в тялото.
НСПВС предизвикват увреждане на лигавицата по няколко механизма. По-голямата част от НСПВС са слаби киселини и стават протонирани и преминават през липидните мембрани, за да проникнат в епителните клетки, когато са изложени на киселинен стомашен сок (pH 2). В епителната клетка (рН 7,4), НСПВС йонизира и освобождава своя Н + и не може да премине през липидната мембрана и по този начин попада в капан. Това води до разединяване на окислителното фосфорилиране, което води до намалено производство на митохондриална енергия, намалена клетъчна цялост и повишена клетъчна пропускливост. Това може да доведе до локално нараняване и бърза смърт на епителните клетки, повърхностен кръвоизлив и ерозии.
Другият основен механизъм, по който НСПВС причиняват увреждане на лигавицата, е чрез инхибиране на циклооксигеназа-1 (COX-1), която е отговорна за синтеза на простагландини. Простагландините увеличават секрецията на бикарбонат и лигавицата, увеличават лигавичния кръвен поток и инхибират клетъчната пролиферация, за да поддържат лигавичната бариера.5 Аспирин ацетилира циклооксигеназата и необратимо инхибира ензима, докато НСПВС инхибират ензима обратимо по зависим от концентрацията начин. Сред тези патофизиологични отговори се смята, че намаляването на притока на кръв е основният механизъм, отговорен за причиненото от НСПВС нараняване.
Съществуват две изоформи на COX: COX-1 е отговорен основно за синтеза на простагландини в стомашно-чревния тракт, докато COX-2 е отговорен за синтеза на простагландини в местата на възпаление. НСПВС като ибупрофен, напроксен, аспирин и индометацин инхибират както COX-1, така и COX-2 и се класифицират като неселективни. Специфичните за COX-2 НСПВС като целококсиб или рофекоксиб инхибират COX-2, без да инхибират COX-1, което ги прави потенциално по-безопасни в стомашно-чревния тракт. Ендоскопските проучвания на пациенти, приемащи COX-2 инхибитори, показват по-ниска честота на улцерация от около 3-5% в сравнение с традиционните НСПВС, които имат честота 20-40%. Доказано е обаче, че COX-2 селективните НСПВС повишават риска от сърдечни заболявания и много от тях са изтеглени от пазара.
Тези, които са изложени на най-висок риск от язви, предизвикани от НСПВС, са пациенти с анамнеза за пептични язви или кръвоизливи, тези, които едновременно използват стероиди или антикоагуланти, лица на възраст над 65 години и тези, които приемат високи дози или комбинации от повече от едно НСПВС (включително ниски доза аспирин). Ако тези пациенти се нуждаят от множество средства, те трябва да започнат лечение за предотвратяване на язви. Освен това, използването на лекарства като селективни инхибитори на обратното захващане на серотонин, кортикостероиди, антагонисти на алдостерон или антикоагуланти увеличава риска от кървене.15 По-напреднала възраст и по-голям брой съпътстващи заболявания също влияят върху клиничния ход на пациентите с H. pylori и НСПВС. 17 Взаимодействието между H. pylori и НСПВС е противоречиво, но настоящите насоки на Американския колеж по гастроентерология препоръчват тестване и лечение на H. pylori, ако дадено лице започва дългосрочни НСПВС и тестването може да бъде обмислено и при тези, приемащи дългосрочни ниски дози аспирин. .5, 18
Около една пета от случаите на PUD не са свързани с H. pylori, НСПВС или аспирин, но точността на тази стойност е оспорена поради фалшиво отрицателни тестове за H. pylori или случайно (или недостатъчно докладвано) поглъщане на НСПВС. 19,20 Този идиопатичен PUD може да се дължи на дисбаланс между фактори, които допринасят за целостта на лигавицата и агресивни обиди, включително хиперсекреторен статус. Други етиологии за PUD включват исхемия, причиняваща стрес язви, лекарства (стероиди, алендронат, калиев хлорид и химиотерапевтични средства), вирусни инфекции (CMV, HSV), стомашна байпас хирургия, метаболитни нарушения, лъчетерапия, хистамин, еозинофилна инфилтрация и базофилия., 21
Диагноза
Диагнозата започва с клинично подозрение, когато пациентите имат симптоми като коремна болка в епигастриума, парене, постпрандиална пълнота или ранно засищане.1 Класически пациентите с язва на дванадесетопръстника се оплакват от влошаване на коремна болка на гладно и описват глад или коремна болка две до три часа след хранене или през нощта. За разлика от това, пациентите със стомашни язви съобщават за гадене, повръщане, загуба на тегло и болки в корема след прандиал. Пациентите в напреднала възраст често са минимално симптоматични и някои пациенти с нелекуван PUD могат да имат периодични симптоми поради спонтанно излекуване и след това рецидив поради постоянство на рискови фактори, като продължителна употреба на НСПВС или инфекция с H. pylori
Ако клиничните симптоми предполагат възможна язвена болест и не се забелязват алармени симптоми, може да се започне емпирично лечение с антисекреторна терапия. Освен това, тъй като H. pylori е често срещана причина за PUD, се препоръчва стратегия за тестване и лечение с неинвазивен тест за H. pylori (тест за дишане на изпражнения или урея) при пациенти на възраст под 55 години без алармени характеристики, в географските региони ракът на стомаха е необичаен и разпространението на H. pylori е по-голямо от 20% .22 При по-възрастни пациенти и пациенти със симптоми на тревога се препоръчва ендоскопия за установяване на диагноза. Сигналите за аларма включват GI кървене, загуба на тегло, ранно засищане, дисфагия или одинофагия, фамилна анамнеза за злокачествено заболяване в горната част на стомашно-чревния тракт, желязодефицитна анемия или нови симптоми на горен стомашно-чревен тракт при пациенти на възраст над 55,23 години. на ПУД. Той може да се използва за откриване на H. pylori със стомашни биопсии и може да изключи злокачествено заболяване.
Лечение
Могат да се обмислят множество режими на лечение на H. pylori и стандартната продължителност на лечението е 14 дни. Дозите на използваните лекарства са: инхибитор на протонната помпа (PPI, стандартна или двойна доза), кларитромицин 500 mg два пъти дневно, амоксицилин 1 gm два пъти дневно, бисмутов субсалицилат 300 mg QID, метронидазол 500 mg TID, тетрациклин 500 mg QID, левофлоксацин 500 mg QD, рифабутин 300 mg QD.
Всички пациенти, лекувани за H. pylori, трябва да бъдат тествани, за да потвърдят ерадикацията най-малко четири седмици след завършване на терапията. Терапията от втора линия трябва да се предписва, ако режимът от първа линия се провали (Фигура 2) и не трябва да включва повтарящи се метронидазол или кларитромицин.18 Освен това, тестването за чувствителност трябва да се обмисли след две неуспешни терапии или след една неуспешна терапия, когато се извършва ендоскопия (по други причини като проследяване на стомашна язва). Ако културата за H. pylori не е достъпна за оценка на резистентност или след като три препоръчани лечения са неуспешни, може да се обмисли тройна терапия на базата на рифабутин (PPI, рифабутин и амоксицилин) в продължение на 10 дни. Ако симптомите не се подобрят след ерадикация на H. pylori, трябва да се продължи с ендоскопия, ако вече не е извършена.
Усложнения
Усложненията на PUD включват слаби симптоми, кървене, перфорация, проникване, запушване на изхода на стомаха и злокачествено заболяване на стомаха (аденокарцином и MALT лимфом). Кървенето е най-честото усложнение и се среща при около 15–20% от пациентите. PUD представлява голяма част (около 40–60%) от острото кървене от горната част на стомашно-чревния тракт. Предупреждението на консултант по ГИ в началото на оценката на пациент с кървене е полезно за координиране на грижите за критично болни пациенти. Резултатите от Глазгоу-Блачфорд и Rockall са използвани за стратификация на риска.29 Подходящата реанимация с интравенозни течности и кръвни продукти за поддържане на целта хемоглобин над 7 е от жизненоважно значение при управлението.
Интравенозната терапия с PPI трябва да започне при всички пациенти, за които се смята, че имат кръвоизлив в горната част на стомашно-чревния тракт веднага след представянето им, тъй като интравенозните PPI намаляват риска от откриване на високорискови стигмати по време на ендоскопия и в съответствие с това риск от повторно кървене и необходимост от операция. Те действат чрез повишаване на интра-стомашното рН, насърчаване на агрегацията на тромбоцитите и осигуряване на стабилност на съсиреците. Прокинетични агенти като еритромицин или метоклопрамид също могат да бъдат разгледани за подобряване на ендоскопската визуализация и диагностичния добив.31 Ранната ендоскопия, която в идеалния случай се извършва в рамките на 24 часа, осигурява както прогностични, така и терапевтични резултати. След ендоскопия се препоръчва или да се започне, или да се продължи ИПП (IV, ако се открият високорискови стигмати от кървене). Проучванията показват, че IV PPI, даван два пъти дневно, е толкова ефективен, колкото непрекъснатият PPI drip32, 33 със значителни икономии на разходи. Повтарящото се кървене е свързано с висока смъртност и може да изисква повторна ендоскопия, ангиографска емболизация чрез интервенционна рентгенология или операция.
Перфорацията е следващото най-често усложнение на PUD, възникващо при 2–10% от пептичните язви и може да се прояви като внезапна силна коремна болка с хемодинамична нестабилност или шок.35 Резултатите от физическия преглед могат да включват първоначално хиперактивни чревни звуци, които могат да намалят и да прогресират до твърд корем с отскок, предполагащ перитонит. Наличието на свободен въздух при изображения е в подкрепа на тази диагноза и при тази настройка трябва да се избягва ендоскопия. Хирургията обикновено е избрано лечение за перфорирана пептична язва.3 При пациенти с лоши хирургични кандидати и с перфорация за повече от 24 часа, която се съдържа (въз основа на водоразтворими контрастни проучвания), медицинско лечение с назогастрално (NG) засмукване, IV течности, антибиотици и подтискане на киселина са опция. Проникващите язви също могат да ерозират в близките органи като панкреас, черен дроб, жлъчен канал или дебело черво.
Запушването на стомашния изход (GOO) е друго усложнение на PUD и може да се прояви с ранно засищане, подуване на корема, загуба на тегло, лошо храносмилане, гадене и повръщане. При физически преглед може да се чуе изпръскване на сукусия поради задържане на въздух и течност в стомаха. Язви, които се проявяват с GOO, често се намират в пилоричния канал или дуоденалната крушка. Медицинската терапия обикновено включва NG всмукване и антисекреторна терапия. Ендоскопска балонна дилатация на пилора или хирургическа намеса са варианти за облекчаване на хроничната обструкция
Заключение
PUD е заболяване с намаляваща клинична тежест поради спада на инфекциите с H. pylori, както и повишена достъпност до антисекреторна терапия и по-разумно използване на НСПВС. Въпреки това, поради продължаващото му високо разпространение през целия живот и разнообразното клинично представяне, разпознаването и подходящото управление на PUD са от ключово значение за избягване и минимизиране на значителни усложнения. Тестване и лечение на H. pylori, както и ограничаване на нараняването на лигавицата, причинено от НСПВС (чрез едновременна PPI профилактика или избор на COX-2 селективни НСПВС, ако са налични) са стратегиите, които трябва да се вземат предвид при оценката на PUD. Реанимацията, антисекреторната терапия, ендоскопията и лечението на антитромботични средства са ключовите стъпки при лечението на PUD кървене, което е най-честото усложнение.
Биография
Мечу Нараянан, д-р, (горе вляво) и Kavya M. Reddy, д-р, (горе вдясно), са стипендианти, а д-р Елизабет Марсикано (долу) е асистент по вътрешни болести в катедрата по гастроентерология и хепатология, Медицински факултет на Университета Сейнт Луис, Сейнт Луис, Mo.
- Пептична язва (язви) - гастроентеролог
- Язвена болест - съветник по ракова терапия
- Пептична язва, сестрински грижи и управление - Nurseslabs
- PDF Работеща глава ПЕПТИЧНА ЯДРНА БОЛЕСТ МЕДИЦИНСКИ И ХИРУРГИЧНИ ЛЕЧЕНИЯ - Безплатно изтегляне в PDF
- Нов подход за перфорация на пептична язва - Ahmadinejad - 2020 - Доклади за клинични случаи -