Chirag H. Mandavia
1 Медицински факултет на Университета в Мисури, Катедра по вътрешни болести, Колумбия, Мисури
3 Медицински факултет на Университета в Мисури, Катедра по диабет и сърдечно-съдови изследователски център, Колумбия, Мисури
Лакшми Пулакат
1 Медицински факултет на Университета в Мисури, Катедра по вътрешни болести, Колумбия, Мисури
3 Медицински факултет на Университета в Мисури, Катедра по диабет и сърдечно-съдови изследователски център, Колумбия, Мисури
4 Хари Труман Медицински център за дела на ветераните, Колумбия, Мисури
Винсент ДеМарко
1 Медицински факултет на Университета в Мисури, Катедра по вътрешни болести, Колумбия, Мисури
2 Медицински факултет на Университета в Мисури, Катедра по медицинска фармакология и физиология, Колумбия, Мисури
3 Медицински факултет на Университета в Мисури, Катедра по диабет и сърдечно-съдови изследователски център, Колумбия, Мисури
Джеймс Р. Соуърс
1 Медицински факултет на Университета в Мисури, Катедра по вътрешни болести, Колумбия, Мисури
2 Медицински факултет на Университета в Мисури, Катедра по медицинска фармакология и физиология, Колумбия, Мисури
3 Медицински факултет на Университета в Мисури, Катедра по диабет и сърдечно-съдови изследователски център, Колумбия, Мисури
4 Медицински център „Хари С Труман“, „Ветерани“, Колумбия, Мисури
Резюме
Сърдечно-съдовите заболявания, които представляват най-високата заболеваемост и смъртност в Съединените щати, имат няколко основни рискови фактора, включително стареене и диабет. Наднорменото тегло и затлъстяването, особено коремното затлъстяване, са все по-често замесени като независими рискови фактори за развитието на сърдечно-съдови заболявания. Метаболитната и/или диабетната кардиомиопатия е особено свързана с наднорменото телесно тегло, причинено от хронично прекомерно хранене и хранене с високо съдържание на мазнини. В началните етапи вече се разбира, че затлъстяването причинява значително нарушение на метаболизма на сърдечната мастна киселина и глюкозата. Тези аномалии се дължат отчасти на повишения оксидативен стрес, който от своя страна може да причини вредни ефекти върху вътреклетъчните сигнални пътища, които контролират клетъчния растеж и пролиферация. Това увеличаване на оксидативния стрес е съчетано с намалени видове антиоксиданти и нарушаване на регулацията на метаболитните сигнални пътища. Кардиомиопатията, наблюдавана при затлъстяване, е свързана с повишена интерстициална фиброза и диастолна дисфункция. С течение на времето еволюиращите аномалии включват хипертрофия и систолна дисфункция, което в крайна сметка води до сърдечна недостатъчност.
1. Въведение
2. Кардиореналният метаболитен синдром
3. Нарушена сърдечна инсулинова метаболитна сигнализация и свързана сърдечна дисфункция
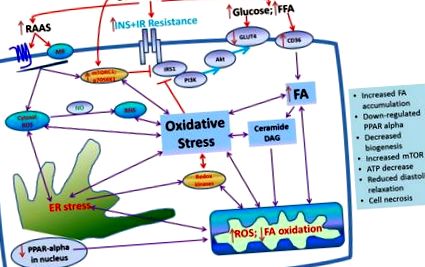
Влияние на прекомерното хранене, медиирано от инсулинова резистентност, върху развитието на клетъчен оксидативен стрес и последваща метаболитна кардиомиопатия в сърцето.
Смята се, че инсулиновият рецепторен субстрат (IRS-1) е точка на сближаване на инсулиновия сигнален път. Сериновото фосфорилиране върху множество остатъци от IRS-1 намалява неговата тирозин фосфорилация и метаболитна сигнализация надолу по веригата. Въпреки че са известни множество кинази, които серин-фосфорилират IRS-1, пътят на mTOR/S6K1 е особено важен при хранителното и медиирано от стреса IRS-1 сериново фосфорилиране (11–13, 20). Благоприятното въздействие на инсулина върху сърцето се медиира от IRS-1/PI3K/Aktsignaling пътека, която насърчава усвояването на глюкозата в миокарда, НЕ медиирания кръвен поток и диастоличната релаксация. на инсулиновата метаболитна сигнализация в сърцето (21–23). Прекомерното хранене и излишното активиране на RAAS все повече се признават, че имат интерактивно действие върху стимулирането на mTOR/S6K1 сигнализиране, което от своя страна отслабва инсулинометаболитната сигнализация в сърдечно-съдовите тъкани (5,11). Скорошна работа от нашата лаборатория показва, че Ang II активира S6K1 в сърдечната и съдовата тъкан и води до намалена инсулинова метаболитна сигнализация и биологични последици, като нарушена NO-медиирана съдова релаксация и нарушено използване на глюкоза в миокарда и диастолна релаксация (11).
Фосфорилирането на S6K1 от mTOR в сърцето се медиира от mTOR комплекс 1 (mTORC1), който е чувствителен към рапамицин. Сърдечната свръхекспресия на mTOR предпазва от сърдечна дисфункция след претоварване на налягането в лявата камера (LV). Освен това, аблация на раптор, протеиновото скеле, което медиира образуването на mTORC1 и активирането на субстрата на mTOR, води до нарушаване на адаптивната хипертрофия и причинява сърдечна недостатъчност при мишки (2,11). Тези наблюдения предполагат, че активирането на mTORC1 при определени обстоятелства може да има кардиозащитен ефект и подчертават необходимостта от по-добро разбиране на mTOR-медиираната сигнализация при сърдечна патология. Имаме доказателство, че cardiacmTOR се активира при инсулиноустойчиви плъхове Zucker със затлъстяване, но не се активира в сърдечните тъкани на диабетни мастни плъхове Zucker. Предполага се, че липсата на активиране на mTOR в сърдечната тъкан при условия на диабет, предизвикан от затлъстяване, може да бъде метаболитен превключвател, свързан с дефицит на инсулин и по-напреднала диабетна кардиомиопатия (11). Последните проучвания от нашата група също започнаха да разкриват кръстосани разговори между RAAS и mTORC1, медиирани от рецептора за ангиотензин тип 2 (AT2R), и следователно възможното съществуване на адаптивен полезен mTOR-AT2R сигнален цикъл.
4. Дисрегулация на сърдечната мастна киселина и метаболизма на глюкозата
5. Развитие на метаболитна кардиомиопатия
- Метаболитно топене (90-дневно предизвикателство за загуба на мазнини)
- Метаболитен синдром при деца на възраст от 6 до 11 години, Ал Айн, Обединени арабски емирства Роля на затлъстяването
- Метаболитен синдром и доброкачествена простатна хиперплазия Актуализация - ScienceDirect
- Метаболитен синдром Как идеалният протеин помага да влезе във форма
- Метаболитен синдром при деца и юноши