Резюме
Ограничаването на протеините по време на лактация се използва като модел на метаболитно програмиране на плъхове за изследване на въздействието на перинаталното недохранване върху метаболизма при възрастни. За разлика от ограничаването на протеина по време на живота на плода, изглежда, че ограничаването на протеините по време на лактация не причинява нито затлъстяване, нито отличителните белези на метаболитния синдром, като хиперинсулинемия, когато индивидите достигнат зряла възраст. Ограничението на протеините обаче провокира поднормено тегло и хипоинсулинемия. Този преглед е фокусиран върху регулирането на секрецията на инсулин и влиянието на автономната нервна система (ANS) при възрастни плъхове, които са били недохранени с протеини по време на лактация. Наличните данни по темата предполагат, че перинаталната фаза на лактацията, когато е обидена от протеинов дефицит, отпечатва метаболизма на възрастните и по този начин променя гликемичния контрол. Въпреки че хипоинсулинемията програмира възрастни плъхове за поддържане на нормогликемия, β-клетките на панкреаса са по-малко чувствителни към стимули за секреция, като глюкоза и холинергични агенти. Тези дисфункции на панкреаса могат да се отдадат на дисбаланс на активността на ANS, регистриран при възрастни плъхове, които са имали ограничение на протеините на майката.
Въведение
Хипотезата за развитието на здравето и болестите (DOHaD), която предвижда, че метаболитни заболявания при възрастни могат да бъдат програмирани по време на перинаталния етап, е тествана в няколко експериментални животински модела. Голям брой доказателства сочат, че етиологията на затлъстяването е свързана не само с изобилието от храна, но и с ограничаването на храната през ранния живот [1–5]. Съществуват многобройни данни, които показват, че лишаването от хранителни вещества за плода увеличава риска от развитие на метаболитно заболяване в живота на възрастните [6, 7]. Лактацията, подобно на живота на матката, е много важна фаза за развитието на мозъка, по-специално при видовете гризачи и по този начин представлява друг чувствителен прозорец, през който хранителните обиди могат да доведат до програмиране на метаболитно заболяване при възрастни [8, 9]. Всъщност прекомерното хранене по време на лактация провокира затлъстяване и хиперинсулинемия, наред с други отличителни белези на метаболитния синдром, докато при хранене трайно намалява телесното тегло и причинява метаболитни промени. Тъй като инсулинът играе ключова роля в генезиса на метаболитно заболяване, този преглед ще бъде посветен на ефектите от недохранването по време на кърмене върху регулирането на секрецията на инсулин чрез предполагаеми модификации на автономната нервна система (ANS).
Автономна нервна система и метаболизъм
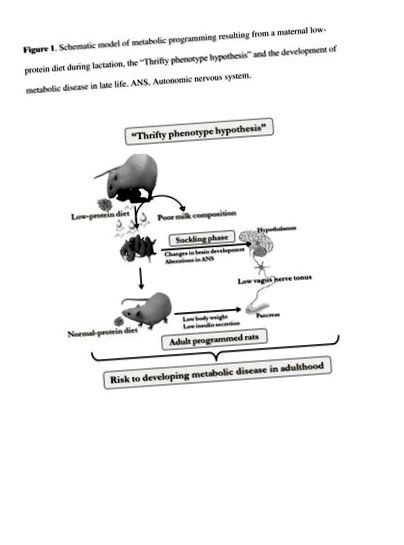
Много внимание е отделено на инсулина върху секрецията, която се наблюдава при затлъстяване. Предполага се, че дисбалансът на активността на ANS е една от причините, наред с другите, за тази дисфункция на β-клетките на панкреаса. При затлъстели хора и гризачи се наблюдава висока активност на блуждаещия нерв, докато се съобщава за намален симпатиков тонус [20–23]. Въпреки това, въпреки че по-малко внимание е било съсредоточено върху патофизиологията на появата на телесно поднормено тегло, няколко проучвания съобщават, че активността на ANS се променя при недохранени или недохранени организми [24, 25]. След отбиването плъховете, хранени с хронично дефицитна на протеини диета, показват ниска активност на блуждаещия нерв, докато се регистрира висока симпатикова активност и тези данни са в съгласие с ниския инсулинов отговор на глюкозата [25]. В друго проучване, панкреатичните островчета, изолирани от плъхове с ограничен протеин, показват слаби глюкозни и холинергични инсулинови тропични отговори [24], което предполага, че дисфункцията на панкреатичните β-клетки може да се отдаде на променена активност на ANS при тези животни с поднормено тегло, както е представено на схематична фигура 1.
Схематичен модел на метаболитно програмиране, произтичащо от диета при майките с ниско съдържание на протеини по време на лактация, „хипотезата на пестелив фенотип“ и развитието на метаболитно заболяване в късния живот. ANS, Автономна нервна система.
Изобилието или ограничението на храна по отношение на контрола на телесното тегло включва промени в метаболитната хомеостаза и активността на баланса на АНС. Въпреки че секрецията на инсулин от β-клетките на панкреаса е повишена при хора с наднормено тегло, тя е намалена при хора с поднормено тегло. Промените в активността на ANS могат да представляват механизмите, лежащи в основата на β-клетъчната дисфункция: високият тонус на ПНС, наблюдаван при индивиди със затлъстяване, непрекъснато усилва секрецията на инсулин, докато ниската активност, съобщавана при индивиди с поднормено тегло, е свързана със слаб холинергичен тропичен ефект на инсулина [26].
С нарастващата епидемия от затлъстяване в световен мащаб, включително огромни популации в развиващите се страни, като Китай, Индия, Мексико и Бразилия, причините за тази здравна и икономическа катастрофа са все по-често изследвани [27–30]. Добре известно е, че метаболитният синдром и затлъстяването показват висока корелация с ниски или отсъстващи физически упражнения и консумацията на богати на калории диети в развиващите се страни; въпреки това, въпреки че обитателите в действителност могат да преживеят хранителен преход, високите нива на наднормено тегло и индивиди със затлъстяване не биха могли да бъдат оправдани единствено чрез диета и физическо бездействие, други отличителни белези, като метаболитно програмиране от подхранването в началото на живота и епигенетична модификация също могат да бъдат подчертавайки настъпването на затлъстяването.
При хранене в началото на живота и епигенетични модификации рискът от асоциация с метаболитни заболявания
Хранителни ограничения за плода: риск от поява на затлъстяване
Преди две десетилетия беше забелязано, че ниското тегло при раждане е свързано с хронични нетрансмисивни заболявания за възрастни, като диабет тип 2, сърдечно-съдови заболявания и затлъстяване [2]. Предполага се, че хранително увреждане по време на перинаталния растеж, включително маточен и ранен постнатален живот, може да допринесе за адаптиране на метаболизма при възрастни към хранителни ограничения. Ако обаче се предлага обилна диета на хора, които са били недохранени по време на перинаталния живот, тази възможност предизвиква метаболитна промяна към съхранението на енергия и натрупване на висока мастна тъкан, което води до високи рискове от началото на метаболитни/коронарни заболявания [1]. Тези наблюдения доведоха до въвеждането на термина DOHaD (Развитие на произхода на здравето и заболяванията), известен преди като хипотеза за пестелив фенотип на Barker [41]. Понастоящем концепцията за DOHaD се разпростира върху всякакви други обиди по време на перинаталния живот, бременността и/или кърменето, като майки с поднормено тегло, с наднормено тегло, диабетици или хиперплази. Тази концепция включва също всеки тип стресови ситуации, които могат да предразположат бебета или малки към развитие на метаболитни нарушения, когато достигнат зряла възраст [42–47].
Дефицитът на храна в периода на кърмене не причинява затлъстяване
Полов диморфизъм при метаболитно програмиране
Важно е, че някои дисфункции, свързани с метаболитното програмиране, не са сходни между мъжете и жените. Тези дисфункции зависят не само от прозореца, в който се е появило хранителното нарушение (под/над храненето), но и от физиологичните различия между половете [60–62]. Както беше съобщено по-рано, глюкозната хомеостаза, инсулиновата чувствителност, функцията на бета-клетките на панкреаса и депотата на мастната тъкан, наред с други метаболитни отличителни белези на зрялата възраст, се променят чрез ранно ограничаване на протеините на майката [63–67]. Тези промени, включително техния размер, се изразяват по различен начин както при женски, така и при мъжки плъхове. Недохранването с протеини по време на лактация причинява по-голяма инсулинова чувствителност при мъжете, отколкото при жените [63, 67], и това се наблюдава и когато настъпва ограничение на протеините по време на бременност и кърмене, което води до по-висока инсулинова чувствителност при мъжете [66, 67], докато инсулинът резистентност се наблюдава при жени [65]. Съобщават се обаче и противоречиви данни [64]. Наблюдават се разлики в нарушенията на глюкозната хомеостаза в зависимост от пола при възрастни плъхове, които са били ограничени преди раждането с протеини; обаче периодът на хранителна обида е важен за определяне както на величината, така и на качеството на метаболитното нарушение.
Програмиран метаболизъм и процес на свързване на секреция на инсулин
Програмиран метаболизъм и инсулинови тропни ефекти на невротрансмитерите
Заключения
Към днешна дата доказателствата сочат, че ограничаването на протеините при майката по време на лактация програмира метаболизма, за да запази по-малко енергия в зряла възраст. Въпреки че няколко проучвания показват, че перинаталните хранителни промени модифицират както стресовите невроендокринни системи, включително оста хипоталамус-хипофиза-надбъбречна жлеза, така и симпатоадреналната система, в този контекст се знае малко за ПНС. Всеки аспект на тази система обаче участва в регулирането на енергийния метаболизъм. Ние показахме, че възрастните мъжки потомци на плъхове, чиито майки са били ограничени с протеини по време на лактация, показват ниска PNS активност. Лактацията на гризачи е решаваща фаза за развитието на мозъка и може да се счита за подобна на последната една трета от периода на човешката бременност [9, 87]. Въпреки че механизмът, по който рестрикцията на протеини по време на лактация предизвиква постоянни промени в метаболизма, все още е до голяма степен неизвестен, доказателствата сочат, че промените в ANS могат да допринесат за нарушаване на гликемичната хомеостаза при метаболитно програмирани плъхове. Дали тези модификации на ANS ще благоприятстват или ще възпрепятстват характеристиките на метаболитния синдром остава спорен въпрос и този въпрос изисква по-нататъшно разследване.
Финансиране
Тази работа беше подкрепена от Бразилската федерална фондация, Conselho National de Desenvolvimento Científico e Tecnológico (CNPq), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) и Paraná Science Foundation (Fundação Araucária).
- Метаболитни фактори в началото на бременността, свързани с гестационен захарен диабет при нормално тегло
- Ранни признаци на множествена склероза Rush System
- Регулиране на централната нервна система на хранителни прозрения от изображения на човешки мозък
- Сигнализация за хранителни вещества в централната нервна система Регулирането на енергийния баланс и бъдещето на
- РАНО; ENTERAL; ХРАНЕНЕ; IN; СЛУЧАИ; НА; ИЗПЪЛНЕНИЕ; НА ЧРЕВОТА; С; ПЕРИТОНИТ