Резюме
Въведение
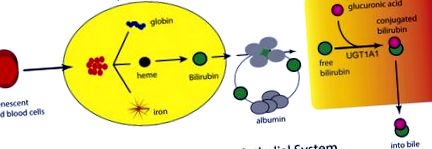
Освобождаване на билирубин в кръвта и транспорт до черния дроб. Бързото увеличаване на кислорода след раждането стимулира производството и стареенето на червените кръвни клетки, което води до освобождаването на хем от хемоглобина от ретикулоендотелната система. Хем се подлага на метаболизъм от хем оксигеназа и биливердин редуктаза, което води до производството на билирубин, който се освобождава в кръвта и се свързва със серумните протеини. След поглъщането му в черния дроб, билирубинът претърпява глюкуронизация от UGT1A1, разположен в ендоплазмения ретикулум. Билирубин-глюкуронидът излиза от хепатоцита, където преминава през жлъчните канали в лумена на червата.
В този преглед документираме, че активността на UGT1A1 се влияе от генетичния полиморфизъм и се регулира на ниво транскрипция чрез редица механизми по време на етапа на развитие; в допълнение към генетичните елементи на гена UGT1A1, ние се фокусирахме върху ролята на факторите на околната среда за модулиране на конюгационния капацитет на UGT1A1 на билирубина. Акцентира се и върху скорошни данни, получени от нови животински модели, които очертават клетъчни и молекулярни събития, възникващи в мозъка в отговор на невротоксичността на билирубина. И накрая, представяме нови доказателства, които предполагат, че метаболизмът на билирубина се осъществява както от чернодробни, така и от извънхепатални UGT1A1 дейности.
UDP-глюкуронозилтрансфераза 1А1 е основният ензим, включващ билирубинова енцефалопатия
При нормалните физиологични условия билирубинът е слабо разтворим във вода и поради това се изисква да се метаболизира, за да позволи неговото изхвърляне и екскреция. UGTs са семейство от свързани с членовете ензими, които катализират конюгацията на широк спектър от ксенобиотици и ендогенни субстрати с глюкуронова киселина (Tukey and Strassburg, 2000). От всички изоформи само UGT1A1 има физиологично значение за метаболизирането на билирубин (Bosma et al., 1994), което е ограничаващата скоростта стъпка за билирубиновата жлъчна екскреция и детоксикация. Клинични данни и експерименти с животни подкрепят факта, че независимо от факторите, допринасящи за хипербилирубинемия, детоксикацията на билирубин се определя предимно от регулаторни събития, които контролират експресията на гена UGT1A1.
Наследени мутации на гена UGT1A1 и други фактори, допринасящи за хипербилирубинемията.
Вродените вродени грешки на гена UGT1A1 са свързани с променена експресия на UGT1A1 и по този начин намаляват или напълно премахват конюгиращата активност на билирубина. Повече от 40 наследствени мутации в гена UGT1A1 са свързани с хипербилирубинемия и степента на дефицит на активност на UGT1A1 определя преди всичко тежестта на хипербилирубинемията и енцефалопатията (Tukey and Strassburg, 2000). Синдромът на Gilbert е лека форма на генетичен полиморфизъм на UGT1A1, който води до леко намаляване на активността на UGT1A1 (Kadakol et al., 2000; Strassburg, 2008), докато синдромът на Crigler-Najjar (CN) показва пълно премахване (тип 1) или силно намаляване на UGT1A1 (тип 2) (Ciotti et al., 1997). Няколко ключови мутации в кодиращата област и промоторната област на гена UGT1A1 са открити при пациенти с CN; тези мутации са свързани с намаляване или елиминиране на активността на UGT1A1 (Kadakol et al., 2000; Fujiwara et al., 2015). Клиничните данни показват, че нелекуваните бебета с CN тип 1 бързо развиват високи плазмени нива на UCB (20-50 mg/dl), излагайки ги на възможността за сериозни неврологични увреждания.
Леките форми на UGT1A1 мутации водят до доброкачествена жълтеница; обаче, когато се свързват други генетично обусловени белези, може да настъпи тежка хипербилирубинемия. Например, кърмачета, които имат хемолитични състояния, причинени от дефицит на глюкозо-6-фосфат дехидрогеназа и резус заболяване, могат да бъдат предразположени към тежка хипербилирубинемия (Huang et al., 2005; Bhutani et al., 2013). Съобщава се също, че експресията на P-гликопротеин (P-gp) в мозъка е свързана с билирубинова невротоксичност. P-gp се експресира обилно в мозъчните капилярни ендотелни клетки и астроцитите на кръвно-мозъчните бариери и има способността да транспортира билирубин от мозъка през кръвно-мозъчната бариера, като действа като мембранна ефлукс помпа (Watchko et al., 1998, 2001). В сравнение с мишки от див тип, нулевите мишки на Mdr1a (P-gp кодиращ ген) имат по-високо съдържание на мозъчен билирубин, вероятно чрез засилен приток на билирубин в мозъка, което предполага, че експресията на Pgp в кръвната бариера играе роля в защитата на централната нервна система срещу невротоксичност на билирубина (Watchko et al., 1998, 2001). В допълнение към гореспоменатите генетични фактори, недоносеността, едновременното заболяване и интервенциите, които възпрепятстват свързването на билирубин-албумин, също се считат за рискови фактори за тежка хипербилирубинемия (Bhutani and Johnson, 2009).
Експериментални модели, създадени за изследване на неонатална хипербилирубинемия и регулиране на UGT1A1.
Горният панел показва генетичния фон на мишки hUGT1A1 * 28. Горната диаграма е представяне на човешкия локус UGT1A, който е бил вмъкнат в генома на мишката (Tg-UGT1), а долната диаграма показва целевото разрушаване на локуса на мишката Ugt1 с вмъкване на неорезистиращия ген в екзон 4. Средно панел (вляво): Новороденото Ugt1 -/- проявява фенотипната черта на жълтеница с жълт цвят на кожата в сравнение с Ugt1 +/− мишки. Повечето от мишките Ugt1 -/- умират преди ден 7. Среден панел (вдясно): Експресия на UGT1A1 в новородени тъкани на черния дроб и тънките черва при hUGT1A1 * 28 мишки. Долната диаграма показва сравнения на TSB между мишките Ugt1 -/- и hUGT1A1 * 28 по време на периода на развитие.
Най-отгоре: С помощта на технологията за рекомбинация Cre-loxP беше постигнато специфично делеция на хепатоцитния или чревния ентероцит на гена Ugt1a1 (Ugt1 ΔHep или Ugt1 ΔIE). Долната диаграма показва въздействието на специфичната за тъканите делеция на гена Ugt1a1 върху нивата на серумен билирубин.
Отгоре: UFP мишки, носещи целевата конструкция. Ugt1a1loxP [FRTneoFRT] loxP се отглеждат в трансгенни мишки от Албумин-Cre, за да генерират UGT1a1F/F/Албумин-Cre мишки (UAC мишки). Средна (вляво): Сравнения на нивата на TSB между UFP и UAC мишки през периода на развитие. Средна (вдясно): Кривите на оцеляване на Kaplan-Meier анализират процентите на оцеляване на UFP и UAC мишки. Отдолу: Прекомерно високите нива на билирубин проникват в мозъка на 15-дневната UAC мишка.
Регулиране на развитието на UGT1A1.
Ясно е, че експресията на UGT1A1 е силно регулирано събитие по време на разработката. Чрез използване на hUGT1A1 * 28 мишки, проучванията показват, че намаляването на експресията на гена на UGT1A1 в черния дроб в етапа на развитие, което съответства на появата на хипербилирубинемия и високите нива на TSB, се регулира активно от прегнана X рецептор (PXR). Обратните генетични експерименти, използващи PXR-дефицитни мишки с хуманизиран UGT1 фон, демонстрират, че при липса на PXR, мишките експресират значително по-високи нива на UGT1A1 с намаляване на нивата на TSB, избягвайки тежка неонатална хипербилирубинемия (Chen et al., 2012). Тези открития категорично показват, че PXR действа като транскрипционен репресор на гена UGT1A1 през неонаталния период и това се регулира като събитие в развитието, тъй като не е наблюдавано активиране на гена UGT1A1 на черния дроб при възрастни мишки hUGT1/Pxr -/-.
Индуцирана от билирубин невротоксичност
За да се оцени ролята на оксидативния стрес при BIND, на сулфадиметоксин-индуцирани жълтени новородени Gunn плъхове са прилагани антиоксиданти, за да се промени тяхното окислително-възстановително състояние, което води до намалено липидно пероксидиране; инхибирането на оксидативния стрес обаче не е довело до блокиране на невротоксичността, тъй като тези кученца все още показват невро-поведенчески аномалии и билирубинова енцефалопатия, наподобяващи наблюдаваното при контролни кученца от плъхове на Гън при липса на антиоксиданти (Daood et al., 2012). Едно от възможните обяснения на тези резултати е, че оксидативният стрес може да се появи в по-късен, а не в начален стадий на заболяването, а реактивните кислородни видове са вторични прояви на невронална дегенерация в резултат на ранни събития, като възпалителни реакции.
Изображенията от малкия мозък, медулата, моста и мозолистото тяло показват намалена миелинизация, както се вижда от намаляването на присъствието на основния протеин на миелина (MBP, зелен) в невроните (неврофиламент, червен).
Принос на факторите на околната среда към хипербилирубинемията
Жълтеница на кърмата и ролята на екстрахепаталните UGT1A1.
Връзката между кърмата и хипербилирубинемията е описана за първи път от Arias и колеги през 1964 г. (Arias et al., 1964). Ранните проучвания на жълтеница в майчиното мляко показват метаболит на прогестерон, прегнан-3-20-дио, присъства в кърмата и е замесен в развитието на жълтеница (Hargreaves and Piper, 1971), въпреки че в крайна сметка не е постигнат научен консенсус. Към днешна дата не са демонстрирани специфични компоненти или комбинации от компоненти, които определено да допринасят за жълтеница на кърмата.
В съответствие с концепцията, че нивата на TSB са по-високи и продължават по-дълго при кърмачета, хранени с кърма, експерименти, използващи хуманизирания модел на мишка UGT1A1 * 28 (Fujiwara et al., 2012), потвърдиха, че неонаталната хипербилирубинемия, възникнала след кърмене с кърма, изчезва при мишки са били хранени с адаптирано мляко. За разлика от конвенционалните познания обаче, това проучване допълнително разкрива, че експресията на екстрахепатален UGT1A1, особено на чревния UGT1A1, подлежи на индукция чрез хранене с формула и е от решаващо значение за метаболизма и изчистването на билирубина по време на постнаталния преход на чернодробната активност на UGT1A1, който е налице само по-късно, в края на сучещия период (Chen et al., 2012; Fujiwara et al., 2012). И обратно, кърмата допринася за развитието на хипербилирубинемия чрез потискане на експресията на UGT1A1 в тънките черва. Установено е, че кърмата потиска чревната I intestB киназа α и β, което води до инактивиране на ядрения рецептор NF-ĸB и почти пълно премахване на чревната експресия на UGT1A1 (Fujiwara et al., 2012).
UGT1A1 Активиране от ксенобиотици чрез ядрени рецептори.
Модулация на експресията на UGT1A1 от химикали в околната среда.
Когато хипербилирубинемичните новородени мишки са били изложени на химикалите от околната среда арсен и кадмий, техните нива на TSB неочаквано са намалели, корелирани с повишени нива на чревна експресия на UGT1A1, без да се забелязват промени в експресията на чернодробния UGT1A1. Данни за профилиране на генната експресия и биохимични проучвания разкриват, че като мощни индуктори на оксидативен стрес, арсенът и кадмият променят редокс състоянието на червата, което води до индукция на UGT1A1 и драматично намаляване на нивата на TSB (Liu et al., 2016). Тези резултати предполагат, че модулацията на чревната активност на UGT1A1 чрез иницииране на сигналния път за оксидативен стрес може да бъде нетрадиционна алтернатива за понижаване на TSB и подобряване на хипербилирубинемия.
Алтернативни подходи за лечение на хипербилирубинемия
Трансплантация на хепатоцити и генно-трансферна терапия.
За пациентите с CNS1 фототерапията често е терапия от първа линия, но може временно да понижи серумните концентрации на билирубин и постепенно да стане неефективна след ранна детска възраст. Понастоящем чернодробната трансплантация е лечебно лечение за предотвратяване на неврологични последствия и kernicterus, но често изисква непрекъсната имуносупресия със значителни рискове (Schauer et al., 2003).
Доказателствата показват, че само ∼5% от нормалната активност на UGT1A1 е адекватно за значително понижаване на плазмената концентрация на билирубин и елиминиране на риска от керниктер (Fox et al., 1998); следователно алтернативни терапии, целящи да облекчат хипербилирубинемията с постоянна експресия на ензима UGT1A1, са в ход в експерименталния етап. Неотдавнашно проучване илюстрира, че предимството на неонаталните хепатоцити пред възрастните хепатоцити се крие във факта, че новородените хепатоцити проявяват по-добра присадка и капацитет за репопулация след трансплантация, което води до по-добър клирънс на билирубина при иктерични плъхове на Gunn (Tolosa et al., 2015). През последните десетилетия също е постигнат значителен напредък чрез генна терапия, използваща базирани на аденовирус или подобни техники, или корекция на UGT1A1 генни дефекти с насочен към мястото подход за възстановяване на ген за лечение на хипербилирубинемични животни (Li et al., 1998; Kren et al., 1999; Roy-Chowdhury et al., 2001; Bellodi-Privato et al., 2005). Проучване на генната терапия показва, че еднократна инжекция на зависим от помощник аденовирусен вектор, експресиращ UGT1A1, който специфично е насочен към чернодробната тъкан, може напълно да коригира наследствената хипербилирубинемия при плъхове Gunn с дълготрайни ефекти и ниска хронична токсичност (Toietta et al., 2005).
Администриране на албумин.
В резултат на високия афинитет на албумин към билирубин, в нормално състояние, UCB е свързан с албумин след транспортиране през циркулацията до черния дроб (Ostrow et al., 1994). Когато нивата на UCB надвишават капацитета на албумин, свободният билирубин е способен да преминава кръвно-мозъчната бариера и да се натрупва в мозъка. Следователно потенциален подход за предотвратяване на натрупването на билирубин в мозъка е да се увеличи способността за свързване на билирубин чрез добавяне на албумин. Когато хипербилирубинемичните новородени мишки, носещи наследствени мутации на Ugt1a1, са били подложени на ежедневна инфузия на албумин, те са били спасени от неврологични увреждания и леталност. Чрез увеличаване на плазмения капацитет на свързване на билирубина, албуминът мобилизира билирубина от тъканите в плазмата и води до намалени системни нива на билирубин в плазмата (Vodret et al., 2015).
Независимо от ефикасността на тези алтернативни лечения, те все още са в експериментален етап и очевидно са необходими клинични изпитвания за оценка на острата токсичност, имуногенните отговори и дългосрочния профил на безопасност, преди да могат да бъдат приложени на пазара за хора.
Разработване на терапевтични средства, насочени към индуциране на генна експресия на UGT1A1.
Използването на животински модели, като хуманизирани мишки UGT1A1 * 28, помага да се определят механизмите, които контролират неонаталната хипербилирубинемия и осигурява важно място за използване на въздействието на безопасни и терапевтични химикали за регулиране на гена UGT1A1 и по-ниски нива на TSB. Тези неинвазивни подходи могат да се възползват от доставката на лекарства директно на новородени или, като алтернатива, чрез лактация след прилагане на лекарството на кърмачки. In vivo проучвания с хуманизирани UGT1A1 * 28 мишки могат директно да използват специфични за тъканите приноси, като черния дроб и стомашно-чревния тракт, които насочват клирънса на билирубина, като същевременно могат да изследват фармакокинетичните параметри на индуциращите агенти.
Обобщение
Тежка неонатална хипербилирубинемия и профилактика на билирубинова енцефалопатия остават клинични проблеми. Клиничните данни показват, че докато физиологичната жълтеница е често срещано доброкачествено състояние, наблюдавано при новородени, допълнителни източници на хемолиза, водещи до повишен катаболизъм на хема и тежък дефицит на UGT1A1, могат да доведат до обратими или необратими невропатологични състояния. Проучванията при животни разкриват, че нивата на UGT1A1 могат да се регулират от околната среда и диетичните съединения чрез активиране на ядрени рецептори или промяна на състоянието на оксидативен стрес. Докато сложната каскада от молекулярни и клетъчни събития, водещи до индуцирана от билирубин невротоксичност и керниктер, остава непълно очертана, новите доказателства показват, че високите нива на TSB активират вродения имунитет и причиняват нарушение на миелинизацията. Тъй като научихме повече за метаболизма на билирубина и неврологичните увреждания с появата на нови токсикологични модели, някои от конвенционалните познания по отношение на хипербилирубинемията сега се оспорват: Чревният UGT1A1 е обект на регулиране на кърмата и съединенията на околната среда и играе критична роля по време на етап на развитие, когато експресията на чернодробна UGT1A1 се забавя.
Съкращения
| ВРЪЗКА | индуцирана от билирубин неврологична дисфункция |
| ЦНС1 | Синдром на Crigler-Najjar тип 1 |
| PBREM | фенобарбитал реагиращ елемент |
| P-gp | Р-гликопротеин |
| PXR | прегнан Х рецептор |
| TSB | общ серумен билирубин |
| UAC | UFP/албумин-Cre |
| UCB | неконюгиран билирубин |
| UGT1A1 | UDP-глюкуронозилтрансфераза 1А1 |
Авторски приноси
Проведени експерименти: Юе, Чен, Нгуен, Туки.
Извършен анализ на данни: Yueh, Chen, Nguyen, Tukey.
Написал или допринесъл за написването на ръкописа: Yueh, Tukey.
Бележки под линия
Написването на този преглед беше подкрепено отчасти от безвъзмездни средства за обществено здравеопазване [ES010337, GM086713, GM100481, R21ES024818 и R21ES023906].
- Генетични и екологични влияния върху затлъстяването SpringerLink
- Диетичното качество влияе върху микробиомния състав в лигавицата на дебелото черво на човека - ScienceDaily
- Диетата влияе върху асоциациите гостоприемник и микробиота в Drosophila PNAS
- Диетата влияе върху лечението на хеликобактер пилори - Тайландски медицински новини
- Екзогенният диетичен кетонен естер намалява телесното тегло и затлъстяването при мишки, настанени в