Отдел по детска ендокринология, Катедра по педиатрия и заразни болести, Медицински факултет на Университета в Мичиган, Ан Арбър, Мичиган
Отдел по детска ендокринология, Катедра по педиатрия и заразни болести, Медицински факултет на Университета в Мичиган, Ан Арбър, Мичиган
Отдел по детска ендокринология, Катедра по педиатрия и заразни болести, Медицински факултет на Университета в Мичиган, Ан Арбър, Мичиган
Отдел по детска ендокринология, Катедра по педиатрия и заразни болести, Медицински факултет на Университета в Мичиган, Ан Арбър, Мичиган
Адрес за заявки за повторно отпечатване и друга кореспонденция: К. Сингър, катедра по педиатрия, Отдел по детска ендокринология, Унив. на Michigan Medical School, D1205 MPB, 1500 E. Medical Center Dr., Ann Arbor, MI 48109 (e-mail: [имейл защитен]).
Резюме
В клиничните и животински проучвания е добре известно, че жените и мъжете имат различен риск от заболяване, както и различна физиология на заболяването. Жените в репродуктивна възраст са защитени от метаболитни и сърдечно-съдови заболявания в сравнение с жените и мъжете в постменопауза. Повечето проучвания на мишки са насочени към използването на мъжки мишки за изследване на метаболитна дисфункция, предизвикана от затлъстяване, поради подобна защита при женски мишки. Изследвахме диетичното затлъстяване при модел на мишка и директно сравнихме възпалителните реакции при мъже и жени. В този преглед ще обобщим това, което е известно за половите различия при индуцирано от диетата възпаление и ще обобщим нашите данни по тази тема. Ясно е, че половите разлики в индуцираната от диетата възпалителна активация с високо съдържание на мазнини се дължат на вътрешно присъщи разлики в хематопоетичните реакции на обезогенните сигнали, но са необходими допълнителни изследвания, за да се разбере какво води до сексуално диморфни реакции.
Глобалните нива на затлъстяване са нараснали драстично през последните няколко десетилетия, като около един на всеки три лица в момента са категоризирани като затлъстели (34). Общата честота на свързани със затлъстяването заболявания като диабет и сърдечно-съдови заболявания (ССЗ) също продължава да нараства в резултат (3а). Затлъстяването се проявява в резултат на дисбаланс на калориен прием и разход на енергия. Основен фактор, допринасящ за увеличаването на нивата на затлъстяване, е увеличаването на консумацията на калорични храни, богати на наситени мастни киселини (4). С увеличената консумация на храни с високо съдържание на мазнини хората натрупват телесни мазнини и по този начин имат повишен риск от развитие на заболявания, свързани със затлъстяването. В този кратък преглед ще наблегнем на ефектите от затлъстяването, предизвикано от диетата, като се фокусираме предимно върху сексуално диморфните реакции на диетата с високо съдържание на мазнини (HFD), подготвяне на имунната система.
Отговорът на индивида към HFD зависи от няколко фактора, включително пол, възраст и етническа принадлежност. Това, което става все по-фрапиращо, е че има явен сексуален диморфизъм при затлъстяването и диабета. Докато процентите на затлъстяване са по-високи при жените (34), мъжете имат по-висок процент на сърдечно-съдови заболявания (ССЗ) и диабет тип 2 (30, 36), което предполага, че жените са защитени от неблагоприятните ефекти на затлъстяването (30). Това е от особено значение, тъй като при изследване на диабет и ССЗ са проведени много предклинични проучвания само при мъже, оставяйки пропуски в познанията ни относно сексуално диморфните реакции на затлъстяването (45). Поради това се създават насоки и терапии въз основа на разследвания при мъже, но се прилагат при мъже и жени (13).
Важно е да се изследват мъжете и жените, за да се разберат факторите, допринасящи за тези разлики, специфични за пола. Предишни проучвания са фокусирани върху променената хормонална среда, анатомичното разпределение на мазнините (17, 19) и разликите в разхода на енергия. Установено е, че жените имат 10% по-високо общо съдържание на телесни мазнини в сравнение с мъжете със същия индекс на телесна маса (ИТМ) (15). Този диморфизъм е особено дълбок при лоши социално-икономически условия, докато по-богатите среди показват по-малка вариация в затлъстяването между половете (11). Това предполага, че естрогенът до голяма степен влияе върху натрупването на мазнини, независимо от социално-икономическия статус (11). Освен това, при съвпадение на затлъстяването, женските показват по-голям обем подкожна мазнина от мъжете, докато мъжете имат по-голям обем интраабдоминална или висцерална мастна тъкан (5, 9). Известно е също, че жените имат по-високи нива на разход на енергия (47, 49). Съществуват ограничени данни, които обясняват това, но те показват увеличение на кафявата мастна тъкан (НДНТ) при жените (17), а скорошни проучвания показват ролята на естрогена в половите разлики в мускулния метаболизъм (40). Установено е също, че естрадиолът може да повлияе на мозъка да намали приема на храна и да стимулира доброволното упражнение, независимо от метаболитните му ефекти (51).
Преобладаването на метаболитния синдром се увеличава с възрастта, тъй като жените се сблъскват с по-високи ИТМ (1), което показва загуба на присъщата защита. Един фактор, който допринася за това, е менопаузата. Клинично по време на менопаузата има промяна в нивата на циркулиращия естрадиол и увеличаване на съотношението на андрогените, което поставя жените в повишен риск от ССЗ и диабет тип 2 (36, 42). По-конкретно, ниските нива на глобулин, свързващ половите хормони (SHBG), високите нива на свободен андроген и ниските нива на естрадиол са замесени в риска от ССЗ при жени в перименопауза (48). При модели на мишки използването на яйчникова недостатъчност за имитиране на настъпването на менопаузата съответства на повишаване на инсулиновата резистентност (42). В този модел на мишка началото на инсулиновата резистентност е предотвратено след овариална недостатъчност с помощта на естроген заместителна терапия (17-β естрадиол), като по този начин допълнително се доказва значението на половите хормони върху проявата на метаболитни заболявания (42).
Докато половите хормони са логично обяснение за мъжките и женските диференциални отговори на затлъстяването, клиничните проучвания, които са използвали естроген-заместителни терапии, не са били успешни в предотвратяването на сърдечно-съдови заболявания (26). По този начин е необходимо по-нататъшно проучване в нови области на разследване, за да се запълнят пропуските в нашето разбиране за това, което свързва затлъстяването със заболявания при мъжете и жените.
Затлъстяването е свързано с хронично възпаление
Банкоматите, наети по време на затлъстяване, насърчават инсулиновата резистентност
Макрофагите все повече участват в допринасянето за метаболитни заболявания. Като ключови медиатори на имунната система, макрофагите играят много роли както в вродения, така и в адаптивния имунитет: те разпознават и извършват фагоцитоза на микроби, паразити и чужди вещества; освобождават цитокини; секретират хемоаттрактанти за набиране на други имунни клетки; и представят чужди антигени на лимфоцитите (10). Макрофагите се намират в почти всички тъкани и имат различни популации и свойства, определени от тяхната среда (53). По време на нормалното хомеостатично състояние има резидентни тъканни макрофаги, представляващи между 10 и 15% от всички клетки в чистата висцерална мастна тъкан (53). По време на затлъстяването обаче се увеличава макрофагите на възпалителната тъкан, което може да ги накара да представляват между 45 и 60% от всички клетки във висцералната мастна тъкан (53).
Идентифицирани са два различими типа банкомати: вербувани банкомати, които се срещат предимно при затлъстели индивиди и показват класически модел на активиране на М1, и резидентни банкомати, открити предимно при слаби индивиди, които имат алтернативно активиране, подобно на М2 макрофагите ( 23). Наетите банкомати се регулират чрез MGL1, рецептор на клетъчна повърхност, който контролира активирането на моноцити/макрофаги и трафика на Ly6c hi моноцити към мастната тъкан (54). Тези банкомати свръхекспресират гени, важни за миграцията на макрофагите и фагоцитозата и се различават от маркера на клетъчната повърхност CD11c, който не се среща в местните банкомати (23). Активираните банкомати се събират в области, известни като короноподобни структури (CLS), които се образуват около умиращи адипоцити. Активираните макрофаги в тези клъстери освобождават няколко възпалителни цитокини, които имат неблагоприятни ефекти върху функцията на адипоцитите, като намалено усвояване на глюкоза, медиирано от инсулин и намалена адипогенеза (23).
В среда с високо съдържание на мазнини набраните макрофаги се разширяват в мастната тъкан и се натрупват в допълнителни места, включително мозъка (21), черния дроб (16), мускулите и панкреаса (31), което води до системни възпаления и заболявания. Наскоро открихме доказателства, че фундаментални промени настъпват в хемопоетичните стволови и прогениторни клетки (HSPC) след хранене с HFD, което води до увеличаване на производството на макрофаги. Тези промени в HSPCs водят до повишено производство на гранулоцитни и макрофагични предшественици и генерират активирани моноцити, които след това се набират, за да станат активирани тъканни макрофаги (46).
Чрез тази констатация за разширяване на хематопоетичните стволови клетки (HSC) и увеличаване на миелоидния предшественик, успяхме да заключим, че диетичното грундиране на хематопоетични клетки-предшественици води до възпаление на мастната тъкан и че производството на левкоцити се засилва чрез обезогенни сигнали (46). Други групи също са установили, че при миши модели затлъстяването е двигател на пролиферацията и разширяването на миелоидните предшественици на костния мозък, с нарастваща моноцитоза и неутрофилия при затлъстели гризачи в сравнение с техните слаби колеги (33). Като цяло двигателите на това активиране на HSC при затлъстели индивиди остават нерешени.
Сексуално диморфни отговори при диета с високо съдържание на мазнини
Както беше посочено по-горе, много от горните изследвания, които са направени за характеризиране на възпалителни промени по време на затлъстяване, предизвикано от диета, са били извършвани при мъже. Доказано е, че женските мишки са защитени от инсулинова резистентност и като цяло имат потиснат отговор на HFD в лабораторията. Няколко механизма са изследвани в опит да се разбере какво предпазва жените от същите метаболитни нарушения, наблюдавани при мъжете. Досегашните изследвания в тази област показват, че мъжките и женските мишки показват дълбоки разлики в анатомичното разпределение и разширяване на мастната тъкан. Проучванията показват, че дори когато контролират диетата и други условия на околната среда, мъжките мишки показват значително по-голямо разширяване на общата телесна маса, включително подкожна мастна тъкан (SAT), висцерална мастна тъкан и черен дроб, отколкото техните женски колеги (12, 14).
За да се разберат механистичните разлики между мъжете и жените, изследванията са фокусирани върху различни хормонални модели. Сред тях е установено, че естрогенният рецептор α (ERα) е от решаващо значение за защита срещу възпаление на тъканите, наблюдавано при женски мишки (41).
Сексуално диморфни макрофагични отговори на диета с високо съдържание на мазнини
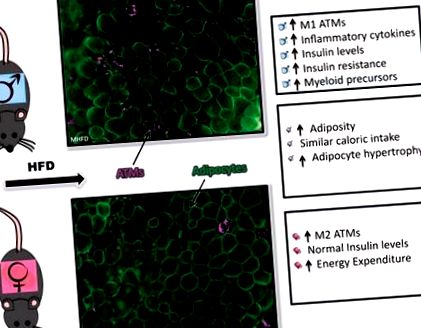
Механизмът на тази сексуално диморфна дисперсия остава загадъчен, особено по отношение на регулирането на миелоидното възпаление. За да разберем различните възпалителни отговори на HFD, разгледахме банкомати и популации на HSC/костен мозък (BM) при мъжки и женски животни на HFD (47). Използвайки 60% HFD чау на основата на свинска мас, както мъжете, така и жените успяха да наддават на тегло и затлъстяване, въпреки че мъжете натрупаха повече телесно тегло в сравнение с жените. Докато жените наддават на тегло, затлъстяване и имат адипоцитна хипертрофия при HFD, те имат нормален глюкозен толеранс и по-ниски нива на инсулин в сравнение с мъжки мишки. Когато по-нататък разгледахме възпалителните промени в мастната тъкан при мъжете след 16 седмици HFD, имаше ясно разширяване на макрофагите, по-специално на CD11c + банкоматите, които образуваха CLS. Жените също показват експанзия на макрофаги, но предимно от тип CD11c. За да разберем възпалителната среда, създадена в мастната тъкан, разгледахме експресията на гена на мастната тъкан на възпалителни цитокини и видяхме, че експресията е намалена при жените на HFD в сравнение с мъжете на HFD (47).
С нашите предишни открития, че мъжете със затлъстяване имат експанзия на HSC и миелоидни предшественици, ние оценихме моноцитите и хематопоетичните предшественици в този модел. Установихме, че докато женските имат нормални миелоидни предшественици на изходно ниво, тези клетки не се разширяват с HFD, както видяхме при мъжете. Изследвайки костния мозък ex vivo, установихме, че женската BM произвежда по-малко колонии на гранулоцити и макрофаги, отколкото мъжете след стимулация с палмитинова киселина (наситени мастни киселини) и предизвиква по-ниски цитокинови отговори на липополизахаридите (LPS) (47).
Като се имат предвид вътрешните промени в БМ, заедно със загрижеността за диференциалното наддаване на тегло и енергийните разходи при мъжете спрямо жените, следващото изпълнение на състезателна трансплантация на БМ (BMT), при което мъжки и женски костен мозък могат да бъдат оценени или при мъже, или при жени, получатели. След BMT предизвикахме животните реципиенти към HFD и установихме, че независимо от пола реципиент, мъжките BM клетки реагират на индуцирано от диетата затлъстяване, като произвеждат повече банкомати, по-специално повече CD11c + банкомати. Това предполага, че има присъща за клетките разлика в хемопоетичните реакции на затлъстяването между половете. Това може също да показва, че има постоянна промяна през целия живот в популацията на HSC предшественици след излагане на HFD (47).
През последните няколко десетилетия имаше по-добро разбиране за въздействието на затлъстяването, предизвикано от диетата, върху възпалението и инсулиновата резистентност, но продължават да съществуват значителни пропуски в нашите знания относно сексуално диморфните възпалителни реакции. Чрез използването на състезателни BMT на мъже и жени успяхме да заключим, че има вътрешен сексуален диморфизъм в костния мозък HSC и потомците на потомците в отговор на затлъстяването, предизвикано от диетата, което е независимо от диференциалното наддаване на тегло и енергийните разходи, въпреки че движещият фактор на този диморфизъм все още е неясен (фиг. 1).
Фиг. 1.Семурно диморфни възпалителни реакции на диета, индуцирано затлъстяване. Имунофлуоресценция на бялата мастна тъкан на гонадите (оцветяване за кавеолин, зелено; Mac2, магента) и обобщение на мъжките отговори (Горна част), женски отговори (отдолу) и сексуално подобни реакции (средна) до затлъстяване, предизвикано от диета. HFD, диета с високо съдържание на мазнини; ATM, макрофаг на мастната тъкан.
Изследванията в тази област установиха, че половите хормони, свойствата на адипоцитите и генетиката са ключови двигатели на мъжките и женските разлики в затлъстяването, диабета и сърдечно-съдовите заболявания. Естрогенът играе системна роля, подобрявайки енергийния баланс чрез невронални сигнали, преживяемостта на β-клетките на панкреаса, подобрения метаболизъм на липидите и инсулиновата чувствителност в черния дроб и мускулите (28). Доказано е, че ефектите на ERα се проявяват чрез активирането му в адипоцитите, особено при мъжете. В контекста на сърдечно-съдови заболявания в действителност е доказано, че миелоидно-специфичната ERα делеция предизвиква инсулинова резистентност и атеросклероза (39). Както беше споменато по-рано, овариектомизираните мишки също показват увеличение на възпалението на мастната тъкан и инсулинова резистентност (50), вероятно чрез промени в MCP1 и увеличаване на реактивните кислородни видове (ROS) след овариектомия (18).
Перспективи и значение
От векове е ясно, че има полови разлики в телесния състав и реакциите на HFD, но едва наскоро стана ясно, че има възпалителни различия между половете по отношение на възпаление, предизвикано от диетата. Констатациите от нашите проучвания и други подчертават, че не просто хормоните оказват пряко влияние върху инсулиновата резистентност, а по-скоро комбинация от телесен състав, енергийни разходи, апетит, хормонални ефекти върху производството на инсулин и възпалителни реакции към диетата създават сексуално диморфни нива на заболявания, свързани със затлъстяването. Необходимо е да се продължи по-нататъшното разследване на тези различия, за да се постигне по-добро разбиране на това, което води до клиничната парадигма на половите различия в отговор на затлъстяването.
Не се декларират конфликти на интереси, финансови или други, от автора (авторите).
- Метаболитен синдром при асоциация на възпалителни заболявания на червата с генетични маркери на затлъстяването и
- Метаболитно ремоделиране на бяла мастна тъкан при затлъстяване
- Метаболитни ефекти на упражненията върху детското затлъстяване съвременна перспектива - ScienceDirect
- Метаболитен синдром, затлъстяване и вътрешно слънце
- Метаболитни параметри и орексигенни анорексигенни фактори на затлъстяването при прозрение за синдром на Прадер-Уили