Елена Богова *, Наталия Волеводз, Валентина Петеркова и Илин Александър
Ендокринологичен изследователски център, Институт по детска ендокринология, Москва, Руска федерация
* Автор-кореспондент: Елена Богова
Ендокринологичен изследователски център, Институт по детска ендокринология
Москва, Руска федерация
Тел: +7-925-882-05-48
Електронна поща: [имейл защитен]
Дата на получаване: 10 юни 2017 г .; Приета дата: 31 юли 2017 г .; Дата на публикуване: 03 август 2017 г.
Цитат: Елена Богова, Наталия Волеводз, Валентина Петеркова, Илин Александър (2017) Метаболитни параметри и орексигенни/анорексигенни фактори на затлъстяването при синдром на Прадер-Вили. J Child Obes Vol No 2 Iss No: 3:13 doi: 10.21767/2572-5394.100034
Резюме
Синдромът на Prader-Willi (PWS) е сложно мултисистемно генетично разстройство, което възниква поради липса на експресия на наследени от баща импринтирани гени в хромозома 15 [1]. PWS е най-честата причина за синдромно затлъстяване, срещаща се при 1 от 10000–30 000 живородени [2]. Това е нарушение на невроразвитието, характеризиращо се с хипотония на новороденото и неуспех да процъфтява, последвано от бързо увеличаване на теглото на възраст между 1 и 6 години, което води до повечето пациенти с PWS да развият болестно затлъстяване и следователно преждевременна смъртност от неговите усложнения. Фенотипът PWS включва множество характеристики, повечето от които са централни по произход (температурна дисрегулация, висок праг на болка, поведенчески аномалии, хипоталамусен хипогонадизъм, дефицит на растежен хормон, централен хипотиреоидизъм, централна надбъбречна недостатъчност). Затлъстяването, най-вече поради ненаситен апетит, представлява един от най-сериозните симптоми на PWS, което води до развитие на преждевременна смъртност от неговите усложнения. Поради това се опитахме да изследваме по-дълбоко отличителни черти на затлъстяването и регулирането на апетита при пациенти с PWS.
Въведение
Синдромът на Prader-Willi (PWS) е сложно мултисистемно генетично заболяване, което възниква поради липса на експресия на наследени от баща импринтирани гени в хромозома 15 [1]. PWS е най-честата причина за синдромно затлъстяване, срещаща се при 1 от 10000–30 000 живородени [2]. Това е нарушение на невроразвитието, характеризиращо се с хипотония на новороденото и неуспех да процъфтява, последвано от бързо увеличаване на теглото на възраст между 1 и 6 години, което води до повечето пациенти с PWS да развият болестно затлъстяване и следователно преждевременна смъртност от неговите усложнения. Фенотипът PWS включва множество характеристики, повечето от които са централни по произход (температурна дисрегулация, висок праг на болка, поведенчески аномалии, хипоталамусен хипогонадизъм, дефицит на растежен хормон, централен хипотиреоидизъм, централна надбъбречна недостатъчност). Затлъстяването, най-вече поради ненаситен апетит, представлява един от най-сериозните симптоми на PWS, което води до развитие на преждевременна смъртност от неговите усложнения. Ето защо се опитахме да изследваме по-дълбоко отличителни черти на затлъстяването и регулирането на апетита при пациенти с PWS.
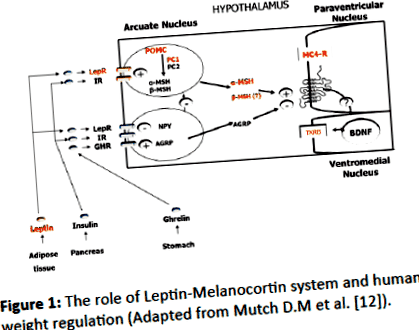
Ние оценихме метаболитните параметри на деца със затлъстяване с генетично потвърдена PWS, които не бяха лекувани с растежен хормон (GH), и сравнихме данните с възрастта, пола и BMIсъответстващите контролни групи със затлъстяване без PWS. Също така измерихме нивата на орексигенни (повишаващ се апетит) и анорексигенични фактори (намаляващ апетит), за да разберем тяхната роля в PWS. Предполага се, че „PWS регионът“ (15q11-q13) съдържа гени, които са прекомерно експресирани в хипоталамуса и кодират протеини, критични за развитието на мозъка, функцията, а също и за регулирането на апетита. Механизмът на ситост/глад е под невроендокринен контрол на централните и периферните пептиди (Фигура 1).
Фигура 1: Ролята на системата лептин-меланокортин и регулирането на теглото на човека (адаптиран от Mutch D.M et al. [12]).
Предмети и методи
17 затлъстели (ИТМ SDS = 3,66 [2,99 ÷ 4,57]), нелекувани с GH деца с PWS (6 момчета, 11 момичета) на средна възраст 9,9 години [6,5 ÷ 13,9] бяха сравнени с 15 деца със затлъстяване (OC) на сходна възраст (9,8 [6,5 ÷ 12,0] години), пол (4 момчета, 11 момичета) и ИТМ (3,21 [2,76 ÷ 3,62] SDS). Всички деца, включени в проучването, са били преди пубертета (етап на Танер 1).
Пациентите с PWS са били генетично потвърдени (PCR, специфичен за метилации). Субектите с хронични вторични заболявания като захарен диабет, чернодробно или бъбречно заболяване или активно злокачествено заболяване или тези, които приемат изследвани лекарства, бяха изключени. Тематичните характеристики и сравнения са показани в маса 1.
| Възраст (години) | 9,9 [6,5 ÷ 13,9] | 9,8 [6,5 ÷ 12,0] | р = 0,82 |
| Мъже/жени | 06-ноем | 04-ноем | р = 0,85 |
| Танер етап | 1 | 1 | р = 0,4 |
| ИТМ на SDS | 3,66 [2,99 ÷ 4,57] | 3,21 [2,76 ÷ 3,62] | р = 0,2 |
| Височина на SDS | -0,02 [-1,29 ÷ 0,49] | 1,74 [1,06 ÷ 2,65] | p = 0,0001 * |
| Маслена маса (%) | 53,05 [48,75 ÷ 56,5] | 42,2 [40,5 ÷ 45,0] | Ã ? â ? Ã ? â ? ¬ = 0,04 * |
| Постна маса (%) | 46,95 [43,5 ÷ 51,25] | 57,8 [55,0 ÷ 59,5] | Ã ? â ? Ã ? â ? ¬ = 0,04 * |
Маса 1: Характеристики на PWS и OC.
Физическият преглед включваше определяне на ръст и тегло. Височината на стойката се определя от Harpenden Stadiometer (Holtain Limited, Crymych, Dyfed, UK).
Теглото на тялото се измерва с точност до 0,1 kg, като се използва стандартно оборудване. ИТМ се определя като тегло в килограми, разделено на квадратен ръст в метри. Стандарти за специфична за възрастта и пола височина (Tanner JM, Whitehouse RH, 1976) и BMI процентили (Cole TJ, 2000) бяха използвани за изчисляване на оценка на стандартно отклонение (SDS), както и за класифициране на децата като затлъстели ( BMI 2.0 SDS).
Всички кръвни проби бяха събрани сутрин след 12-часов пост през нощта. Лабораторните измервания включват серумна глюкоза, лептин, инсулин, инсулиноподобен растежен фактор 1 (IGF-1), липиди (общ холестерол, липопротеин с висока плътност (HDL), липопротеин с ниска плътност (LDL), триглицериди), аспартат аминотрансфераза (AST ), аланин аминотрансфераза (ALT), гладен и постпрандиален серумен мозъчен невротрофичен фактор (BDNF) и плазмен грелин. Концентрацията на инсулин и IGF-1 се измерва чрез хемилуминесцентен имунометричен анализ, като се използват анализатори Cobas 6000 (Roche) и Liaison (Dia Sorin). Нивата на лептин се определят с помощта на ензимен имуноанализ. Индексът на хомеостазния модел на инсулинова резистентност (HOMA-IR) беше изчислен, като се използва инсулин на гладно и концентрации на глюкоза (глюкоза на гладно x инсулин на гладно/22,5). Общите нива на грелин и серумен BDNF на гладно и след хранене (на 60 минути и 120 минути) са измерени по време на тестване на смесено хранене (370 kcal: 20% протеин, 50% въглехидрати и 30% мазнини), като се използват търговски ензимни имуноанализ (Phoenix Pharmaceuticals Inc. и системи за научноизследователска и развойна дейност). Кръвни проби за оценка на грелин се събират в епруветки, съдържащи EDTA, с епруветки апротинин и се съхраняват при 70 ° С до 1 месец.
Съставът на тялото беше оценен чрез двуенергийна рентгенова абсорбциометрия (DEXA).
Статистическите анализи бяха извършени с помощта на Statistica за Windows v.8.0. Данните са представени като среден и интерквартилен диапазон. Тест на Ман-Уитни, използван за сравняване на 2 групи. За определяне на статистическата значимост са използвани стойности на Р на стандартно ниво 0,05.
Резултати
Подробностите за измерванията на пациентите са описани в Таблица 2.
| Лептин (ng/ml) | 85,05 [43,7 ÷ 117,45] | 37,2 [27,7 ÷ 44,90] | Ã ? â ? Ã ? â ? ¬ = 0,02 * |
| IGF-1 (ng/ml) | 84,5 [52,7 ÷ 173,3] | 238,2 [221,9 ÷ 323,8] | p = 0,0003 * |
| Инсулин (U/l) | 9,7 [5,4 ÷ 15,45] | 12,6 [8,2 ÷ 18,5] | р = 0,38 |
| Глюкоза (mmol/l) | 4,55 [4,0 ÷ 5,0] | 4,75 [4,2 ÷ 5,1] | р = 0,37 |
| HOMA-IR | 1,44 [1,04 ÷ 2,05] | 2,74 [1,9 ÷ 3,95] | p = 0,01 * |
| Общ холестерол (mmol/l) | 4,9 [4,3 ÷ 5,6] | 4,06 [3,7 ÷ 5,1] | р = 0,08 |
| LDL (mmol/l) | 3,18 [2,45 ÷ 4,0] | 2,8 [2,0 ÷ 3,1] | р = 0,13 |
| HDL (mmol/l) | 1,1 [0,87 ÷ 1,5] | 0,97 [0,88 ÷ 1,2] | р = 0,42 |
| Триглицериди (mmol/l) | 0,8 [0,7 ÷ 1,1] | 1,05 [0,95 ÷ 1,25] | р = 0,07 |
| Ã ? Â ? Ã ? Â ? LT (U/l) | 25,75 [18,0 ÷ 42,7] | 18,15 [18,0 ÷ 22,0] | р = 0,1 |
| Ã ? Â ? Ã ? Â ? ST (U/l) | 27,0 [24,5 ÷ 36,15] | 23,5 [21,0 ÷ 25,0] | р = 0,05 |
Таблица 2: Измервания на PWS и OC.
В сравнение с OC, децата с PWS на сходна възраст, пол и ИТМ са имали SDS с по-нисък ръст (-0,02 [0,49 ÷ 1,78] срещу 1,74 [1,06 ÷ 2,65], p = 0,0001) и нива на IGF-1 (84,5 [52,7 ÷ 173,30 ]) спрямо (238,2 [221,9 ÷ 323,8], p = 0,0003). Изследванията на телесния състав показват повишено телесно съдържание на мазнини при деца с PWS в сравнение с контролната група на OC (53.05 [48.75 ÷ 56.5] срещу 42.2 [40.5 ÷ 45.0]%, Ã ? â ? Ã ? â ? ¬ = 0,04, съответно) и намалена чиста маса (46,35 [42,7 ÷ 49,85] срещу 57,80 [55,0 ÷ 59,5]%, Ã ? â ? Ã ? â ? ¬ = 0,04). В сравнение с OC, нивата на лептин са били почти 2 пъти по-високи при PWS (85.05 [43.7 ÷ 117.45] срещу 37.2 [27.7 ÷ 44.9] ng/ml, Ã ? â ? Ã ? â = 0,02 ); за разлика от това, няма значителни разлики в общия холестерол, липопротеините с висока плътност (HDL), липопротеините с ниска плътност (LDL), триглицеридите, AST, ALT между две групи. HOMA-IR е по-нисък при PWS в сравнение с OC (1.44 [1.04 ÷ 2.05] срещу 2.74 [1.9 ÷ 3.95], p = 0.01), което предполага, че децата с PWS са по-чувствителни към инсулина.
Концентрация на грелин на гладно (1,0 [0,5 ÷ 1,0] срещу 0,23 [0,13 ÷ 0,30] ng/ml, Ã ? â ? Ã ? â = 0,028) и нива на грелин след хранене за 60 и 120 минути ( 0,47 [0,4 ÷ 1,0] срещу 0,18 [0,11 ÷ 0,31], p = 0,00039 и 0,5 [0,37 ÷ 1,0] срещу 0,14 [0,11 ÷ 0,28] ng/ml, p = 0,000025) са значително по-високи при деца с PWS в сравнение с OC (Фигура 2).
Фигура 2: Нива на грелин на гладно и след хранене (ng/ml) в PWS и OC по време на теста със смесено хранене.
Няма значими разлики в базалните (22,8 [15,7 ÷ 29,19] срещу 18,42 [10,40 ÷ 28,50] ng/ml, p = 0,54) и постпрандиалните анорексигенни нива на BDNF на 60 и 120 минути между PWS и OC (27,7 [21,4 ÷ 30,27 ] срещу 22,53 [13,02 ÷ 26,20], p = 0,43 и 24,62 [18,56 ÷ 27,75] срещу 17,53 [11,08 ÷ 25,50] ng/ml, p = 0,21) (Фигура 3).
Фигура 3: Нива на грелин на гладно и след хранене (ng/ml) в PWS и OC по време на теста със смесено хранене.
Дискусия
Концентрацията на анорексигенен хормон лептин е по-висока при пациенти с PWS в сравнение с OC. Както е известно, лептинът се секретира от мастните клетки (адипоцитите) право пропорционално на количеството складирана мазнина. Следователно, наблюдаваната хиперлептинемия отразява високото ниво на затлъстяване при пациенти с PWS [10]. Изследване на телесния състав показва повишена телесна мазнина и намалена чиста маса при деца с PWS в сравнение с OC, което в комбинация с нисък ръст и нисък IGF-1 предполага, че пациентите с PWS имат дефицит на растежен хормон.
Различни пептиди и хормони са проучени при пациенти с PWS, но все още няма точно безпокойство относно механизма на PWS хиперфагия. Вероятно не един, но много фактори биха могли да изиграят роля за повишен апетит на пациентите с PWS.
Заключения
Наблюдаваните деца с PWS имат нисък ръст, ниски нива на IGF-1 и ненормален телесен състав с повишени телесни мазнини и намалена чиста телесна маса, наподобяващи пациенти с дефицит на растежен хормон. Нивата на лептин при деца с PWS са по-високи, отколкото при OC, отразявайки степента на затлъстяване. HOMA-IR е по-нисък при PWS в сравнение с OC, което предполага, че децата с PWS са по-чувствителни към инсулин от пациентите с «просто затлъстяване». Това може да предполага различна роля на инсулина в патогенезата на метаболитните промени в PWS в сравнение с обикновеното затлъстяване. Нивата на орексигенен грелин на гладно и след хранене са значително по-високи при деца с PWS в сравнение с контролите със затлъстяване, което показва наличието на присъща хиперфагия при пациенти с този синдром. Няма значителни разлики в базалните и постпрандиалните анорексигенни нива на BDNF между децата с PWS и OC, но са необходими допълнителни изследвания, за да се изясни ролята на BDNF и неговия рецептор за намаляване на теглото, енергийни разходи и контрол на апетита при PWS.
- Метаболитен синдром, адипокини и хормонални фактори при фармакологично нелекувани възрастни възрастни хора
- Параметри на затлъстяването при синдром на поликистозните яйчници
- Молекули Специален брой Заместители на захарта и затлъстяване, диабет и метаболитен синдром
- Профилактика на сърдечно-съдови заболявания Затлъстяване, диабет и метаболитен синдром
- Затлъстяването и метаболитният синдром при детски псориазис - ScienceDirect