Питър Х. Гоф
отдел по микробиология, Icahn School of Medicine в планината Синай, Ню Йорк, Ню Йорк, САЩ
b Завършило училище по биомедицински науки, Медицинско училище Icahn в планината Синай, Ню Йорк, Ню Йорк, САЩ
Томоко Хаяши
c Moores UCSD Cancer Center, University of California San Diego, La Jolla, California, USA
Wenqian He
отдел по микробиология, Icahn School of Medicine в планината Синай, Ню Йорк, Ню Йорк, САЩ
b Висше училище по биомедицински науки, Медицинско училище Icahn в планината Синай, Ню Йорк, Ню Йорк, САЩ
Шиин Яо
c Moores UCSD Cancer Center, University of California San Diego, La Jolla, California, USA
Хауърд Б. Котам
c Moores UCSD Cancer Center, University of California San Diego, La Jolla, California, USA
Gene S. Tan
отдел по микробиология, Icahn School of Medicine в планината Синай, Ню Йорк, Ню Йорк, САЩ
Брайън Крейн
c Moores UCSD Cancer Center, University of California San Diego, La Jolla, California, USA
Флориан Крамер
отдел по микробиология, Icahn School of Medicine в планината Синай, Ню Йорк, Ню Йорк, САЩ
Карън Месер
c Moores UCSD Cancer Center, University of California San Diego, La Jolla, California, USA
Миня Пу
c Moores UCSD Cancer Center, University of California San Diego, La Jolla, California, USA
Денис А. Карсън
c Moores UCSD Cancer Center, University of California San Diego, La Jolla, California, USA
Питър Палезе
отдел по микробиология, Icahn School of Medicine в планината Синай, Ню Йорк, Ню Йорк, САЩ
d Катедра по медицина, Icahn School of Medicine в планината Синай, Ню Йорк, Ню Йорк, САЩ
Maripat Corr
e Катедра по медицина, Калифорнийски университет, Сан Диего, La Jolla, Калифорния, САЩ
РЕЗЮМЕ
ВАЖНОСТ Необходимо е разработване на нови адюванти, за да се подобри имуногенността, за да се осигури по-добра защита от инфекция със сезонен грипен вирус и да се подобри готовността за пандемия. Тук показваме, че няколко дозови комбинации от синтетични TLR4 и TLR7 лиганди са мощни адюванти за индуциране на рекомбинантен грипен вирус хемаглутинин антиген на хуморален и клетъчен имунитет срещу вирусни предизвикателства. Компонентите на комбинирания адювант действат допълнително, за да осигурят щадяща доза антиген и адювант, като същевременно запазват ефикасността си. Разбирането на механизма на действие на адювант е критичен компонент за предклиничната оценка на безопасността и ние тук демонстрираме, че комбинирани сигнали за адювант TLR4 и TLR7 чрез подходящите рецептори и адаптерния протеин MyD88. Тази нова комбинация от адюванти допринася за по-широко защитна ваксина, като същевременно демонстрира привлекателен профил на безопасност.
ВЪВЕДЕНИЕ
Грипът остава основен световен здравен проблем и ефикасността на наличните в момента ваксини е ограничена (1, 2). Грипните вируси от подтип H1 и H3 и грипните вируси В са етиологичните агенти в последните сезонни огнища (3). Грипните вируси А също са били отговорни за няколко глобални пандемии през миналия век, включително испанския грип от 1918 г. (H1N1), азиатският грип от 1957 г. (H2N2), грипния грип от Хонконг през 1968 г. (H3N2) и пандемиите от свински произход от 2009 г. (H1N1) ( 4). Съвременните противогрипни ваксини индуцират хуморална защита, която е свързана с отговор на инхибиране на хемаглутинацията (HAI) към имунодоминантната глобуларна глава (5). Докато по-голямата част от неутрализиращите антитела са насочени към епитопи в глобуларния домен на главата на вирусния хемаглутинин (HA), неговите антигенни области са силно променливи и непрекъснато се подлагат на антигенен дрейф, което води до избягване на неутрализацията, предизвикана от естествена инфекция и имунизация (3, 5) Един основен фокус на подобреното развитие на грипната ваксина е рационалният антигенен състав (6, –13). Разработването на подходящ адювант обаче може да бъде еднакво важно при оптималния дизайн на ваксината (14, –18).
Настоящите сезонни грипни ваксини се базират на прогнози за това кои щамове на грипния вирус ще циркулират през следващия сезон. Най-широко разпространени са тривалентните или четиривалентните ваксини, съдържащи антигени на вируса на грип А H1N1 и H3N2 плюс съответно един или два компонента на вируса грип В (6). По-голямата част от свързаната с грипния вирус смъртност настъпва при възрастното население. През 2015 г. Американската администрация по храните и лекарствата (FDA) одобри пускането на пазара на ваксина, насочена към възрастното население; тази ваксина, Fluad, е първата ваксина срещу сезонен грипен вирус, съдържаща адювант (19, 20). Fluad, тривалентна ваксина, произведена от три щама на грипния вирус (два подтипа A и един тип B), се формулира с адювант MF59 (Novartis), емулсия масло във вода от скваленово масло. Добавянето на адювант дава по-високо ниво на защитни антитела в рискови популации, като възрастни хора (21).
РЕЗУЛТАТИ
Комбинираният адювант TLR4/TLR7 насърчава намаляването на титрите на белодробните вируси и намалява заболеваемостта след предизвикване на хомоложен грипен вирус.
Комбинираният адювант 1V270/1Z105 беше допълнително изследван при двойно дефицитни мишки Tlr4.Tlr7 -/- и мишки Myd88 -/- (вижте Материали и методи за допълнителни подробности за мутантните миши щамове, използвани в това проучване). С комбинирания адювант отговорът на антителата и защитният ефект срещу вирусно предизвикателство зависят от наличието на TLR4, TLR7 и MyD88 (фиг. 2G до toI). I). Способностите на мишките Tlr4.Tlr7 -/- и Myd88 -/- да реагират на адювант rPR/8 HA бяха потвърдени чрез използване на поли (I · C), агонист за TLR3 и протеин-5, свързан с меланома (MDA5), вътреклетъчен индуцируем ретиноева киселина ген I (RIG-I) подобен рецептор. Tlr4.Tlr7 -/- и Myd88 -/- мишки, имунизирани с rPR/8, адювантирани с поли (I · C), генерират отговор на антитела, сравним с този при WT мишки (Фиг. 2J). Тези имунизирани мишки Tlr4.Tlr7 -/- и Myd88 -/- бяха защитени от загуба на тегло и оцеляха с вирусно предизвикателство PR/8, подобно на WT мишки (фиг. 2К и andL). L). Следователно мишките Tlr4.Tlr7 -/- и Myd88 -/- са способни да монтират защитни антивирусни имунни отговори с алтернативен адювант, а in vivo ефикасността на 1V270/1Z105 зависи от непокътнати сигнали TLR4 и TLR7 чрез адаптера MyD88.
Получените от костния мозък и радиоустойчиви клетки допринасят за комбинирана индукция 1V270/1Z105 на антиген-специфичен хуморален имунитет и ефикасност на защитната ваксина.
IgG и CD4 + клетки, индуцирани от 1V270/1Z105 адювант rHA допринасят за защита от вирусно предизвикателство.
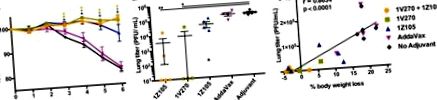
За да се оцени официално ролята на IgG в защитата, индуцирана от комбинирания адювант, WT (BALB/c) мишки бяха имунизирани на 0 и 3 седмици или с rHA от PR/8, или с грип A/California/04/2009 (пандемия H1N1) (Cal/09) плюс 1V270/1Z105 или с неадювантен антиген. Мишките бяха обезкървени 10 седмици след първата имунизация и серумите бяха инактивирани чрез топлина и пасивно прехвърлени чрез интраперитонеално (i.p.) инжектиране в реципиентни WT (BALB/c) мишки. Мишките бяха предизвикани с хомоложен PR/8 вирус и последвани за заболеваемост, изследвана чрез загуба на тегло (P Фиг. 4A) и смъртност (P Фиг. 4B) или предизвикани с адаптирана към мишки хетероложна NL/09 и последвана за заболеваемост (P Фиг. 4C) и смъртност (P Фиг. 4D). Контролна група от мишки, имунизирани с rCal/09 и предизвикани с грип A/Netherlands/602/2009 (NL/09), беше включена, за да демонстрира хомоложна защита в пандемичния модел H1N1. Пасивният трансфер на антитела от мишки, имунизирани с 1V270/1Z105, отслабва загубата на тегло и осигурява защита от летално инфекциозно хомоложно предизвикателство, но не и от хетероложно предизвикателство.
1V270 и 1Z105 работят допълнително, за да индуцират антиген-специфични IgG и да защитят мишките от грипния вирус.
Въпреки че адювантните ваксини могат да подобрят имунитета, регулаторните агенции са подходящо загрижени за безопасността на ваксините (16, 45, 46). Тук изследвахме комбинирания адювант за нецелеви ефекти и систематично оценяваме намаляване на дозата, за да сведем до минимум всякакви потенциални токсичности. По-рано съобщихме, че комбинираният адювант 1V270/1Z105 не предизвиква системен възпалителен отговор и се сравнява добре с емулсията AddaVax на базата на сквален в това отношение (18); обаче определянето на in vivo механизма на действие е критична стъпка в предклиничната оценка на нови адюванти. С нокаутиращи модели мишки демонстрирахме, че 1Z105 и 1V270 са строго зависими от TLR4 и TLR7, съответно, сигнализиране чрез MyD88 без никакви забележими нецелеви ефекти. Комбинацията от малки молекули, насочени към TLR4 и TLR7, води до способността за значително намаляване на адювантната доза.
Адювантите с множество молекулни и клетъчни мишени са желателни, ако резултатите от ефикасността от предклинични модели трябва да бъдат преведени в употреба при хора с генетично разнообразен произход. 1V270/1Z105 работи както чрез TLR4, така и чрез TLR7 и оказва своето въздействие както върху периферните радиоустойчиви клетки, така и върху клетките, получени от костния мозък. Активирането на множество рецептори в различни популации на адаптивни и вродени имунни клетки ще помогне за подобряване на отговорите на ваксините в популации, базирани на общността. По-специално, тази стратегия има голям потенциал за преодоляване на имунното стареене при по-възрастни пациенти, които са изложени на най-висок риск от усложнения от грипни вирусни инфекции. Както вече описахме, съотношението TLR4: TLR7 влияе върху баланса на Th1: Th2 тип имунитет (18). Продължавайки напред, оптимизирането на съотношението TLR4: TLR7 трябва да осигури възможност за оптимизиране както на безопасността, така и на ефикасността, тъй като съединенията са формулирани за клинично развитие, а това е важна област на изследване за разработване на адювантни ваксини от следващо поколение.
МАТЕРИАЛИ И МЕТОДИ
Животни.
Получаване на MyD88 и WT химерни мишки за костен мозък.
Химерни мишки от костен мозък се генерират чрез инжектиране на 10 7 клетки от костен мозък интравенозно в облъчени с цялото тяло (950 cGy) мишки реципиенти (47). Химерните мишки бяха имунизирани с rHA плюс адювант 6 седмици след трансфера на костния мозък. За оценка на химеризма, CD45.1 и CD45.2 вродени маркери бяха използвани съответно в WT и Myd88 -/- мишки. Пет и 11 седмици след пренасянето на костния мозък, мононуклеарните клетки от периферната кръв от реципиентните мишки се оцветяват за CD45 маркери, за да се анализира процентът на донорните клетки чрез поточна цитометрия. Средните проценти на химеризъм на 5 и 11 седмици след прехвърляне на костен мозък са определени съответно на 91,3% ± 3,1% и 96,4% ± 2,0% (означава ± стандартни отклонения).
Реактиви.
Съединенията 1Z105 и 1V270 са синтезирани в лабораторията на Карсън в UCSD, както е описано по-рано (22, –24), разтворени в диметилсулфоксид (DMSO; Sigma-Aldrich, Сейнт Луис, МО) като 20 до 100 mM основни разтвори и съхранявани при -20 ° C. Нивата на ендотоксин в тези съединения бяха определени чрез използване на Endosafe (Charles River Laboratory, Wilmington, MA, USA) и бяха потвърдени, че са по-малко от 10 ендотоксинови единици (EU)/μmol. AddaVax и VacciGrade високомолекулни (HMW) поли (I · C) са закупени от Invivogen (Сан Диего, Калифорния).
Рекомбинантен НА се приготвя, както е описано по-рано (48, 49). Накратко, rHA антигени, получени от грипен вирус A/Пуерто Рико/8/1934 (H1N1) (PR/8) и A/California/04/2009 (пандемия H1N1) (Cal/09), са изразени от бакуловирусни вектори в High Five клетки (BTI-TN-5B1-4 клетки; субклон от Виенския биотехнологичен институт) в лабораторията като разтворими тримери, като се използва естественият тримеризационен домейн на T4 фаг фибритин и С-краен хексахистидинов етикет за пречистване, както е описано по-горе (48, 49 ). Протеинът се пречиства с Ni-нитрилотриоцетна киселина (NTA) - агарозни зърна (Qiagen, Hilden, Германия).
Проучвания in vivo имунизация.
BALB/c WT, C57BL/6 WT, Tlr4 -/-, Tlr7 -/-, Tlr4.Tlr7 -/- (двоен нокаут), Myd88 -/- и мишки Ticam Lps2 бяха имунизирани i.m. с 1V270 (10,8 μg/инжекция, еквивалентно на 10 nmol/животно), 1Z105 (89,4 μg/инжекция, еквивалентно на 200 nmol/животно) или комбинация от 1V270 (10 nmol/животно) и 1Z105 (200 nmol/животно) или при дози, посочени по друг начин в легендите на фигурите за оценка на реакцията на дозата, в общ обем от 50 μl 10% DMSO във физиологичен разтвор (носител). Контролите не включват адювант (антиген в 10% DMSO във физиологичен разтвор), носител, поли (I · C) [10 μg поли (I · C) плюс антиген в носител] и AddaVax (съотношение 1: 1 с антиген във физиологичен разтвор) . Контрола само с адювант (10 nmol от 1V270 плюс 200 nmol от 1Z105 в носител) е била предварително оценена и е установено, че няма ефект върху предизвикани мишки спрямо само носител (18). Всички мишки бяха имунизирани i.m. с rHA (2 μg rPR/8 HA на мишка или 5 μg rPR/8 HA на мишка в експеримента с адювантна доза-отговор). Всички имунизации бяха извършени i.m. в мускула на гастрокнемия.
Предизвикателство на миши грипен вирус.
Адаптирана към мишка (чрез серийно преминаване през миши бели дробове при работа, извършена преди мораториума за придобиване на функция) A/Netherlands/602/2009 (H1N1) (NL/09) и A/Puerto Rico/8/1934 (H1N1) PR/8) са отгледани в 8 до 10-дневни ембрионирани пилешки яйца. Мишите 50% летални дози (mLD50s) са съответно 10 PFU и 30 PFU, както е определено при 8- до 10-седмични женски мишки BALB/c. Мишките бяха анестезирани с кетамин-ксилазин и заразени i.n. в обем от 50 μl буфериран с фосфат физиологичен разтвор (PBS) със 100 PFU NL/09 или 300 PFU PR/8. Всички предизвикани животни се наблюдават ежедневно за телесно тегло и се жертват, когато достигнат одобрените от IACUC крайни точки.
Проучване за пасивен серумен трансфер.
За проучването за пасивен серумен трансфер, 6- до 8-седмични женски мишки WT BALB/c са имунизирани на 0 и 3 седмици с rPR/8 HA плюс 1V270/1Z105 или rPR/8 HA в носител. Мишки бяха обезкървени 10 седмици след първата имунизация и серумите бяха пречистени чрез микроцентрифугиране. Серумите се инактивират при топлина при 56 ° С и 200-μl аликвотни части от серуми се прехвърлят чрез i.p. инжекция на наивни 6-8-седмични BALB/c женски мишки. Мишките бяха предизвикани с 10 mLD50 от PR/8 вирус 3 часа след пасивен серумен трансфер и наблюдавани ежедневно за промени в телесното тегло.
Изследване на изчерпване на CD4 +.
CD4 + клетките са изчерпани след ваксинация. Накратко, мишките BALB/c се имунизират с rPR/8 HA плюс 1V270/1Z105 и 3 до 4 седмици по-късно се прилага моноклонално антитяло (MAb) GK 1,5 (200 μg/инжекция; BioXCell, Западен Ливан, NH) i.p. на дни -2 и +1 спрямо вируса (ден 0) за изчерпване на CD4 + клетките. MAb LTF-2 (BioXCell) се използва като изотипна контрола. Мишките бяха предизвикани с хомоложен PR/8 вирус или хетерологичен NL/09 вирус и бяха изследвани за заболеваемост, въз основа на загуба на тегло и смъртност.
Измерване на антиген-специфични антитела.
Антителата срещу грипния вирус бяха измерени в ELISA, като се използва като субстрат PR/8 вирус, пречистен чрез 30% захарозна възглавница чрез ултрацентрифугиране по стандартни методи (18). EPTs бяха определени като най-високото разреждане на серума, което доведе до сигнал три пъти над фоновото ниво. Общият IgG е открит, както е описано по-рано (18).
Титри на грипния вирус.
Титрите на грипния вирус бяха определени в MDCK клетки чрез стандартен анализ на плака, описан по-рано (50).
- Моята диета е по-добра от вашата, може ли дивата диета на Абел Джеймс да работи за вас от Daily Burn
- Ако включите шоколад в диетата си Харвард Здраве
- Портокал за отслабване 4 напитки с портокалов сок, които могат да направят чудеса за вашата диета - NDTV храна
- Pramlintide Приложни практични съвети за това как Symlin да работи правилно diaTribe
- Предписание 90-дневен годеник Лариса Класиране на отслабването Д-р Саймън Т Гарза Отслабване Работа Slcrb