Jianxia Li
училище за опазване на природата, Пекински горски университет, Пекин 100083, P.R. Китай
Jieqiong Dong
b Колеж по биологични науки и технологии, Пекин Ключова лаборатория за горски хранителни процеси и безопасност, Пекински горски университет, № 35 Tsinghua East Road, Haidian District, Пекин 100083, P.R. Китай. Имейл: moc.361@12283326w; Факс: +8601062336700; Тел: +8601062336700
Jie Ouyang
b Колеж по биологични науки и технологии, Пекин Ключова лаборатория за горски хранителни процеси и безопасност, Пекински горски университет, № 35 Tsinghua East Road, Haidian District, Пекин 100083, P.R. Китай. Имейл: moc.361@12283326w; Факс: +8601062336700; Тел: +8601062336700
Jie Cui
c Институт за развитие на лечебни растения, Китайска академия за медицински науки, Пекин 100193, P.R. Китай
Юан Чен
b Колеж по биологични науки и технологии, Пекин Ключова лаборатория за горски хранителни процеси и безопасност, Пекински горски университет, № 35 Tsinghua East Road, Haidian District, Пекин 100083, P.R. Китай. Имейл: moc.361@12283326w; Факс: +8601062336700; Тел: +8601062336700
Фънджун Уанг
b Колеж по биологични науки и технологии, Пекин Ключова лаборатория за горски хранителни процеси и безопасност, Пекински горски университет, № 35 Tsinghua East Road, Haidian District, Пекин 100083, P.R. Имейл: moc.361@12283326w; Факс: +8601062336700; Тел: +8601062336700
Jianzhong Wang
b Колеж по биологични науки и технологии, Пекин Ключова лаборатория за горски хранителни процеси и безопасност, Пекински горски университет, № 35 Tsinghua East Road, Haidian District, Пекин 100083, P.R. Китай. Имейл: moc.361@12283326w; Факс: +8601062336700; Тел: +8601062336700
Резюме
Получава се дихидрокверцетиново производно (DHQA) чрез аминометилиране, за да се преодолее ниската разтворимост във вода и бионаличността на дихидрокверцетин (DHQ). DHQA се характеризира чрез HPLC, ядрено-магнитен резонанс, сканираща електронна микроскопия, рентгенова дифракция и термогравиметрични анализи. DHQA се превръща в аморфна форма, но основната структура на DHQ остава непроменена. Бяха проведени и тестове за разтваряне и разтваряне. Резултатите показват, че степента на разтворимост и разтваряне на DHQA са приблизително 16,28 и 6,31 пъти по-високи от тези на DHQ, съответно. MTT анализът на DHQA показа нетоксичен ефект срещу неракови клетки HEK-293T (EC50 = 820,00 μM) и мощна инхибиторна активност срещу ракови Hela клетки (EC50 = 138,17 μM). И накрая, антиоксидантната активност на DHQA е потвърдена in vitro чрез тестове за активност на DPPH и ABTS за отстраняване на радикали. DHQA показва висока антиоксидантна активност с ниски стойности на IC50 (0,043 и 0,042 mM, съответно). Анализът за намаляване на мощността на Fe 3+ показва, че DHQA проявява по-висока редуцираща мощност от DHQ и аскорбинова киселина.
1. Въведение
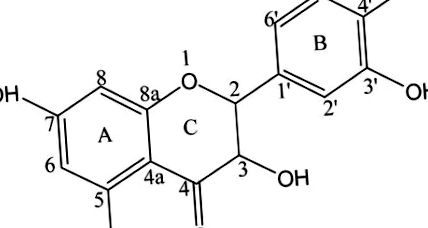
Дихидрокверцетин (DHQ; известен също като 3,5,7,3,4-пентахидрокси флаванон или таксифолин; фиг. 1) е флавоноид и един от най-ефективните природни антиоксиданти, които са важни за човешкото здраве.1 DHQ е широко разпространен в корите от рода Pinus или Larix и в семената от рода Silybum.2,3 DHQ проявява антинеопластични, антимикробни, 4 противовъзпалителни, аналгетични, 5 и антиадипогенни свойства, 6 както и радикална активност за отстраняване. може да подобри кръвообращението в мозъка и ефективно да инхибира клетъчната меланогенеза, като същевременно повиши нивото на тирозиназния протеин.2,8,9 Това съединение проявява антивирусна активност и индуцира устойчивост към сърдечно-съдови заболявания и агрегация на тромбоцитите.10 DHQ също защитава растенията от патогени. Следователно DHQ се използва широко в медицинската, хранителната, козметичната, селскостопанската и техническата сфера. DHQ обаче е трудно да се абсорбира и метаболизира поради ниската си водоразтворимост, като по този начин ограничава неговата бионаличност и ефикасност.10,13,14 Следователно трябва да се разработи ефективно, водоразтворимо и нетоксично синтетично производно на DHQ, за да се разшири приложението му.
Наскоро беше изследвано аминометилирането на DHQ. Nifant'ev et al. използва вторични амини, първичен амин и амиламин като аминови компоненти в реакцията на Mannich (аминометилиране) за синтезиране на голям брой монозаместени и дизаместени DHQ производни.15 Kosheleva et al. синтезирани близки структурни аналози на DHQ с еквимоларно съотношение на реагентите от реакции на Mannich.16 Kaziev et al. докладвани хетерополни съединения на DHQ на базата на модифициран флавоноид, 2,3-дихидрокверцетин, от реакции на Mannich.17 Тези резултати показват, че всички тези DHQ производни имат основната структура на DHQ, която съдържа пет хидроксилни групи. Следователно, тези DHQ производни могат да запазят антиоксидантните свойства на DHQ поради няколко хидроксилни групи.18 DHQ модификацията се постига чрез въвеждането на аминогрупи, които произвеждат нови полифункционални съединения с нарушен структурен баланс, за да подобрят разтворимостта. Предишни изследвания обаче се фокусираха върху синтеза и структурата на аминометилирани DHQ производни. Доколкото ни е известно, характеристиките, солюбилизацията, скоростта на разтваряне и антиоксидантната активност на аминометилирани DHQ производни до момента не са докладвани.
Това проучване се фокусира върху получаването и характеризирането на водоразтворимо DHQ производно, образувано чрез аминометилиране, без промяна на първоначалната молекулна структура на DHQ. Постигнахме селективно бизаминометилиране на DHQ с 1-пролин; реакцията се извършва при моларно съотношение DHQ: формалдехид: 1 -пролин 1: 2: 2 (фиг. 2). Структурата и свойствата на аминометилираното DHQ производно се характеризират с високоефективна течна хроматография (HPLC), ядрено-магнитна резонансна спектроскопия (NMR), сканираща електронна микроскопия (SEM), рентгенова дифракция (XRD) и термогравиметрия (TG). Накрая бяха проведени тестове за разтворимост, скорост на разтваряне, цитотоксичност и антиоксидантна активност, за да се изследват биологичните дейности на аминометилираното DHQ производно. Тази работа може да предостави ценна информация за подобряване на разтворимостта на DHQ, за да бъде лесно усвоена и метаболизирана от човешкото тяло.
2. Материали и методи
2.1. Материали
DHQ (96% чистота) е изолиран от Larix gmelinii според нашето предишно проучване.19 HEK-293T (човешки ембрионален бъбрек 293T) и Hela (човешки цервикален карцином) са закупени от Union Hospital (Пекин, Китай). Модифицираната среда на орел на Dulbecco (DMEM) и фетален говежди серум (FBS) са закупени от Hyclone (Logan, UT, USA). Пеницилин-стрептомицинът е закупен от Gibco (Гранд Айлънд, Ню Йорк, САЩ). Цисплатин, аристолохинова киселина, диметилсулфоксид (DMSO), 3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолиумбромид (MTT), 1,1-дифенил-2-пикрилхидразил (DPPH) радикал и 2, 2'-азинобис- (3-етилбензтиазолин-6-сулфонат) (ABTS) са получени от Sigma (Сейнт Луис, МО, САЩ). Всички други разтворители и химикали са с аналитично качество и са получени от Beijing Chemical Reagents Co., Ltd. (Пекин, Китай). Водата се пречиства със системата за свръхчиста вода NW (Pudong, Шанхай, Китай).
2.2. Получаване на аминометилиран DHQ
Съединението (DHQA: аминометилиране на DHQ) се синтезира съгласно метода на Nifant'ev et al. с леки модификации.20 Смес от 33% формалин (1.32 mmol), 1-пролин (0.152 g; 1.32 mmol) и 10 ml етанол се разбърква при 60 ° С до пълна хомогенизация. Накрая бавно се добавя разтвор на DHQ (0,2 g, 0,66 mmol) в 5 ml етанол. Реакционната смес се разбърква при 60 ° С в продължение на 1,5 часа. Получената бледожълта прахообразна утайка се отделя чрез филтруване, последователно се промива с етанол, бензен и хексан и се суши във вакуумна сушилня до постоянно тегло.
DHQA се анализира с HPLC, използвайки модифициран метод. 16 Използва се HPLC система Shimadzu LC-2010A (Киото, Япония) с детектор LC-2010 и колона Shimadzu VP-ODS-C18 (250 mm × 4,6 mm). Подвижната фаза беше MeOH – CF3COOH (0,1%) с градиентно елуиране от 10 до 90% MeOH за 30 минути. Елуентът протича изократично при 1,0 ml min –1. Пробата се открива при 288 nm и обемът на инжектиране е 20 μL. Всички проби бяха филтрирани през 0,45 μm мембранни филтри преди инжектиране в HPLC апарата.
2.3. 1H и 13 ° С ЯМР спектроскопия
1H и 13C NMR спектри бяха получени на 400 MHz Bruker AV-III спектрометър (Германия), работещ при стайна температура, с DMSO-d6 като разтворител и тетраметилсилан (TMS) като вътрешен стандарт. Преди измерването, 20 и 40 mg от изсушените проби се разтварят в 0,5 ml DMSO-d6 за 1Н и 13 ° С ЯМР, съответно. 1 H NMR спектрите са получени с минимум 64 сканирания, докато 13 C NMR спектрите са извършени в импулсен FT режим (100,6 MHz) с минимум 2048 сканирания.
2.4. SEM
Пробите за SEM бяха лиофилизирани в апарат HITACHI ES-2030, монтиран върху метални стъбла с колоиден графит и покрит със злато в разпръскващо покритие Hitachi E-1010 за 70 s. Материалите бяха наблюдавани и микроснимки бяха получени с HITACHI S-3400.
2.5. Прах XRD
Праховите рентгенови анализи бяха проведени на рентгенов дифрактометър Shimadzu XRD-7000 с излъчване Cu Kα. Дифракционните модели са записани между 5 ° и 60 ° с размер на стъпката 2θ = 0,02 ° при скорост на сканиране 5 ° min –1 .
2.6. Термични анализи (TG)
Загубата на тегло на DHQ и DHQA се определя с TG анализатор (Q500, TGA Instruments). Приблизително 10 mg проба бяха използвани за всеки цикъл. Пробата се нагрява в динамична азотна атмосфера (скорост на потока = 70 mL min –1) от стайна температура до 600 ° C, със скорост на нагряване 10 ° C min –1 .
2.7. Тест за солюбилизация
Разтворимостта на DHQ и DHQA се определя съгласно Yang et al.10 Излишно количество от съответното съединение се поставя в 2 ml вода (приблизително рН 5.7) под азот и се защитава от светлина. Сместа се разбърква в продължение на 1 час при 20 ± 2 ° С. Разтворът се филтрира върху 0,45 μm целулозна ацетатна мембрана. Филтратът се изпарява до сухо при понижено налягане и остатъкът се дозира чрез метод на претегляне.
2.8. Тест за разтваряне
2.9. Анализ на цитотоксичността
Клетките HEK-293T и Hela бяха култивирани в DMEM среда, допълнена с 10% FBS, 100 U mL -1 пеницилин и 100 mg mL -1 стрептомицин. Клетките се инкубират при 37 ° С в овлажнен инкубатор с атмосфера от 5% CO2. DHQ, DHQA и положителни контроли (цисплатин и аристолохинова киселина) се приготвят в DMSO и се разреждат до различни концентрации (2–1280 μM) с хранителната среда. Крайната концентрация на DMSO в средата е под 0,1%.
Клетките се инокулират в 96-ямкови плаки (1 х 104 клетки на гнездо, 200 μL на гнездо) и се култивират при 37 ° С. След 12 часа предварителна инкубация, за да се позволи клетъчно свързване, супернатантата се отстранява и се добавя празна среда или среда, съдържаща различни концентрации на тествания разтвор, и се инкубира в продължение на 48 часа. Супернатантата се отстранява след инкубация и във всяка ямка се добавят 100 μL тетразолиев реагент (1 mg mL –1), последвано от допълнително инкубиране при 37 ° С в продължение на 4 часа. Супернатантата се декантира и се добавя DMSO (150 μL на гнездо), за да се даде възможност за разтваряне на формазан. Оптичната плътност (OD) на всяка ямка се открива с помощта на четец на Microplate (BIO-RAD Model 680) при 570 nm. Всяко третиране се повтаря 5 пъти. Ефективната концентрация 50% (EC50) се определя чрез приспособяване на кривата.
2.10. Тестове за антиоксидантна активност
2.10.1. DPPH радикална активност за почистване
Извличането на DHQ и DHQA срещу DPPH радикала се оценява по стандартен метод с някои модификации. 22 Екстрактът (2 ml) се смесва с 2 ml разтвор на DPPH (2 × 10 -4 mol L -1). Реакционната смес се инкубира на тъмно при стайна температура в продължение на 30 минути, преди да се получи абсорбцията на сместа при 517 nm. Като положителна контрола се използва DPPH радикалът на аскорбинова киселина. Процентът на активност на почистване срещу DPPH радикал е изчислен със следното уравнение: Радикална активност на почистване (%) = [1 - (A - B)/C] × 100 където A е абсорбцията на разтвора на DPPH радикал, смесен с екстракта на пробата, B е абсорбцията на екстракта от пробата, смесен с алкохол, а C е абсорбцията на разтвора на DPPH радикал, смесен с вода. Всички измервания бяха извършени в три екземпляра (n = 3).
2.10.2. ABTS радикална дейност за почистване
Анализът се извършва съгласно процедурата, описана от Li, Wang, Wang, Walid и Zhang с някои модификации.23 Работният разтвор се приготвя чрез смесване на изходни разтвори от 7,4 mM ABTS и 2,6 mM калиев персулфат в равни количества; сместа се оставя да реагира в продължение на 12 часа при стайна температура на тъмно. Полученият разтвор (1 ml) се разрежда с алкохол, за да се получи необходимата абсорбция при 734 nm от 0,7 ± 0,02 единици с UV спектрофотометър. За анализа се използва прясно приготвен разтвор на ABTS. Накратко, 0,2 ml от екстракта се оставя да реагира с 0,8 ml от ABTS разтвора; абсорбцията при 734 nm се записва след 6 минути със спектрофотометър. Като положителни контроли бяха използвани ABTS радикалите на аскорбиновата киселина. Процентът на активност на почистване срещу радикала ABTS се изчислява със следното уравнение: Радикална активност на почистване (%) = (Abscontrol - Abssample)/Abscontrol където Abscontrol е абсорбцията на ABTS в алкохол, а Abssample е абсорбцията на ABTS разтвор, смесен с пробата екстракт. Всички измервания бяха извършени в три екземпляра (n = 3).
2.10.3. Анализ за намаляване на мощността на Fe 3+
3. Резултати и дискусия
3.1. HPLC анализ
Идентифицирането и количественото определяне на DHQA се основава на комбинация от времена на задържане и метод за нормализиране на площ, използвайки HPLC система. На фиг. 3А, резултатите показват, че времето на задържане на DHQA е 10,39 минути, което е различно от това на DHQ (RT = 18,01 минути) на фиг. 3В. Според метода за нормализиране на площта, пиковата площ на DHQA е 96%. Това явление ясно показва, че е настъпило аминометилиране на DHQ и DHQA има доста висока чистота.
- Синтез, активност и структура-активност Изследвания на взаимоотношенията на новите катионни липиди за ДНК
- Синтез и характеризиране на целулозни производни от отпадъци от промишлени кърпи - Yıldız - 2019
- Обзор Център за физическа активност и управление на теглото
- Коприва за здраве диетични диетични антиоксиданти plantpowerz
- Физическа активност за отслабване Kaiser Permanente