Свързани термини:
- АСЕ инхибитор
- Серозит
- Кинин
- Брадикинин
- Кръвно налягане
- Каликреин
- Тъкани Каликреин
- Дипептидил карбоксипептидаза
Изтеглете като PDF
За тази страница
Хормони и транспортни системи
Никола Маменко,. Олег Починюк, във Витамини и хормони, 2015
1. Въведение
Сърповидно-клетъчна болест
Phuong-Thu T. Pham,. Сузи К. Лю, в Хронична бъбречна болест (второ издание), 2020 г.
Системата Кинин – Каликреин и хиперфилтрация
Предполага се, че системата кинин-каликреин играе роля в хиперфилтрацията, наблюдавана при пациенти с SCD, подобно на пациентите с диабет. 48 Висока серумна концентрация на каликреин се появява при пациенти с диабет и индуцирани от стрептозоцин диабетични плъхове с хиперфилтрация. Хроничното инхибиране на бъбречния каликреин намалява GFR и RPF при стрептозоцин-индуцирани диабетни плъхове. 48 В проучване на напречно сечение, проведено за оценка на ролята на бъбречния каликреин като рисков маркер за SCN при 73 педиатрични пациенти с SCD, активната екскреция на каликреин в урината корелира положително и значително със скоростта на екскреция на албумин в урината. В този случай каликреинът, като албумин, може да бъде маркер на нефропатията. 49 Проучването имаше няколко недостатъка, включително липсата на измервания на бъбречната функция (eGFR или креатининов клирънс) и пациенти със смущаващи фактори (чести кръвопреливания, намаляващи сърповидното натоварване на хемоглобина, засягащо бъбречно функционално увреждане, очаквано за възрастта). 50 При деца със СКД ранното кръвопреливане предпазва от микроалбуминурия. 51 Дали системата кинин – каликреин играе роля в процеса на хиперфилтрация в SCN, предстои да се проучи.
Патофизиология на първичната хипертония
Робърт М Кери, в Микроциркулация, 2008
18.15 Системата Кинин и HT
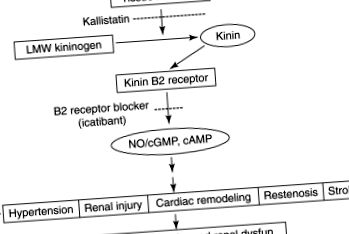
Каликреин/кининовата система (KKS) представлява пептидна каскада, която е важна за сърдечно-съдовата и бъбречната регулация [1121,1122]. BK, основният активен пептид, се образува чрез действието на каликреин върху кининогена. BK действа на един от двата рецептора, B1 и B2. BK B2 рецепторът е основният рецептор, медииращ BK-индуцирани промени в сърдечно-съдовата и бъбречната функция. В2 рецепторът има висок афинитет към BK и медиира вазодилататорното и хипотензивното действие на BK чрез освобождаване на NO, PGI2 и PGE2 [1123]. В2 рецепторът също е антихипертрофичен и антиисхемичен и подобрява инсулиновата чувствителност [1121,1122] .
KKS участва в патофизиологията на HT [1124] (Фигура 18.44). BK е мощен вазодилататор, намаляващ общото периферно съдово съпротивление и индуциращ натриуреза при хората [1125,1126]. Бъбречната артериална инфузия на BK индуцира натриуреза и диуреза чрез увеличаване на RBF, поради освобождаването на PG [1127,1128]. Екскрецията на каликреин в урината е значително намалена както при хора, така и при гризачи с НТ, а нивата на кининоген и кинин-потенциращ фактор са намалени при първичен и злокачествен НТ [1129–1132]. Трансгенните мишки, свръхекспресиращи каликреин в бъбречната тъкан, са намалили АН, което е коригирано чрез приложение на апротинин, инхибитор на тъканния каликреин. Също така, хипотензивният отговор към АСЕ инхибиторите се обръща от апротинина в SHR [1133]. Това е важно, тъй като ACE е същият ензим като кининаза II, който разгражда BK до неактивни метаболити. Взетите изцяло констатации подчертават ролята на KKS в регулирането на BP.
Фигура 18.44. Защитната роля на каликреин-кининовата система чрез B2 рецептора в сърдечно-съдовата, бъбречната и ЦНС. От Реф. [1134] с разрешение.
Напоследък молекулярните и генетични доказателства засилиха нашите концепции относно ролята на KKS в HT [1134]. KKS съществува като отделни плазмени и тъканни системи. Полиморфизмите на промоторния ген на каликреин в човешката тъкан са свързани с НТ и НТ, свързани с краен стадий на бъбречно заболяване [1135]. В допълнение е доказано, че полиморфизмът на промотора на каликреин регулира генната експресия и променя АН в отговор на промените в приема на Na + с храната [248]. Тези открития предполагат, че генната експресия на каликреин може да осигури маркер за популационни проучвания при чувствителна към солта НТ и бъбречно заболяване.
В допълнение към гореспоменатото намаляване на екскрецията на каликреин при хора с НТ, редица генетично хипертонични модели плъхове също имат намален каликреин в урината [1136–1140]. Антагонистът на BK B2 рецептора, икатибант, индуцира повишаване на BP в SHR, хранена със сол с дефицит на сол, което предполага, че BK играе роля в модулирането на HT в този модел [1141]. Нещо повече, дефицит на кининоген плъхове Brown Norway Katholick, които не са в състояние да генерират BK, са податливи на индуцирана от сол НТ [1142]. Всички тези наблюдения биха били в съответствие с патофизиологичната роля на дефицита на BK/B2 рецептор при НТ.
В2 рецепторът се експресира конститутивно и е основният рецептор, участващ в сърдечно-съдовата регулация, а В1 рецепторът е минимално експресиран. Въпреки това, при условия на възпаление В1 рецепторът може да бъде регулиран нагоре и може да медиира BK-индуцирана вазодилатация и хипотония [1143,1144] .
Откриване и разработване на инхибитори на пролилкарбоксипептидаза за кардиометаболитни нарушения
Сара Чайковски Скари, Джон М. Римолди, в Годишни доклади по медицинска химия, 2013 г.
3.2 Системата каликреин-кинин
KKS е сложна система, която също участва в регулирането на сърдечно-съдовата функция, коронарния съдов тонус при хората и хемостазата 26, която до голяма степен уравновесява RAS. Механично, когато комплексът от високомолекулно кининоген и прекаликреин (ПК) се свързва с ендотелните мембрани, PRCP катализира превръщането на ПК в каликреин (фиг. 7.2). Освободеният каликреин разцепва кининоген с генерирането на брадикинин (ВК), което в крайна сметка води до индуциране на вазодилатация чрез действие на ВК върху В2 рецепторите и последващо освобождаване на NO и простагландини. 27 PRCP също катализира инактивирането на кинина BK1–8, давайки BK1–7. 17 Беше показано, че повишеното регулиране на PRCP в липополизахарид стимулира ендотелните клетки повишава активирането на каликреин от ПК и насърчава възпалителна реакция. Инхибиторите на периферния PRCP могат да намерят полезност като противовъзпалителни средства. 28
Патогенеза на хипертонията
Системата Каликреин-Кинин
Системата каликреин-кинин работи паралелно с RAAS, но има много функции (напр. Намаляване на АН, вазопротекция, натриуреза), които се противопоставят на действията на Ang II и алдостерон. 66 Кинини (които включват брадикинин, калидин и метионил-лизил-брадикинин) се генерират от протеинови прекурсори, наречени кининогени, чрез действие на каликреин, ензим, който се експресира главно в подчелюстните жлези, панкреаса и бъбреците, но се открива и в съдовите тъкани, сърце и надбъбречни жлези. Кинините бързо се хидролизират и инактивират от редица кининази, включително АСЕ (киназа II) и неутрална ендопептидаза 24.11 (енкефалиназа), които инактивират и други вазоактивни пептиди. Поради тази бърза хидролиза кинините циркулират в много ниски концентрации и действат главно близо до мястото на произход.
Кинините действат чрез рецепторите В2 и В1: рецепторът В1 се изразява само в условията на възпаление и нараняване на тъканите, докато рецепторът В2 медиира повечето функции на кинините. Активирането на B2 рецептора стимулира освобождаването на различни вазодилататори/натриуретици/антитрофични медиатори, които са отговорни за CV ефектите на кинините. Интересното е, че има кръстосани разговори между В2 рецептора и АСЕ, както и серинови протеази като каликреин, което води до активиране на В2 рецептора и потенциране на брадикинин. В2 рецепторът също така образува хетеродимери с AT1 рецептора, активирайки сигнализирането на AT1 рецептора и образува комплекс с eNOS, инхибирайки генерирането на NO. Функционалните последици от тези рецепторно-рецепторни взаимодействия трябва да бъдат напълно изяснени, но е ясно, че кинините медиират някои от CV и бъбречните ефекти на ACE-Is и ARB, както и някои от неблагоприятните ефекти на ACE- Е. В допълнение, изглежда, че брадикининът играе важна роля в посредничеството на противорегулаторните вазопротективни ефекти на активирането на AT2 рецептора, както и на депресорните ефекти на Ang (1-7).
Намалената активност на каликреин-кининовата система е свързана с човешката хипертония, тъй като ниската екскреция на каликреин в урината е описана при нормотензивни деца на родители с хипертония, докато високият каликреин в урината е свързан с намален риск от първична хипертония. 66 Въпреки това, животински модели с генетична делеция на компоненти на системата каликреин-кинин не развиват повишаване на АН, което предполага, че кинините не играят основна роля в патогенезата на хипертонията. Изглежда обаче, че те играят важна модулаторна роля в солевата чувствителност на АН, както и в антихипертензивните и кардиопротективните ефекти на ACE-Is и ARBs.
Бъбречна токсикология
7.12.7.2.1 Хронично бъбречно заболяване
KKS изглежда участва в ХБН (Jozwiak et al. 2004). Например при плъхове с диабет, индуциран от стрептозотоцин, се съобщава за трансфекция на човешкия тъкан каликреин ген за предотвратяване на диабетна нефропатия (Riad et al. 2007). По същия начин при експериментални модели на диабет свръхекспресията на АСЕ и следователно по-ниските нива на брадикинин са свързани с влошаване на диабетната нефропатия (Riad et al. 2007). Съобщава се също, че брадикининът е антифибротичен в експериментален модел на едностранна бъбречна обструкция, модел на ХБН (Schanstra et al. 2002). Потвърждавайки тези констатации, антагонистът на B2 рецептора Icatibant премахва бъбречните защитни ефекти на кинините (Buléon et al. 2008). Освен това, хроничното лечение с АСЕ инхибитори индуцира експресия на В1 рецептор във васкулатурата и бъбреците, което може да бъде един от механизмите зад ренопротективните ефекти на АСЕ инхибиторите при ХБН (Marin-Castano et al. 2002). Освен това, при пациенти с ХБН е демонстриран човешки В2 рецепторен генен полиморфизъм, което предполага роля на този рецептор в ранното развитие на ХБН (Jozwiak et al. 2004).
Брадикинин
Марти К.С. Wong, в Handbook of Hormones, 2016
Патофизиологични последици
Клинични последици
Активирането на KKS е важно за регулирането на кръвното налягане и възпалителните реакции. Ефектите на BK са предимно антагонистични на тези на ренин-ангиотензиновата система; по този начин KKS е насочен в клинични проучвания за антихипертензия.
Използвайте за диагностика и лечение
ACE отдавна е цел за лечение на хипертония и инхибирането на ACE не само намалява производството на вазоконстриктивен Ang II, но също така забавя разграждането на вазодилататорната BK. Използването на ACE инхибитори за лечение на хипертония е отличителен белег и специфичните агонисти за KKS ще продължат да бъдат популярна тема в изследванията на хипертонията. Освен свързано с кръвното налягане, кинините са също потенциални маркери за дихателни алергични реакции, септичен шок, сърдечни заболявания, панкреатит, наследствен и придобит ангиоедем, болест на Алцхаймер и цироза на черния дроб [10] .
Човешки каликреин 1, тъкан каликреин
Тъкан Каликреин намалява хипертонията и предпазва от сърдечни наранявания
Тъканната система каликреин-кинин играе важна физиологична роля за поддържане на ниско кръвно налягане. Трансгенните мишки, свръхекспресиращи каликреин в човешката тъкан, са хипотензивни през целия си живот [28,29]. Соматичното генно доставяне на човешки тъкан каликреин чрез системни и целенасочени подходи намалява кръвното налягане до 8 седмици при хипертонични плъхове [30–35]. Нулевата мутация на тъканния каликреин води до разширена кардиомиопатия в ранна възраст, въпреки нормалното кръвно налягане [36]. Трансгенните плъхове, свръхекспресиращи човешки тъкан каликреин, имат по-ниско 24-часово средно артериално налягане и подчертан защитен ефект върху сърдечната хипертрофия, индуцирана от изопротеренол [37]. Доставката на каликреин в тъкани води до намаляване на кръвното налягане и отслабване на сърдечната хипертрофия и фиброза при хипертонични плъхове [33,34,38,39]. Генен трансфер на каликреин подобрява сърдечната функция, намалява размера на инфаркта, ремоделиране на вентрикулите при нормотензивни плъхове след миокарден инфаркт [40–43]. Каликреин предпазва от кардиомиопатия чрез подобряване на сърдечната функция, серумните глюкозни и липидни профили при индуцирани от стрептозотоцин диабетни плъхове [44] .
Система Каликреин-Кинин
Марти К.С. Wong, в Handbook of Hormones, 2016
KKS Cascade
Две каскади, плазмен KKS и тъкан KKS, са основните пътища за образуване на кинини при бозайници (Фигура 30.1). В плазмения KKS кининогенът с високо молекулно тегло (HMW) (KNG) се разцепва от плазмения каликреин (KLKB1), за да образува неапептид, известен като BK. В тъканната KKS KNG с ниско молекулно тегло (LMW) се разцепва от тъканни каликреини (KLK), за да се образува декапептид [Lys 0] -BK или калидин. Тъканните каликреини са серинови протеази, известни като жлезисти каликреини, но имената и символите на това семейство протеази са унифицирани наскоро [2]. Тъканната KKS може да се загуби при земноводните, а плазмената KKS се загуби при телеости [3]. В elasmobranchs само BK е пречистен и не е ясно дали KKS съществува или не [4]. Няма доказателства за функционална KKS при минога, тъй като само предполагаемата KNG1 е клонирана [5] (Таблица 30.1).
Фигура 30.1. Каскадни пътища на KKS на бозайници срещу телеости.
Две каскади, плазмен KKS и тъкан KKS, са основните пътища за образуване на кинини при бозайници. В плазмения KKS кининоген с високо молекулно тегло (HMW) (KNG) се разцепва от плазмения каликреин (KLKB1), за да образува неапептид, известен като брадикинин (BK). В тъканната KKS KNG с ниско молекулно тегло (LMW) се разцепва от тъканни каликреини (KLK), за да се образува декапептид [Lys 0] -BK или калидин. Плазмената KKS каскада не е идентифицирана в телеостовете.
Таблица 30.1. Наличие на KKS компоненти при гръбначни животни
| Кининоген (KNGI) | HWM | ? | ? | - | + | псевдоген | + |
| LMW | + | ? | + | ? | - | + | |
| Плазмен каликреин (KLKBI) | ? | ? | - | + | + | + | |
| Тъканен каликреин (KLK) | ? | ? | ? | ? | ? | + | |
| Брадикинин (BK) | ? | + | + | + | кожа-BK | + | |
| B1 рецептор (BDKRB1) | ? | ? | + | ? | ? | + | |
| B2 рецептор (BDKRB2) | ? | + | + | + | + | + |
Компонентите на KKS бяха идентифицирани чрез база данни за геноми и публикувани данни. Компонентите на KKS в земноводните, рибите и циклостомите все още не са напълно определени.
BK е краткотраен пептид и основният ензим за разграждане е кининаза II, която е известна още като ангиотензин конвертиращ ензим (ACE). Освен АСЕ, ВК се разгражда и от голям брой ензими, включително кининаза I, аминопептидаза Р и катепсин К. (Фигура 30.2) [6]. Сред различните видове съотношението на тези пептидази в плазмата е много различно, което показва, че регулирането на метаболизма на ВК е много разнообразно [7] .
Фигура 30.2. Метаболизъм на брадикинин от различни ензими.
BK е краткотраен пептид и основният ензим за разграждане е кининаза II, която е известна още като ангиотензин конвертиращ ензим (ACE). В допълнение към АСЕ, ВК се разгражда и от голям брой ензими, включително кининаза I, аминопептидаза Р и катепсин К.
Каскадата KKS е тясно свързана с тази на ренин-ангиотензиновата система (RAS). Известно е, че KLKB1 превръща проренин в ренин. АСЕ и кининаза II са един и същ ензим, който превръща неактивния Ang I в Ang II и инактивира BK. Кининазата II притежава по-висок афинитет към BK от Ang I и се смята, че произхожда от KKS и предхожда ролята си в RAS. Инхибирането на ACE не само намалява Ang II, но и забавя разграждането на BK. Освен активните пептиди, KKS и RAS се кръстосват и на рецепторно ниво чрез хетероложна димеризация между рецепторите за ангиотензин тип-1 (AT1), рецепторите за ангиотензин тип-2 (AT2) и рецепторите за брадикинин B2, които модулират сигналните пътища на рецептора [ 8] .
- Тревисто растение - общ преглед на ScienceDirect теми
- Малтодекстрин - общ преглед на ScienceDirect теми
- Млечна киселина - общ преглед на ScienceDirect теми
- Здраве на стадото - преглед на ScienceDirect теми
- Hypericum perforatum - общ преглед на ScienceDirect теми