Джордан Дж. Кларк
1 Катедра по медицинска химия, Университет в Мичиган, Ан Арбър, Мичиган, Съединени американски щати
Марк Л. Бенсън
2 Катедра по компютърна медицина и биоинформатика, Университет на Мичиган, Ан Арбър, Мичиган, Съединени американски щати
Ричард Д. Смит
1 Катедра по медицинска химия, Университет на Мичиган, Ан Арбър, Мичиган, Съединени американски щати
Хедър А. Карлсън
1 Катедра по медицинска химия, Университет на Мичиган, Ан Арбър, Мичиган, Съединени американски щати
2 Катедра по компютърна медицина и биоинформатика, Университет на Мичиган, Ан Арбър, Мичиган, Съединени американски щати
Свързани данни
Всички структурни файлове са свободно достъпни от Банката с данни за протеини. Структурите, използвани в изследването, са изрично изброени в допълнителната информация (таблица S1).
Резюме
Резюме на автора
Тук ние изследваме как свързването на лиганда влияе на гъвкавостта на протеина, като анализираме над 4000 кристални структури, с порядък повече от предишни проучвания, базирани на апо-холо двойки. В литературата съществува спор за това колко гъвкави са местата на свързване в протеините. Изследвания, които заключават, че има малко движение при свързването на лиганда, са склонни да измерват RMSD на гръбначния стълб, но проучвания, които показват по-големи конформационни промени, основават своите анализи на ориентации на страничните вериги. Нито едно от тези проучвания не е използвало едни и същи протеини, така че не е ясно доколко различните заключения се дължат на избраните анализи спрямо различните използвани набори от данни. Освен това много изследвания са използвали апо-холо двойки за измерване на конформационната промяна в протеините, но нито едно не е изследвало присъщата гъвкавост на самите апо и холо състояния. Индуцираната промяна, наблюдавана в двойка апо-холо, трябва да бъде поставена в контекста на това колко променливи са състоянията апо и холо. Нашите анализи съвместяват всеки съществуващ дебат, като потвърждават по същество различно поведение на гръбначните стълбове и страничните вериги, където скелетите са склонни да вземат проби от много малко конформационно пространство и страничните вериги често се тласкат към нови конформации при свързването на лиганда.
Въведение
Протеините са естествено гъвкави биополимери, съставени от низ аминокиселини, сгънати в до голяма степен нековалентна структура. [1] Степента на гъвкавост често е тясно свързана с функцията на протеина, особено за ензимите. Разбирането на гъвкавостта на протеините е важно при сгъването на протеини, протеиновото инженерство и рационалния дизайн на лекарства.
Ключова характеристика на местата за свързване на протеин-лиганд е, че те имат както характерно твърди, така и гъвкави остатъци. [2, 3] Твърдостта може да подпомогне специфичността и херметичността на свързването на лиганда, докато гъвкавостта позволява влизане на лиганди в мястото на свързване и може също да участва в комуникацията между алостерични и ортостерични места за свързване. Клъстери от остатъци в близост до местата на свързване често се наблюдават при напрегнати конформации. [4, 5] Счита се, че свързването на лиганд предизвиква щам в тези остатъци и се предполага, че това увеличение на вътрешната енергия може да се използва от протеина за катализа и изхвърляне на лиганд от активен сайт.
Възможността да се отчитат напълно индуцираните промени е особено важно при докинг на протеин-лиганд. Докингът се оказва много труден на практика, когато настъпват конформационни промени при свързване. [6, 7] Проблемът с кръстосаното докинг е илюстрация на трудностите при отчитане на гъвкавостта на протеините при свързването на лигандите. Кръстосано докинг се опитва да докира лиганд от една кристална структура в мястото на свързване на друга структура на същия протеин, но изследванията показват, че много лиганди не се побират, освен ако на протеина е позволено да се приспособи към лиганда. [8-11] По-големият необходимата корекция, толкова по-трудно е да се предскаже точно свързването на протеин-лиганд. [12] Трябва да се включи гъвкавост на протеините, за да се представи точно свързването на протеин-лиганд.
Както очертаваме по-долу, има много изследвания, изследващи степента и свойствата на свързването на лиганда чрез сравняване на апо и холо протеинови кристални структури. Редица проучвания също са изследвали местните характеристики на техните места на свързване, като гъвкавост на страничната верига или повърхност, достъпна за разтворител (SASA), докато някои проучвания са изследвали само глобални белтъчни промени при свързване на лиганда. Анализите на повечето проучвания се разделят на две категории: изчисления на средно квадратно отклонение (RMSD) на атомите на гръбначния стълб или ротамерен анализ на страничните вериги на аминокиселините. Тези различни подходи доведоха до противоречиви заключения, които нашето проучване помага да се съгласуват. По-долу обобщаваме най-важните констатации към днешна дата.
Анализ на гръбначния стълб
Структурните вариации изглеждат малки, когато се оценяват чрез движение на гръбначния стълб. Gutteridge и Thornton установяват, че ензимите в малкия им набор от 11 протеини (11 апо, 14 холо), свързани към субстрат или продукт, са склонни да бъдат по-структурно сходни един с друг, отколкото със свободния ензим (структури, свързани със субстрат и свързан с продукта средно Cα RMSD от 0.36 Å, докато апо ензимите са средно 0.75 Å RMSD за субстратните структури и 0.69 Å RMSD за продуктовите структури). [13]
Gutteridge и Thornton следват работата си, отбелязана по-горе, като търсят конформационни промени при свързване на лиганда в по-голям набор от структури. При тяхното изследване на 60 ензима,
75% от холо-апо двойките имат Cα RMSD от ≤ 1 Å. Това RMSD е в контраст с Cα RMSD, наблюдавано сред апо-апо протеинови двойки като базова линия, където
83% от 31 апо-апо двойки са имали Cα RMSD ≤ 1 Å. [14]
Гунасекаран и Нусинов класифицираха 98 протеина в три категории въз основа на максимално изместване на Cα между холо и апо структури: твърди протеини (≤ 0,5 Å), умерени (0,5 Å 2 Å). [15] Всички класове имаха еднаква контактна плътност, така че гъвкавостта на някои остатъци не се дължи на разхлабената опаковка. Установено е, че твърдите и умерено гъвкави протеини имат повече полярно-полярни взаимодействия: 35% и 34% за твърди и умерено гъвкави, срещу 28% за гъвкави протеини. Като цяло повечето от промените на φ и between между апо и холо бяха минимални. Всички класове имаха няколко остатъка от свързващи места с φ и ψ ъгли в бедните региони на картата на Рамачандран. Имаше повече в апо, отколкото холо структури, и те имаха тенденция да се групират близо до мястото на свързване. Освен това те не откриха забележима разлика в SASA на остатъците от мястото на свързване от трите им класификации на местата за свързване (твърди, умерено гъвкави и много гъвкави). [15]
Brylinski и Skolnick установяват, че повечето двойки апо-холо протеин не показват значителна структурна разлика и че двойките холо-холо протеин показват още по-малко промени, използвайки метриката Cα RMSD. [16] За 521 еднодоменни апохоло структурни двойки, 80% имат RMSD ≤ 1 Å и сред набор от еднодоменни холо-холо двойки,
92% са имали RMSD ≤ 1 Å.
Marks et al. установи, че дължината на фрагменти от бримки в ансамбли от идентични на последователността протеинови структури е положително корелирана с вероятността тези вериги да демонстрират високи нива на структурна вариация (локализиран скелет RMSD> 2Å). [17] Въпреки това, вероятността да се демонстрират високи структурни вариации е сравнително ниска, дори при по-дълги контури (3,85% от взетите от тях 20-остатъчни контури). Този набор от данни включва 5548 уникални протеинови последователности, за които в PDB има поне две рентгенови кристални структури с разделителна способност 2,0 Å или по-добра.
Qi и Hayward изследват 203 групи ензими със структури, съставени от двойки домени, както с, така и без функционални лиганди. [18] Лигандите в тези двойки домейни бяха разделени на две групи в зависимост от това дали са в рамките на 4Å от двата домена (150 лиганда) или само един домен (53 лиганди). Те установиха, че свързващите двойни домейни лиганди често (84%) са в контакт с „разширения регион на огъване“ (остатъците, налични между анотираните домейни и три остатъка във всеки анотиран домейн). И обратно, свързващите лиганди с един домейн рядко (13%) са в контакт с този удължен регион на огъване. Това показва, че лигандите, които задействат движението на домейни чрез тяхното свързващо събитие и не контактуват с двата домена (не-обхващащи тригер-лиганди), рядко се свързват в непосредствена близост до областта на огъване между двата протеинови домена. Авторите на това проучване обаче отбелязват, че обхватът на тяхната работа е ограничен до широкомащабни „движения на домейни“, коментирани от изходния материал, който са използвали.
Амемия и др. създаде база данни за структурна промяна на протеините (PSCDB) [19, 20], която се фокусира върху по-мащабни конформационни промени в протеина, подобно на споменатата по-рано работа на Qi и Hayward. Покритието на PSCDB се простира отвъд движенията на домейни, до локални подкомпоненти на домейни, но не и до движения на ниво остатък. Тяхното представяне на протеиновите движения се осъществява с атомно изместване и теория на линейна реакция на доменните подкомпоненти, като се използва набор от 839 двойки апо-холо протеин. В целия си набор от данни само 7% от техните протеини показват движение на домейн, пряко свързано с свързване на лиганда, 15% показват движение на местно (поддомейн), свързано директно със свързване на лиганд, а 39% не показват никакви значителни движения между апо и холо състояние.
Fradera и сътр. установи, че структурата на свързващия сайт се запазва при свързването на лиганда, както е видно от факта, че средният RMSD на всички атоми, свързващ сайт се променя ≤ 1 Å, че повече от 90% от атомите в контакт с лиганда се движат по-малко от 1 Å и че повечето места за свързване са имали само умерени промени в своите електростатични потенциали. [21] Те обаче установиха, че тези малки движения са способни да предизвикат значителни промени в обема и формата, така че индексите за сходство на обема (η) варират от 0,44 до 0,90. Различията в индексите за геометрично сходство сочат към необходимостта от други начини на анализ, които да придружават RMSD. Тези резултати намекват, че малките промени в изместването на гръбначния стълб могат да доведат до значително увеличена наличност на конформационното пространство на страничната верига.
Анализ на страничната верига
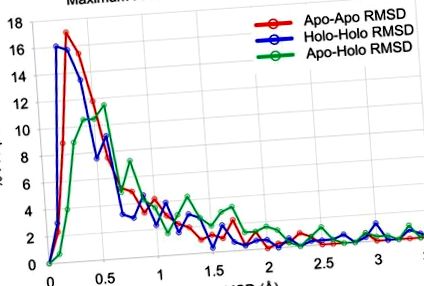
Данните за двойките апо-апо са показани в червено, двойките холо-холо са показани в синьо, а двойките апо-холо са показани в зелено. Няма статистическа значимост за разликата в апо-апо спрямо холо-холо данните (p> 0,05, разлика в медианите = 0,025 Å). Разликата между апо-холо данните и апо-апо данните е значителна (р 2 Å, 6% от семействата имат холо-холо RMSD> 2 Å, а 10% от семействата имат апо-холо RMSD> 2 Å. Това подчертава относително ниската конформационна гъвкавост, наблюдавана в гръбнака на поне 90% от семействата протеини.
Всяка точка представлява максимумите, наблюдавани в едно протеиново семейство, а броят точки на всяка секция е обозначен в черно (числата в скоби са точки със стойности> 3,5 Å). А) Максимумът на двойките апо-апо се сравнява с максимума на двойките холо-холо; 207 протеина показват RMSD ≤ 1 Å за двете групи. Б) Максимумът на двойките апо-холо се сравнява с максимума на двойките апо-апо; 201 протеина показват RMSD ≤ 1 Å и за двете групи. В) Максимумът на двойките апо-холо се сравнява с максимума на двойките холо-холо; 201 протеина показват RMSD ≤ 1 Å и за двете групи. Точките за данни за семейството са оцветени от броя на апо + холо структурите в семейството: черното има 4 структури (67 семейства с 2 апо и 2 холо структури), лилавото има 5-14 структури (184 семейства), синьото има 15-30 структури (32 семейства), а зелените имат> 30 структури (22 семейства).
маса 1
| Двойки Апо-Апо | 0.86 | 0,45 |
| Холо-холо двойки | 0,72 | 0,43 |
| Двойки Апо-Холо | 1.16 | 0,69 |
Апо структурите и холо структурите имат подобни конформационни вариации, базирани на сравнението на максималните апо RMSD спрямо максималните холо RMSD на всеки протеин (Фигури (Фиг. 1 1 и и 2А). 2А). По принцип протеините са склонни да имат еднаква конформационна гъвкавост в апо и холо състоянията. Само 10% от апоструктурите на протеините показват значително по-голяма гъвкавост на гръбначния стълб в сравнение с техните холоструктурни колеги, а 12% от холоструктурите на протеините показват значително по-голяма гъвкавост на гръбначния стълб в сравнение с техните аналогични апоструктури (31 апо семейства, 39 холо семейства). Имаше 28 семейства с максимален RMSD на Apo и Holo> 1 Å, което показва, че и двете свързващи състояния са относително гъвкави. Максималният RMSD на гръбначния стълб за апо и холо структури е и 0,05 (вж. Методи).
Както очакваме, наблюдава се по-голяма вариация при преминаването между двойки апо-холо (фигури (фиг. 1 1 и 2В и 2С). В сравнение с двойки апо-апо и холо-холо, 15% от протеините (45 протеинови семейства) имат значително повече конформационно пространство на разположение на техните гръбначни връзки между несвързаното и свързаното състояние (апо-холо двойки) в сравнение с апо (фиг. 1В) или холо (фиг. 1С). Важно е, че тези 45 протеинови семейства не са напълно излишни между два случая, споделящи само 14 протеина в тези 45.
Анализирайки измерванията на RMSD във всички протеини, количеството конформационно пространство, достъпно за апо протеини, не се различава значително от това на холо протеините (p> 0,05) (Фигури (Фиг. 1 1 и and 2A, 2A, Таблица 1). Най-вече, количеството конформационно пространство между апо и холо структури е по-голямо от това в рамките на апо (р (Фиг. 1 1 и 2В и 2С, Таблица 1). Това предполага, че гръбначните стълбове във всеки от апо и холо набора от данни заемат еднакво големи подмножества на общото налично конформационно пространство и има голямо припокриване между двата комплекта. Макар и статистически значима, разликата от 0,86 Å RMSD в апо структури, 0,72 Å RMSD в холо структури и 1,16 Å RMSD между всички структури е по-малка от 0,5 Å RMSD на промяна. Това вероятно е незначително в контекста на цяла протеинова структура и е близо до експериментална грешка, като се имат предвид В-фактори за повечето гръбначни атоми.
Ниското глобално RMSD измерване може да маскира големи измествания в много малко остатъци. Следователно, RMSD стойностите също бяха изчислени специално за атомите в обединените места на свързване, за да се фокусират върху локализирани промени, възникнали при свързването на лиганда. Изместването на гръбначния стълб на мястото на свързване е малко по-голямо от целия гръбначен стълб (Таблица 2). Разпределението на RMSD обаче по семейство и тип остава до голяма степен непроменено (S1A, S1B и S1C Фиг. В поддържаща информация). Тези резултати се наблюдават както за подмножества апо, така и за холо структура (S1D и S1E Фиг.) В Поддържаща информация.
- Домашни протеинови блокчета 5 Протеинови блокчета, които можете лесно да направите у дома Как да си направите протеинови блокчета у дома
- Как да подобрим усвояването на протеини в здравето на тялото Треньорът Люк Коутиньо има отговора
- Медена горчица Двойни хапки Протеинова закуска - SlimGenics-Direct
- Повишена гъвкавост; Oxycise!
- Повишено наддаване на телесно тегло и телесни протеини при кастрирани и адреналектомизирани плъхове, третирани с