Субекти
Резюме
Въведение
Подобни противоречия съществуват относно ролята на PGE2 в възпалението. Доказано е, че фармакологичното или генетичното инхибиране на производството на PGE2 намалява възпалителния отговор при различни модели на възпаление 15,16,17, а инхибирането на COX-2 инхибира развитието на NASH при плъхове с диабет тип 2, аргументирайки в полза на провъзпалително въздействие на PGE2. Обаче е известно също така, че PGE2 инхибира производството и освобождаването на фактора на невъзпалителния туморен цитокинов тумор некроза α (TNF-α) от макрофагите и Kupffer клетките чрез EP2 и EP4 рецептори 19,20. В допълнение, PGE2 значително инхибира активността на чернодробните естествени клетки-убийци инвитро 21. Трансгенна свръхекспресия на COX-2 в черния дроб, частично защитена от индуцирано от диетата развитие на NASH и фиброза 22. Взети заедно, последните данни може да показват, че PGE2 може да отслаби чернодробното възпаление.
Предполага се, че микрозомалната PGE синтаза 1 (mPGES-1) е ключовият ензим, отговорен за производството на по-голямата част от PGE2 в контекста на възпалението. Бихме могли да покажем, че той е надрегулиран в човешкия черен дроб от пациенти с NASH в сравнение със здравия контролен черен дроб. За да се изясни потенциалната роля на PGE2 в развитието на чернодробни NASH, контролните мишки и мишки без mPGES-1 са хранени с диета с високо съдържание на мазнини и високо съдържание на ω6-полиненаситени мастни киселини (PUFA), съдържаща холестерол. показано, че индуцира NASH при мишки 23. Докато и контролните, и мишките с дефицит на mPGES-1 развиват сравнимо затлъстяване и чернодробна стеатоза, възпалителният отговор, включително производството на TNF-α и последвалата апоптоза на хепатоцитите, е значително по-силен в черния дроб на мишките с дефицит на mPGES-1, което показва, че PGE2 може да затихне реакция по време на разработването на NASH.
Резултати
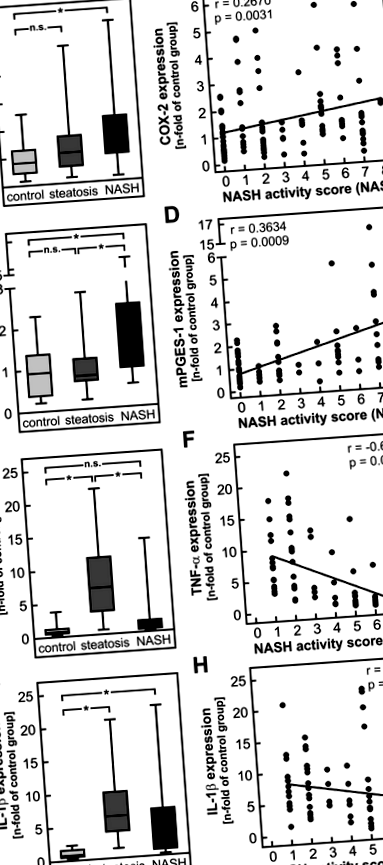
Регулиране на ключови ензими за синтез на PGE2 в черния дроб на пациенти с NASH
Нарушение на PGE2-медиирани противовъзпалителни контури за обратна връзка при мишки с дефицит на mPGES-1
Индуциран от NASH диета стеатохепатит със стеатоза, фиброза и инфилтрация на макрофаги при мишки от див тип и mPGES-1 с дефицит. Мъжки mPGES-1 +/+ (WT) или mPGES-1 -/- (KO) мишки получават диетите в продължение на 20 седмици. Представителни микрофотографии на чернодробна хистология, увеличение 10 × или 20 ×.
Както се очаква от резултатите от проучването при хора, COX-2 иРНК се индуцира около 10 пъти от диетата на NASH както при див тип, така и при дефицит на mPGES-1 животни (Фиг. 3А). Значителна индукция на COX-2 също беше определена на ниво протеин (фиг. 3В, оригинални петна в допълнителна фигура S3). За разлика от това, mPGES-1 тРНК се индуцира 3 пъти при диви животни, но липсва в черния дроб на мишки с дефицит на mPGES-1 както при стандартна, така и при NASH диета. Както се очакваше, индуцирането на ключовите ензими на синтеза на простагландин Е2 доведе до значително повишаване на нивата на чернодробен PGE2 при животни от див тип, хранени с диета от NASH (фиг. 3С). За разлика от това, нивата на PGE2 при животни с дефицит на mPGES-1 не се влияят от диетата (фиг. 3D). Въпреки че и двата генотипа бяха тествани множество търговски антитела, нито едно от тях не позволи количествено определяне на експресията на mPGES-1 на ниво протеин (данните не са показани).
В зависимост от клетъчния тип и допълнителни модулиращи фактори, PGE2 може или да усили, или да инхибира възпалителния отговор 20,27. За да се охарактеризира ролята на PGE2 в развитието на индуциран от диетата NASH, потенциални мишени надолу по веригата на PGE2 са анализирани при мишки от див тип и mPGES-1 с дефицит.
Нивото на mRNA на провъзпалителния фактор на некрозис на туморен цитокин α (TNF-α) се увеличава в черния дроб на диети с дишащ тип и мишки с дефицит на mPGES-1 в черния дроб в сравнение със съответните контроли, хранени със стандартна диета ( Фиг. 4А). Известно е, че PGE2 инхибира индукцията на TNF-α в макрофаги 20. Следователно ние предположихме, че липсата на PGE2 в мишки с дефицит на mPGES-1 може да доведе до повишена експресия на TNF-α, индуцирана от диета в тези черни дробове. В съответствие с тази хипотеза, зависимата от диетата индукция на чернодробна TNF-α иРНК е значително по-изразена при мишки с дефицит на mPGES-1, отколкото при животни от див тип (фиг. 4А). Подобен модел на индукция се наблюдава на ниво протеин: експресията на TNF-α протеин се увеличава само леко, но не значително при животни, хранени с див тип NASH, но е значително увеличена при мишки с дефицит на mPGES-1 с диета NASH ( Фиг. 4В, оригинални петна в допълнителна фигура S4).
Подобно на TNF-a, иРНК на провъзпалителния цитокин интерлевкин-1β (IL-1β) се индуцира в черния дроб на животни, хранени с диета с NASH (фиг. 4С). За разлика от TNF-α, експресията на IL-1β може да бъде увеличена с PGE2 28. Следователно диетата зависима индукция на IL-1β се очаква да бъде по-ниска при мишки с дефицит на mPGES-1. Въпреки това, нивата на мРНК на IL-1β са значително по-високи при мишки с дефицит на mPGES-1 с диета с NASH, отколкото в съответната група от див тип (фиг. 4С). Подобни резултати бяха получени и на ниво протеин: нивото на IL-1β протеин се повишава само леко, но не значително при мишки от див тип, хранени с NASH-диета, но за разлика от това се наблюдава значително двукратно увеличение на IL-1β протеин в NASH мишки с дефицит на mPGES-1 с диети (фиг. 4D, оригинални петна в допълнителна фигура S5).
Известно е, че TNF-α усилва апоптозата на хепатоцитите, което беше анализирано от терминална дезоксинуклеотидил трансфераза dUTP нick Е.nd Lанализ на abeling (TUNEL), както и имунохистохимично оцветяване на разцепена каспаза 3. В черния дроб на мишки, хранени с NASH-диета, броят на апоптотичните хепатоцити е увеличен (Фиг. 4Е, F). Освен това, броят на TUNEL- или разцепените каспаза 3-положителни клетки е значително по-висок при черния дроб на мишки с дефицит на mPGES-1 в сравнение с мишки от див тип, хранени с NASH-диета (Фиг. 4Е, F).
Клетъчни компоненти, участващи в разликите на PGE2-зависимите промени в възпалителния отговор
Резидентните макрофаги (клетки на Kupffer) и новоназначените инфилтриращи макрофаги са сред потенциалните чернодробни източници на провъзпалителни цитокини и PGE2. За да се определи дали промяна в производството на PGE2 и цитокини в макрофаги на мишки с дефицит на mPGES-1 е отговорна за усиленото производство на TNF-α и IL-1β, индуцирано от NASH, при тези животни, перитонеални макрофаги са изолирани от тези животни и стимулирани с LPS в културата. Перитонеалните макрофаги, изолирани от хранени с чау диви и мишки с дефицит на mPGES-1, не секретират откриваеми количества PGE2 в супернатантата на клетъчната култура (Фиг. 5А). След стимулация с LPS, производството на PGE2 се индуцира само в перитонеални макрофаги от див тип, докато няма засилено производство в дефицитни на mPGES-1 перитонеални макрофаги (Фиг. 5А). LPS индуцира експресия на TNF-α и увеличава секрецията на TNF-α в средата. И индукцията, и секрецията са значително по-високи в mPGES-1-дефицитни макрофаги, отколкото в клетки от див тип (Фиг. 5В, С). Очевидно постулираната автокринна PGE2-медиирана обратна инхибиторна верига е действала в перитонеални макрофаги.
За разлика от производството на TNF-α, експресията и секрецията на IL-1β в перитонеалните макрофаги не се влияе от PGE2 (Фиг. 5D, E). Следователно се предполагаше, че засиленото образуване на IL-1β в черния дроб на мишки с дефицит на mPGES-1, хранени с NASH (Фиг. 4C, D), може да се дължи на TNF-α-задействано образуване на IL-1β в хепатоцитите. В съответствие с това предположение TNF-α силно индуцира експресията на IL-1β в хепатоцитите (фиг. 6).
- 7 храни за борба с възпалението на черния дроб и панкреаса - стъпка към здравето
- 3 начина за намаляване на чернодробните ензими - wikiHow
- AIP Paleo Organ Meats and Insal Recipe Round-Up - Черни пастети, кюфтета, бургери и други! A
- 10 лесни стъпки за детоксикация на черния дроб за 2 седмици The Times of India
- 10 вкусни рецепти от цвекло за по-здрав черен дроб