Катедра по медицинска клетъчна биология, Университет Упсала, Упсала, Швеция; и
Адрес за заявки за повторно отпечатване и друга кореспонденция: J. Sällström, катедра по медицинска клетъчна биология, Университет Упсала, Биомедицински център, кутия 571, SE-751 23 Упсала, Швеция (имейл: [имейл защитен] или [имейл защитен] ).
Катедра по медицинска клетъчна биология, Университет Упсала, Упсала, Швеция; и
Катедра по медицинска клетъчна биология, Университет Упсала, Упсала, Швеция; и
Катедра по физиология и фармакология, Институт Каролинска, Стокхолм, Швеция
Катедра по медицинска клетъчна биология, Университет Упсала, Упсала, Швеция; и
Катедра по медицинска клетъчна биология, Университет Упсала, Упсала, Швеция; и
Катедра по медицинска клетъчна биология, Университет Упсала, Упсала, Швеция; и
Резюме
Високият прием на протеин е свързан с повишена скорост на гломерулна филтрация (GFR), за която се предполага, че се медиира чрез намалена сигнализация на механизма на тубулогломерулната обратна връзка (TGF). Доказано е, че азотният оксид (NO) допринася за високо индуцирана от протеини гломерулна хиперфилтрация, но специфичната отговорна изоформа на NO синтаза (NOS) не е ясна. В това проучване е разработен модел за хиперфилтрация, предизвикана от високо протеини при съзнателни мишки. Използвайки този модел, ние изследвахме ролята на TGF, използвайки нокаутиращи мишки с аденозин А1-рецептор, които нямат механизма на TGF. Освен това, ролята на различните NOS изоформи е изследвана с помощта на невронални, индуцируеми и ендотелни-NOS нокаутиращи мишки, и освен това, мишки от див тип, остро прилагани с неспецифичния NOS инхибитор н ω-нитро-1 -аргинин метилов естер (100 mg/kg). GFR се измерва последователно при мишки, на които се дава диета с ниско съдържание на протеини (8% казеин) в продължение на 10 дни, последвана от диета с високо съдържание на протеини (50% казеин) в продължение на 10 дни. Всички мишки развиват висока протеинова индуцирана хиперфилтрация в подобна степен. Тези резултати показват, че индуцираната от протеини гломерулна хиперфилтрация е независима от механизма на TGF и NOS изоформите.
хроничният прием на високо протеини е свързан с увеличаване на скоростта на гломерулна филтрация (GFR) при хора, както и при животински модели (2, 18, 19). Хиперфилтрацията като цяло има клинично значение, тъй като има потенциал да причини бъбречно увреждане, което е свързано с албуминурия, гломерулосклероза и хипертония (4).
Механизмът на тубулогломерулната обратна връзка (TGF) е контур с отрицателна обратна връзка, работещ в юкстагломеруларния апарат на всеки нефрон, който регулира натоварването на натриевия канал, за да съответства на тръбния транспортен капацитет (16). Ако GFR се увеличи, клетките на макулата денса ще открият повишена концентрация на тръбен натриев хлорид, с последващо активиране на механизма TGF. Резултатът ще бъде свиване на аферентната артериола и нормализиран GFR. Сигнализирането от клетките на макула денса към съседните аферентни артериоли включва аденозин и нокаутиращите мишки с дефицит на аденозинови А1-рецептори (A1AR) напълно нямат TGF отговора (5, 21).
Високопротеиновата индуцирана хиперфилтрация се предлага да бъде медиирана от механизма TGF (18, 24). Високият прием на протеини ще увеличи филтрацията на аминокиселини, което от своя страна ще увеличи реабсорбцията на аминокиселините в проксималните тубули. Тъй като реабсорбцията на повечето аминокиселини зависи от натрия [прегледано от Gonska и др. (7)], ще се осъществи и повишена реабсорбция на натрий. Това ще намали концентрацията на натриев хлорид в макула денса, като по този начин ще намали степента на сигнализиране на TGF, което би се очаквало да увеличи GFR.
NO е мощен вазодилататор, който се произвежда от три вида изоформи на азотен оксид синтаза (NOS); ендотелна- (eNOS), индуцируема- (iNOS) и невронална- (nNOS) NOS. В бъбречната кора изоформите, считани за най-важни при регулирането на GFR, са eNOS и nNOS. eNOS е изобилен в аферентните артериоли, а nNOS се намира главно в клетките на макула денса [прегледано от Mount and Power (12)]. NO се счита за възможен медиатор на хиперфилтрация, тъй като отделянето на цикличен гуанозин монофосфат с урината се увеличава по време на прием на високо протеини (8), а неспецифичното инхибиране на NOS намалява хиперфилтрацията (25). Освен това последните данни показват специфична роля на nNOS в хиперфилтрацията (27).
В настоящото проучване разработихме модел за индуцирана от протеини хиперфилтрация при съзнателни мишки. Тази техника позволява последователни измервания при едно и също животно и елиминира риска от непредсказуеми ефекти на анестезията. Използвайки този модел, ние изследвахме два възможни механизма, които биха могли да предизвикат хиперфилтрация, индуцирана от високо протеини: намалена активност на TGF поради повишена проксимална реабсорбция и увеличена продукция на NO, която директно разширява аферентната артериола.
Всички експерименти са одобрени от регионалния комитет по етика на животните в Упсала и са извършени в съответствие с международните насоки на Националния здравен институт за употреба и грижи за лабораторни животни. Бяха проведени четири експериментални серии при мишки.
Серия 1: разработване на модел за индуцирана от високо протеини гломерулна хиперфилтрация при мишки.
Серия 2: Ролята на TGF в развитието на гломерулна хиперфилтрация.
Влиянието на TGF е изследвано с използване на женски нокаут A1AR (A1AR -/-) и съответни мишки от див тип (A1AR +/+) от щама, разработен от Johansson и колеги (9) и обратно кръстосан от лабораторията Jackson (Bar Harbor, ME) ) към фон C57BL/6J. GFR за първи път е измерен след 10 дни на диета с ниско съдържание на протеини. След това диетата се превключва на високо протеинова и GFR се измерва отново след 10 дни.
Серии 3 и 4: роля на NOS в развитието на гломерулна хиперфилтрация.
В серия 3, влиянието на различни NOS изоформи е изследвано с помощта на специфични NOS нокаутиращи мишки (eNOS -/-, nNOS -/- и iNOS -/-) върху C57BL/6J фон и съответстващи C57BL/6J диви видове, отглеждани в отдела от хомозиготно размножаване двойки. Животните редовно са генотипирани с помощта на PCR, за да се провери целостта на щамовете. Мъжки и женски мишки (на възраст 3-6 месеца) бяха използвани в равни пропорции (~ 50% мъжки/женски) във всички групи. GFR за първи път е измерен след 10 дни на диета с ниско съдържание на протеини. След това диетата беше превключена на високо протеинова и GFR беше измерена отново след 10 дни. В серия 4, същата процедура се повтаря с мъжки мишки от див тип, на които е направена интраперитонеална инжекция на неспецифичния NOS инхибитор н ω-нитро-1 -аргинин метилов естер (1 -NAME; 100 mg/kg) или носител (физиологичен разтвор) 30 минути преди двете измервания на GFR.
Диети.
На животните се дава или диета с ниско съдържание на протеини, или диета с високо съдържание на протеини (съответно 8 и 50% казеин; Lantmännen, Kimstad, Швеция). Диетите бяха изокалорични (14 kJ/g) и имаха подобен електролитен състав. Преди да започнат експериментите, животните се поддържат на стандартната диета на животновъдния обект, съдържаща 18,5% протеин (R36; Lantmännen).
Измерване на скоростта на гломерулна филтрация.
Клирънсът на инулина като измерване на GFR се определя при съзнателни животни чрез техника, модифицирана от метода, описан от Qi et al. (14). Животните бяха задържани в специално изработена камера от плексиглас и им беше приложена болусна инжекция на [3 H] метокси-инулин (~ 85 kBq; American Radrolabeled Chemicals, St. Louis, MO, USA), разтворен в 200 μl физиологичен разтвор във вената на опашката, като се използва спринцовка от 1 ml, снабдена с 27-G игла. След това животните бяха върнати в клетките си. Кръвни проби (∼5 μl всяка) са взети от малък разрез на върха на опашката в хепаринизирани стъклени капиляри на 1, 3, 7, 10, 15, ∼35, 55 и 75 минути. Плазмената концентрация на инулин се определя чрез течен сцинтилационен брояч (Wallac 1409, Wallac Oy, Турку, Финландия). Клирънсът на инулина се изчислява чрез разделяне на дадената интравенозна доза на общата площ под времевата крива на плазмения инулин (AUC0-∞). AUC0-∞ беше изчислена, като се използва анализ на фармакокинетичните данни без отдели от сумирането на трапецовидните области, които се образуват чрез свързване на точките с данни (20). Площта на крайната фаза, т.е. от 15 минути до безкрайност (включително остатъчната площ след последното измерване), беше изчислена въз основа на уравнението за наклона. Площта преди първото измерване беше изчислена с помощта на линейна обратна екстраполация.
експресия на иРНК на NOS изоформи.
Бъбречната кора от бъбреци от див тип и различните NOS нокаутиращи животни на високо протеинова диета се отделя и незабавно се замразява в течен азот. Общата РНК беше извлечена с помощта на RNeasy mini kit и пробите бяха обратно транскрибирани с помощта на QuantiTect комплект за обратна транскрипция (Qiagen, Hilden, Германия). Експресията на NOS беше количествено определена с комплект SYBR Green qPCR, използвайки термоциклер в реално време (LightCycler, Roche Diagnostics, Манхайм, Германия) и свързан с експресията на 18S чрез метода ΔCt. Последователностите на грундовете са предоставени в допълнителните данни.
Статистика.
Всички стойности са изразени като средни стойности ± SE. Отчетеният ΔGFR след лечение с високо протеинова диета се изчислява като средна стойност на индивидуалното нарастване при всички животни от групата. Бяха извършени множество сравнения между генотиповете, използвайки еднопосочен ANOVA, и хиперфилтриращият отговор беше изследван, използвайки двупосочен ANOVA с повтарящи се мерки. Ако ANOVA бяха значителни, беше извършен защитен най-малко значим различен пост хок тест на Fisher. Извършени са единични сравнения с помощта на Student т-тест. За всички сравнения, P 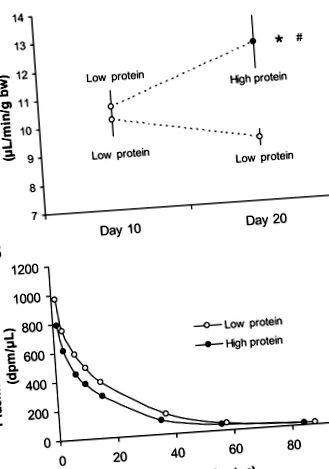
Фиг. 1.A: скорост на гломерулна филтрация при мишки от див тип, получаващи нискобелтъчна диета в продължение на 10 дни, последвана или от високо- (н = 7) или ниско- (н = 6) протеинова диета за 10 дни. Б.: представителна крива на изчезване на инулин от едно животно, съответно на диета с ниско и високо съдържание на протеини. *P
Фиг. 2.Телесно тегло (A), бъбречно тегло (Б.), съотношение между бъбреците и телесното тегло (° С) и гломерулен обем (д) за мишки от див тип в серия 1 дадено или ниско- (н = 6) или с високо съдържание на протеини (н = 6) диета. *P
Серия 2.
Мишките A1AR -/- имат подобен GFR и развиват подобна хиперфилтрация, като съответните им контроли от див тип (Фиг. 3). Увеличението при мишките A1AR -/- беше 5,0 ± 1,8, а при мишките от див тип 6,4 ± 2,3 μl · min −1 · g телесно тегло −1. A1AR -/- мишките са имали малко по-високо телесно тегло от контролите си от див тип (ниско съдържание на протеин: 33 ± 2 срещу 27 ± 1 g; високо протеин: 33 ± 2 срещу 28 ± 1 g).
Фиг. 3.Скорост на гломерулна филтрация в див тип (н = 6) и аденозинови А1-рецепторни нокаутиращи мишки (A1AR -/-, н = 6) дава диета с ниско съдържание на протеини в продължение на 10 дни, последвана от диета с високо съдържание на протеини в продължение на 10 дни. *P
Серия 3.
Животните, които нямат nNOS, eNOS или iNOS, развиват подобна степен на хиперфилтрация като техните контроли от див тип (Фиг. 4 и Таблица 1). ENOS -/- показва по-нисък GFR в сравнение с дивите видове и при двете диети. NNOS -/- имаше по-нисък коефициент на коефициент на полезна стойност при диета с ниско съдържание на протеини, но това не беше значително при диетата с високо съдържание на протеини (P = 0,17). За iNOS -/- не са открити разлики в GFR в сравнение с дивите видове. iNOS -/- и eNOS -/- имаха малко по-ниско телесно тегло от техните контроли от див тип; тази разлика обаче е била значителна само при високо протеиновата диета. (Маса 1). Не е открита разлика между генотиповете в експресията на бъбречна кортикална тРНК на различните NOS изоформи (Фиг. 5).
Фиг. 4.Скорост на гломерулна филтрация в див тип (н = 8), ендотелна- (eNOS -/-, н = 8), невронал- (nNOS -/-, н = 6) и индуцируем- (iNOS -/-, н = 9) нокаутиращи мишки с азотен оксид синтаза, получаващи диета с ниско съдържание на протеини в продължение на 10 дни, последвана от диета с високо съдържание на протеини в продължение на 10 дни. *P
Таблица 1. Телесно тегло и увеличаване на скоростта на гломерулна филтрация при мишки от див тип, eNOS -/-, nNOS -/- и iNOS -/-, които получават диета с ниско съдържание на протеини в продължение на 10 дни, последвана от диета с високо съдържание на протеини за 10 дни (серия 3)
Стойностите се изразяват като средни стойности ± SE. GFR, скорост на гломерулна филтрация; NOS, синтаза на азотен оксид. Див тип: н = 8; ендотелна NOS нула (eNOS -/-): н = 8; невронална NOS нула (nNOS -/-): н = 6; индуцируем NOS null (iNOS -/-): н = 9.
* P
Фиг. 5.Относителна експресия на иРНК на различните NOS изоформи в див тип (н = 7), eNOS -/- (н = 4), nNOS -/- (н = 5) и iNOS -/- (н = 6) нокаутиращи мишки с азотен оксид синтаза, като се има предвид високо протеиновата диета.
Серия 4.
Животните, на които е дадено l -NAME, са имали по-нисък коефициент на коефициент на полезно действие както при диети с ниско, така и с високо съдържание на протеини, в сравнение с третирани с носител мишки. Третираните с l -NAME животни показват хиперфилтрация при високо протеинова диета (Фиг. 6A). Въпреки че абсолютното увеличение на GFR (GFR на високобелтъчна диета-GFR на диета с ниско съдържание на протеини) е значително по-ниско по време на лечението с l -NAME в сравнение с животните, на които е даден само носител (1,2 ± 0,6 срещу 3,0 ± 0,7 μl · min -1) g тяло wt −1), относителното увеличение е сходно и в двете групи (фиг. 6Б.).
Фиг. 6.Скорост на гломерулна филтрация при мишки от див тип, получаващи диета с ниско съдържание на протеини в продължение на 10 дни, последвана от диета с високо съдържание на протеини в продължение на 10 дни. A: Преди да бъде измерен GFR, животните бяха предварително обработени с носител (н = 10) или 1 -ИМЕ (100 mg/kg телесно тегло; н = 10). Б.: относителна промяна в GFR, предизвикана от високо протеиновата диета. *P
По време на прием на високо протеини, натриево зависимата реабсорбция на аминокиселини ще се увеличи в проксималните тубули. В по-ранни експерименти демонстрирахме, че плъховете, хранени с високо протеинова диета, въпреки повишения си GFR, имат намалена концентрация на натриев хлорид в ранните дистални тубули, което показва намалена концентрация в макула денса (18). По този начин сигналът за обратна връзка към аферентната артериола е намален, което може да действа за увеличаване на GFR. Според този обяснителен модел GFR в A1AR -/- без механизъм TGF, следователно се очаква да бъде по-малко засегнат от приема на протеини в храната. Въпреки това, в настоящото проучване, когато тези нокаутиращи мишки са били лекувани с високо протеинова диета, те са показали подобна степен на хиперфилтрация като мишки от див тип, което показва, че хиперфилтрацията се извършва независимо от механизма на TGF.
Гломерулната хиперфилтрация се открива и по време на диабет и е свързана с повишен риск от развитие на микроалбуминурия и нефропатия по-късно в заболяването (1, 11, 15). Предполага се, че това увеличение на GFR зависи и от механизма на TGF (23). Според тази теория, гломерулната хиперфилтрация е вторична по отношение на увеличения проксимален котранспорт на натрий-глюкоза. Резултатното намаляване на натоварването с натриев хлорид към макулата денса ще намали TGF реакцията, като следователно ще увеличи GFR. Последните данни обаче демонстрират запазена хиперфилтрация при два модела диабет в A1AR -/-, което показва, че механизмът на TGF не е необходим за хиперфилтрация (6, 22). Следователно, намаленото натриево натоварване на макулата денса, не увеличава GFR чрез механизма TGF в дългосрочен план, нито при хиперфилтрация, причинена от диабет, или при висок прием на протеин.
В настоящето, както и в няколко други модела на хиперфилтрация, индуцирана от хроничен прием на високо протеини, се съобщава за повишен гломерулен обем. Тъй като нито инхибирането на NOS, нито дефицитът на TGF не са повлияли степента на хиперфилтрация, възможно е увеличеният гломерулен обем да допринася пряко за повишената GFR. Доказано е, че съдовият ендотелен растежен фактор участва в развитието на гломерулна хипертрофия по време на хроничен прием на висок протеин (17) и може да бъде цел за бъдещи проучвания относно гломерулния растеж и хиперфилтрацията. Освен това, тъй като настоящото проучване се занимава само с хроничната ситуация на повишен прием на протеин, възможно е NO и механизмът на TGF да са важни за острия хиперфилтриращ отговор на аминокиселинна инфузия или богата на протеини храна.
В заключение, гломерулната хиперфилтрация, индуцирана от висок прием на протеин, възниква независимо от механизма на TGF и изоформите на NOS. Въпреки това, по време на базални условия, NO, получен от eNOS и nNOS, е важен за поддържане на нормален GFR. Тъй като индуцираната от високо протеини гломерулна хиперфилтрация се случва независимо от тези важни регулаторни системи, вероятно е гломерулният растеж, който увеличава площта на филтриране, да допринесе пряко за увеличената GFR.
Перспективи и значение
Настоящото проучване беше проведено с помощта на сравнително нова методология за измерване на GFR, която се оказа проста и изключително полезна за оценка на хиперфилтриращия отговор на промените в хранителния протеинов товар. Нито един от изследваните фактори (т.е. специфични NOS изоформи или TGF) не е установен да допринася значително за хиперфилтрация, индуцирана от високо протеини. Описаният протокол обаче може да бъде полезен в бъдещи проучвания, насочени към механизмите, причиняващи хиперфилтрация.
Това проучване беше финансово подкрепено от Шведския изследователски съвет (K2009-64X-03522-38-2), Фондация Валенберг, Консорциум Валенберг Север, Шведската фондация за сърце и бели дробове (20070198) и Фондация Ингабрит и Арне Лундберг.
Не се декларират конфликти на интереси, финансови или други, от авторите.
- Независим преглед Отслабване на 9 седмици Бебе Най-добрите хапчета за отслабване DA-Регионален полеви офис III
- Незабавната каша може да не е толкова здравословна, колкото се рекламира The Independent The Independent
- Как яденето на крекер може да ви подскаже колко въглехидрати трябва да изядете The Independent The Independent
- Корабът-призрак на Любов Орлова, носещ плъхове-канибали, „може да се насочи към Великобритания“ The Independent The
- Колко дълго човек може да оцелее без вода The Independent The Independent
