Резюме
Заден план
Оцелелите от рак на гърдата с наднормено тегло са по-склонни да имат отрицателни резултати от рак на гърдата. Биомаркерите, свързани с инсулиновата резистентност, могат да помогнат да се обясни тази отрицателна връзка. Загубата на тегло е свързана с подобрения в инсулиновата чувствителност. Нашата цел беше да идентифицираме въздействието на поведенческа интервенция за отслабване върху индексите на инсулинова резистентност.
Методи
Преживелите рак на гърдата с наднормено тегло, завършили първоначалната терапия на рака, са били включени в 6-месечна поведенческа интервенция за отслабване, която включва намаляване на калориите, упражнения и модификация на поведението. Биомаркери, свързани с инсулиновата резистентност, са получени на изходно ниво и след интервенцията. Резултатите от участниците, които са постигнали ≥5% загуба на тегло, са сравнени с тези, които са загубили по-малко тегло.
Резултати
Въпреки че не са имали диабет като предварително съществуваща диагноза преди проучването, 69% от всички участници се считат за преддиабет или диабет на изходно ниво въз основа на дефинициите на Американската диабетна асоциация. Участниците, които са постигнали ≥5% загуба на тегло, са имали значително по-нисък инсулин на гладно, AUC инсулин и инсулинова резистентност, измерени чрез HOMA-IR. Функцията на бета-клетките намалява, както се очаква, когато инсулиновата резистентност се подобри. Освен това нивата на лептин намаляват.
Заключения
Преживелите рак на гърдата, които са постигнали ≥5% загуба на тегло, показват значително подобрение в индексите на инсулинова резистентност. Въпреки критериите за изключване на диабета по време на записването, голяма част отговаря на критериите за преддиабет или диабет в началото. Изглежда, че преддиабетът е недостатъчно признат при оцелелите с наднормено тегло на гърдата. Поведенческите интервенции за отслабване могат да доведат до загуба на тегло и подобрения в биомаркерите, свързани с резултатите от рака на гърдата, а освен това могат да намалят шанса за развитие на диабет.
Пробна регистрация
Заден план
Смята се, че 66% от преживелите рак на гърдата са с наднормено тегло или затлъстяване [1]; оцелелите от затлъстяване от рак на гърдата имат 30% по-висок риск от рак на гърдата и обща смъртност в сравнение с жените с нормално тегло [2, 3]. Увеличаването на теглото след терапията също допринася за риска. Епидемиологичните проучвания показват, че всеки прираст от 5 кг наддаване на тегло е свързан с 12% увеличение на смъртността от всички причини и 13% увеличение на специфичната смъртност от рак на гърдата [4].
Инсулиновата резистентност и свързаните с нея пътища представляват правдоподобно механистично обяснение за връзката между наднорменото тегло и отрицателните резултати от рака на гърдата [5]. В предклиничните изследвания инсулиновата резистентност е свързана с пътища, замесени в развитието и развитието на рака, включително пътя на активирана от митоген протеин киназа (MAPK) и пътя на фосфатидилинозитол 3-киназата (PI3K) [6]. Епидемиологичните данни идентифицират двукратно увеличаване на риска от рецидив на рак на гърдата и трикратно повишен риск от смърт при оцелели от рак на гърдата с най-високи нива на инсулин на гладно [5]. Метаболитните хормони, получени от мастна тъкан, като адипокините лептин и адипонектин, модулират инсулиновата чувствителност, активират NFkB и mTOR пътя и също са свързани с риск от рак на гърдата [7, 8].
Излишното затлъстяване е основен двигател на инсулиновата резистентност [9], а загубата на тегло със или без упражнения може да доведе до значителни подобрения в инсулиновата резистентност за жените след менопаузата [10]. Положителни промени в свързаните с инсулина параметри са идентифицирани с интервенции за отслабване, предоставени на оцелелите от рак на гърдата. Сред жените, които са постигнали ≥ 5% загуба на тегло с поведенческа интервенция за отслабване, е установено значително намаляване на лептина и серумния инсулин (стр
Методи
Дизайн и допустимост
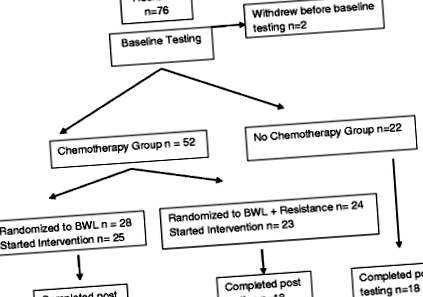
24-седмична интервенционна интервенция за поведенческа загуба на тегло (BWL) беше тествана с дизайн на проучване от три рамена преди теста, за да се определи осъществимостта и ефективността (фиг. 1). Основният резултат от проучването е загуба на тегло и резултатите са публикувани по-рано [13]. Накратко, бяха наети оцелели от рак на гърдата, които са получавали (CHEMO) и не са получавали химиотерапия (NO CHEMO). Жените, получили химиотерапия, бяха рандомизирани да получат стандартната BWL интервенция или същата интервенция с добавена тренировка за съпротива (CHEMO срещу CHEMO-RT). Рамото NO CHEMO служи като група за сравнение. Изследването е одобрено от Институционалния съвет за преглед в Университета на Върмонт (UVM).
Кръв е била на разположение за 70 от 74 участници в изходното тестване. Изходно и след тестване на кръвта е на разположение за 51 от 53 участници, завършили проучването
Бяха наети жени с ранен стадий на рак на гърдата, завършили първоначалната онкологична интервенция поне 6 седмици преди започване на проучването. Онкологичната интервенция включва операция ± лъчева и химиотерапия в зависимост от изследваната ръка. Критериите за допустимост включват индекс на телесна маса (ИТМ) между 26 и 50 kg/m 2, постменопаузален статус и възраст ≤ 65 години. Жените, които са имали метастатичен рак на гърдата или съществуваща диагноза захарен диабет на изходно ниво, са били недопустими. За анализа на биомаркерите, докладван тук, жените, загубили ≥5%, са сравнени с тези, които са загубили 2 (m). Съставът на тялото, включително общата мастна маса и масата без мазнини, беше оценен с помощта на двойна енергийна рентгенова абсорбциометрия (Lunar DPX-L денситометър, Lunar Co, Madison WI). Свързаните с дейността енергийни разходи (AEE) и продължителността на физическата активност бяха измерени с помощта на акселерометър BodyMedia® Body Monitoring System, носен в продължение на 7 дни. AEE включва калории, изразходвани за дейности с ≥ 3 метаболитни еквивалента (METS). Продължителността на физическата активност включваше минути на дейност, извършена при ≥3 METS.
Мерки за инсулинова резистентност
Кръвни проби бяха събрани след бързо нощуване (≥ 12 часа) и 24 часа бездействие на изходно ниво и завършване на проучването. Тестът за орална толерантност към глюкоза (OGTT) беше завършен. Кръвта е взета на 0, 30, 60, 90 и 120 минути след 75 g перорално натоварване с глюкоза. Стойностите на плазмената глюкоза бяха определени с помощта на автоматизиран глюкозооксидазен метод (YSI Stat Plus Analyzer). Кръвта се оставя да се съсирва за 30-45 минути и след това се центрофугира за 10 минути. Серумът се пипетира от клетъчния слой и се съхранява при - 80 ° C.
Серумният инсулин е измерен с помощта на Roche Elecsys 2010 в Лабораторията за клинични биохимични изследвания, Colchester VT и се записва в μU/ml (1 μU/ml = 6.594 pmol/L). Проведени са проби за контрол на качеството, измерващи ниски, средни и високи диапазони. Средният коефициент на вариация в рамките на анализа за пробите за контрол на качеството с нисък, среден и висок диапазон е съответно 2,18%, 1,64% и 2,01%. Поради пулсиращия характер на инсулина са получени 2 мерки на гладно в допълнение към изходното ниво за OGTT (- 15, - 10, 0) и осреднени.
Данните от OGTT бяха използвани, за да се идентифицира дали преддиабетът или диабетът присъстваха на изходно ниво и използваха определенията на Американската диабетна асоциация (ADA) [21]. Преддиабетът или повишеният риск от диабет се определя като глюкоза на гладно от 100 mg/dl до 125 mg/dl (включително) или 2-часова плазмена глюкоза по време на 75 mg OGTT от 140 mg/dl до 199 mg/dl (включително ). Диабетът се определя като глюкоза на гладно ≥ 126 mg/dl или 2-часова плазмена глюкоза по време на 75 mg OGTT от ≥ 200 mg/dl.
Общите глюкозни и инсулинови области под кривата (AUC) се определят по трапецовидния метод [22], като се използват глюкозни и инсулинови мерки, получени с OGTT. Индексът Matsuda, мярка за инсулинова чувствителност, се изчислява от OGTT серума и инсулиновите отговори [23]. Индексът Matsuda отразява съставна оценка на чернодробната и мускулната чувствителност към инсулин [24]. Освен това инсулиногенният отговор след 30 минути се изчислява като индекс на ранна секреция на инсулин.
Оценката на хомеостатичния модел (HOMA) се използва за оценка на инсулиновата резистентност (IR), като се използват плазмените глюкоза на гладно и стойностите на инсулина на гладно [25]. Инсулиновата резистентност се изчислява по формулата: инсулин (μU/ml) x глюкоза (mg/dl)/405. Нормалната IR се дефинира като 1. Съществува добра корелация (0.88, 0.85 и 0.73 [26] между оценките на IR, получени от HOMA и евглиемичната скоба. HOMA-% B, изчислена е и оценка на бета-клетъчната функция от пробите на гладно. Връзката между HOMA-IR и HOMA-% B е обратна хиперболична крива. В условията на нормален глюкозен толеранс по-високите степени на инсулинова резистентност са свързани с по-висока бета клетъчна функция. [27].
Серумният лептин и общият адипонектин са измерени от Лабораторията за клинични и биохимични изследвания при UVM, като се използва твърдофазен, ензимно свързан имуносорбентен анализ (R&D системи). Всички проби от всеки момент от изследването са анализирани в една партида и са пуснати в два екземпляра. Средният коефициент на вариация в рамките на анализа за пробите за контрол на качеството с нисък, среден и висок диапазон са съответно 5,27%, 5,46% и 8,75% за лептин и 5,99%, 6,28% и 7,16% за адипонектин. Изчислено е съотношение лептин към адипонектин.
Статистически методи
Изследвани са честотите и описателната статистика на демографските и изходните променливи, включително възраст, време от поставяне на диагнозата, етап, получаване на химиотерапия, лъчева и антиестрогенна терапия, ИТМ при диагностициране и при започване на изследването, продължителност на физическата активност при започване на изследването и диагностика на преддиабет и диабет. Оригиналните три групи имат сходен изходен състав на тялото. И трите групи загубиха значително количество тегло от изходното ниво до мерките след интервенция, но няма значителни разлики в загубата на тегло между групите [13]. Участието им в упражненията (минути, прекарани в умерена/енергична физическа активност) също не се различава значително. В резултат на това данните от трите групи бяха комбинирани и дихотомизирани чрез загуба на тегло ≥ или
Резултати
Потокът от участници през изследването е илюстриран на фиг. 1. Набрани са седемдесет и шест участника. Налични са кръвни проби за 70 субекта. Изходните и 6-месечните кръвни проби са пълни за 51 участници. Липса на вземане на кръв се е случило поради трудности при получаване на достъп и последващ отказ на субекта. Изходните медицински характеристики, включително възраст, характеристики на рака и изходен ИТМ за тези, които са извършили и не са завършили проучването, са сходни между трите групи (данните не са показани). Както се очакваше, имаше значителни разлики в стадия и възрастта, тъй като две групи са получили химиотерапия, а хората, които получават химиотерапия, имат по-напреднал рак, изискващ химиотерапия и често са по-млади.
Няма разлика във възрастта, времето от поставянето на диагнозата, получаването на антиестрогенна терапия или радиацията между тези, които са загубили Таблица 1 Базови характеристики на участниците по категория за отслабване
Антропометрични резултати
Интервенцията доведе до значителна загуба на тегло, което беше основният резултат. Използвайки намерение за лечение на анализ, всички участници в комбинация са загубили 4,5 кг (стр Таблица 2 Анализ на ковариацията на антропометричните мерки по групи за отслабване
Нито една от групите за отслабване не е претърпяла значителна промяна в AEE или умерена продължителност на физическата активност в резултат на интервенцията. Обаче тези, които са загубили ≥5%, са имали по-голям разход на активна енергия и са прекарали значително повече минути за умерена активност от тези, които са загубили Таблица 3 Анализ на ковариацията на променливите на упражненията, коригирани за възрастта и изходния ИТМ по група за отслабване
Резултати от инсулиновите параметри
В началото много участници бяха идентифицирани с нарушена глюкоза, било предидиабет или диабет, въз основа на глюкоза на гладно или глюкоза на гладно след 120 минути след OGTT (Таблица 1). По-голям дял от губещите
Нивата на лептин след интервенция са значително по-ниски при тези, които губят ≥5%, отколкото тези, които са загубили
Дискусия
Преживелите рак на гърдата с наднормено тегло имат отрицателни резултати в сравнение с тези с нормално тегло [2, 4]. Клетъчните сигнални промени, свързани с инсулиновата резистентност и свързаните с нея параметри, предлагат правдоподобен механизъм за отрицателните резултати. Смята се, че понижаването на серумния инсулин с 25% може да подобри преживяемостта с 5%, същия порядък като адювантната химиотерапия [29]. Загубата на тегло подобрява параметрите на инсулиновата резистентност сред общата популация [10]. По същия начин настоящото проучване идентифицира благоприятни промени в инсулиновите параметри сред оцелелите от рак на гърдата, които постигат загуба на тегло.
Въпреки изключването на лица с предварително съществуваща диагноза диабет и използване на лекарства за диабет, голяма част от участниците са имали преддиабет и диабет в началото на базата на дефинициите на ADA [21]. Почти 70% честотата на преддиабет и диабет на изходно ниво сред оцелелите от рак на гърдата е по-висока от очакваната. В обща популация от жени в постменопауза, получаващи подобна интервенция с BWL, 33% са имали нарушена глюкоза на гладно на изходно ниво [10]. Въпреки сходния ИТМ на изходно ниво, честотата на нарушен метаболизъм на глюкозата е по-висока при губещите участници
Заключение
Инсулиновата резистентност е рисков фактор за повишен риск от рецидив и лоша прогноза при оцелелите от рак на гърдата. Хората, които постигат минимум 5% загуба на тегло, са имали значително по-ниска инсулинова резистентност и намалени нива на инсулин на гладно. Ако може да се постигне загуба на тегло, оцелелите от рак на гърдата имат потенциала да подобрят параметрите, свързани с инсулина, което може да намали шансовете за отрицателни резултати от рак на гърдата. Освен това, преживелите рак на гърдата с наднормено тегло може да имат по-висока от очакваната честота на неидентифициран диабет и метаболитни промени, предполагащи преддиабет, и постигането на загуба на тегло може да намали риска от диабет. Повишеният скрининг за диабет може да бъде оправдан при преживелите популации с наднормено тегло или затлъстяване. Необходими са изследвания, за да се установи дали промените в инсулиновите пътища или други биомаркери се превръщат в подобрена преживяемост и да се идентифицират ефективни интервенции за отслабване за оцелелите от рак на гърдата, които имат трудности при отслабване.
- Инсулиновата резистентност се подобрява повече при жените, отколкото при мъжете, в комбинация с интервенция за отслабване
- Как отслабването може да повлияе на мускулната маса, метаболизма и телесните мазнини
- Поддържаната загуба на тегло в продължение на 1 година увеличава инсулиновата чувствителност при жените
- Японски билки за отслабване, одобрени от FDA The Impact Genome Project®
- Предоставяне на храна като стратегия за подпомагане на отслабването и подобряване на метаболитните параметри в типа