Водородният сулфид (H2S) е метаболит и сигнална молекула в биологичните тъкани, която регулира много физиологични процеси.
Свързани термини:
- Метаболитен път
- Цистеин
- Сулфат
- Азотен оксид
- Сулфид
- Алфа окисление
- Бактерия
Изтеглете като PDF
За тази страница
Водороден сулфид
Излагане на околната среда (данни за мониторинг във въздуха, водата, седиментите, почвата и биотата)
Концентрациите на сероводород в атмосферния въздух варират от 0,11-0,33 ppb и в градските райони обикновено са
Водороден сулфид
Леонард Г. Форган, Джон Александър Доналд, в Handbook of Hormones, 2016
Откритие
Водородният сулфид (H 2S) е естествено съединение, което се съдържа в много физически и биологични системи. Той е силно токсичен при високи концентрации, токсичността се дължи на инхибирането на митохондриалната цитохром с оксидаза (ССО), карбоанхидразата (СА), моноаминооксидазата, Na +/K + -ATPase и холинестеразите [1]. Едва през 1996 г. бяха признати физиологичните сигнални свойства на H2S. Първоначално идентифициран като невромодулатор [2], оттогава са публикувани множество изследвания, показващи участието на H2S в сърдечно-съдовата система и почти всички други органи, изследвани до момента [3] .
Водороден сулфид
C Механизми на действие
Доказано е, че водородният сулфид взаимодейства с голям брой ензимни системи (напр. Алкална фосфатаза, аденозин фосфатаза и тези, които участват в синтеза на протеини), но цитохром оксидазата е определена като критична ензимна цел за токсичност. Това е подобно на действието на цианида, но малко по-силно. Цитохром оксидазата участва в електронната транспортна система в окислителното фосфорилиране, което генерира клетъчна енергия. По този начин ензимното инхибиране би довело до намалена наличност на кислород и клетъчна аноксия. Предполага се, че функционалната хистотоксична (тъканна токсичност) хипоксия е основен механизъм на токсичност в тъкани с голямо търсене на О2. H2S не уврежда транспорта на O2 от хемоглобина, нито предизвиква образуване на сулфхемоглобин, както се съобщава в по-ранни проучвания. При ниски концентрации H2S може също да инхибира синтеза на хем и може би да наруши метаболизма на желязото. В допълнение към биохимичните ефекти, прякото дразнещо действие върху лигавиците и стабилизирането (т.е. анестезия) на възбудими тъкани също може да играе роля в общите токсични реакции.
Водороден сулфид в редокс биологията, част Б
Бурку Гемичи, Джон Л. Уолъс, в Методи в ензимологията, 2015
Резюме
Водороден сулфид в редокс биологията, част А
Вивиан С. Лин,. Кристофър Дж. Чанг, в Методи в ензимологията, 2015
Резюме
Водородният сулфид е окислително-редокс активен вид сяра, който се генерира ендогенно в системите на бозайниците като антиоксидант и сигнална молекула за подпомагане на клетъчната функция. Основните и повсеместни действия на сероводорода изискват чувствителни и специфични методи за проследяване на тази биомолекула, тъй като тя се произвежда в живите организми с времева и пространствена регулация. В този контекст, медиираното от сероводород редукция на азид до амин е полезен метод за органичен синтез и тази реакция е успешно използвана за получаване на биосъвместими флуоресцентни сонди за откриване на сероводород in vitro и в клетки. Тази глава предоставя протоколи и насоки за прилагане на флуоресцентни сонди на базата на азиди за откриване на сероводород в живи системи, включително протокол, използван за откриване на ендогенен сероводород в живи единични клетки с помощта на конфокален микроскоп.
Токсини за околната среда и сърцето
Саханд Рахнама-Могадам,. Ричард А. Ланг, в Сърце и токсини, 2015
3.20.7 Водороден сулфид
Сероводородът е водоразтворим, безцветен газ с отчетлива миризма на изгнили яйца. Хората, изложени на сероводород при концентрации над 100 до 150 ppm, могат да загубят способността да миришат на сероводород след 2 до 15 минути непрекъснато излагане поради обонятелна умора. 310 311 Водороден сулфид се произвежда от утайки от отпадъчни води, течен оборски тор, серни горещи извори и природен газ. Също така е страничен продукт от различни промишлени процеси като рафиниране на нефт, преработка на дървесна целулоза, производство на вискоза, преработка на оборски тор, преработка на захарно цвекло, преработка на риба и настилка с горещ асфалт. 310 Механизмът на неговата токсичност е чрез прекъсване на митохондриалното клетъчно дишане чрез инактивиране на цитохром оксидазата. 310,311
Пациентите с отравяне със сероводород могат да се проявят с увреждане на лигавицата, хемоптиза, тахикардия, цианоза, лактатна ацидоза и загуба на съзнание. Миокарден инфаркт, миокардит и разширена кардиомиопатия са описани след излагане на сероводород. 310 Откриването на сероводород при пациенти, за които се подозира експозиция, може да се осъществи чрез измерване на нивата на тиосулфат чрез хроматография на кръвта или тъканите. 311,312
Жертвите на отравяне със сероводород трябва да бъдат отстранени от мястото на излагане и да се прилага кислород. Хипербаричният кислород може да бъде от полза, въпреки че доказателствата за неговата ефикасност са анекдотични. 310 313 инхалаторен амил нитрит и интравенозно натриев нитрит са използвани като антидоти и са ефективни, ако се прилагат в рамките на минути след излагане на сероводород. Нитритите индуцират метхемоглобин, който конкурентно свързва сулфидния йон, като по този начин освобождава цитохром оксидазата. Полученото съединение, сулфетхемоглобин, може да се метаболизира и екскретира. 312 Все пак трябва да се внимава, тъй като нитритите могат да предизвикат хипотония и метхемоглобинът може да намали доставката на кислород.
Водороден сулфид в редокс биологията, част А
Xinggui Shen,. Кристофър Г. Кевил, в Методи в ензимологията, 2015
1.2 Басейни със сероводород
Водородният сулфид се произвежда от различни източници, включително химични реакции (напр. Водороден газ и елементарна сяра, железен сулфид и HCl, алуминиев сулфид и вода), сулфат-редуциращи бактерии и в тъкани на бозайници. По време на производството на сероводород в тъканите на бозайници участват три тъканно специфични ензима, а именно цистатионин-β-синтаза, цистатионин-γ-лиаза и 3-меркаптосулфуртрансфераза (Moore, Bhatia и Moochhala, 2003).
Лабилно киселинният сулфид и свързаната сулфанова сяра са две основни форми на сероводород, съхранявани в клетките на бозайници. Те могат да отделят сероводород съответно при киселинни и при редуциращи условия (Shen, Peter, Bir, Wang и Kevil, 2012). Примери за свързана сулфанова сяра включват тиосулфат, персулфид, тиосулфонат, полисулфиди, политионати и елементарна сяра. Като цяло тези различни биохимични форми са важни за регулиране на количеството бионаличен сероводород (Ishigami et al., 2009; Wintner et al., 2010).
Нервна система и поведенческа токсикология
13.15.5.4 Водороден сулфид
Водородният сулфид е често срещан и мощен токсичен агент, който е основният химически риск при производството на кисел газ (т.е. съдържащ сяра). Токсичността на водороден сулфид също се среща в съоръжения за задържане на свине и промишленост, занимаващи се с обработка на оборски тор и отпадъчни води. Повечето хора лесно възприемат този газ, тъй като границата на откриване на обонянието за сероводород е ≥5 ppb (Hoshika et al. 1993). Токсичните ефекти на сероводорода са характерно свързани с дозата и най-вече включват нервната, сърдечно-съдовата и дихателната системи. Хората, остро изложени на to100 ppm сероводород, често изпитват лакримация, фотофобия, непрозрачност на роговицата, тахипнея, диспнея, трахеобронхит, гадене, повръщане, диария и сърдечни аритмии. Тези промени обикновено се разрешават при евакуация на чист въздух. Въпреки това, хората, възстановяващи се от излагане на сероводород, могат да имат кашлица, хипосмия, дизосмия и фантосмия в продължение на няколко дни до седмици (Glass 1990). При хората вдишването на само 100–250 ppm сероводород само за няколко минути може да доведе до некоординация, памет и двигателна дисфункция и аносмия (така наречената обонятелна парализа) (Glass 1990).
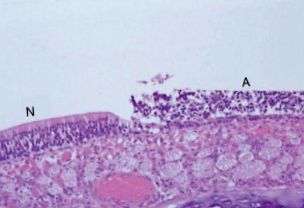
Brenneman et al. (2002) излагат групи от 10-седмични плъхове на Sprague – Dawley на до 400 ppm сероводород в продължение на 3 часа на ден в продължение на 1 или 5 последователни дни. Най-изразената назална лезия е обонятелната некроза на лигавицата ( Фигура 3 ). Тази лезия е възстановена в рамките на около 30 дни след експозицията (Brenneman et al. 2002). Основните разлики, наблюдавани в ефектите между 1- и 5-дневната експозиция, са, че честотата на лезиите е 100% при трите най-високи нива на дозата, а носните лезии са по-регионално обширни в носната кухина. Мултифокална, двустранно симетрична обонятелна невронална загуба и базално-клетъчна хиперплазия, ограничени до обонятелната лигавица, са наблюдавани при плъхове, изложени на хронично 30 или 80 ppm сероводород. Наблюдават се лезии в дорзалния медиален медус и гръбната и медиалната зона на етмоидната вдлъбнатина. Не се забелязват ефекти, свързани с лечението при 10 ppm, което е нивото на неблагоприятно въздействие (NOAEL) за лезии в обонятелната лигавица (Brenneman et al. 2000a).
Фигура 3. Обонятелна некроза на лигавицата с базалноклетъчна хипертрофия по дорзалната преграда на носа на плъх след излагане на 200 ppm сероводород в продължение на 3 h (N). Засегнатият епител одорант (A) е в съседство с по-нормално изглеждащия епител, показващ специфичен за мястото характер на тази лезия при гризачи.
Намалена активност на цитохром оксидазата се наблюдава в обонятелния епител на плъхове след еднократна 3-часова експозиция на ≥30 ppm сероводород (Dorman et al. 2002). Назалната екстракция на сероводород е измерена в изолираните горни дихателни пътища на мъжки плъхове Sprague – Dawley и варира от 32% за експозиция 10 ppm при 75 ml min -1 до 7% за експозиция 200 ppm при 300 ml min -1 (Schroeter et al. 2006). Прогнозираният регионален поток на сероводород корелира с разпределението на носните обонятелни лезии при плъхове (Schroeter et al. 2006).
Остри отговори на токсични експозиции
Водороден сулфид
Водородният сулфид е често срещан страничен продукт от добива и рафинирането на петрол, както и потенциална опасност от разграждането на органични материали (следователно, неговото общо наименование, „канализационен газ“); прекомерното излагане може да бъде резултат от работа в затворени пространства, потапяне в оборските ями, 306 или близост до геотермални и вулканични източници. 307 Водородният сулфид е дразнител на дихателните пътища, но е още по-мощен цитотоксичен задушник, нарушаващ цитохром оксидазата и клетъчното дишане. Следователно, в случаи на тежка експозиция на сероводород, бързият сърдечно-съдов колапс и смърт често засенчват всякакви ефекти върху белодробните органи, въпреки че остър модел на нараняване на белите дробове може да присъства при оцелелите достатъчно дълго, за да получат интензивна поддържаща помощ; дразнещите симптоми като преобладаваща характеристика могат да имат по-голямо значение при експозиции с по-нисък интензитет. 306,308-311
Професионална неврология
Имоти
Водороден сулфид (H 2S, молекулно тегло 34,08) е запалим, безцветен газ, който е обидно миризлив (мирис на изгнили яйца или зеле), разтворим в липиди и слабо разтворим във вода (налягане на парите във вода 18,75 10 2 kPa) и по-тежък от въздуха (плътност 1,19). Във водна среда той лесно се дисоциира до хидросулфид, но не и до сулфид, както следва. Недисоциираният сероводород и хидросулфидният йон са преобладаващи при съотношение 1: 2 при pH 7,4 (Reiffenstein et al., 1992; Агенция за регистрите на токсичните вещества и заболявания, 2006):
Биологичните източници на сероводород са склонни да отделят периодични пикове или импулси на газа, обикновено заедно с метан (който за всички практически цели е нетоксичен). Веднъж освободен, плътният газ може да продължи, докато бъде изместен от вятър или вентилация в ниско разположена земя, вдлъбнатини като окопи или ями или в затворени пространства. Сероводородът във водата, например в канализацията, блатата и дълбокия океан, има тенденция да се натрупва до насищане и след това се отделя спонтанно или с смущения, като отопление или физически смущения. Това води до „оригване“ на газа и болусен ефект, който след това може да бъде уловен в затворени пространства или ями (Nogue et al., 2011).
Продължителното освобождаване е по-често от геоложки източници, както в „петрола“. Дори там вулканичната активност, изсмуканите джобове на газ и капризите на добива на нефт и газ могат да доведат до променлив профил на експозиция за кратки периоди.
- Течен парафин - общ преглед на ScienceDirect теми
- Повишен апетит - общ преглед на ScienceDirect теми
- Тегло на калта - общ преглед на ScienceDirect теми
- Липидна диета - общ преглед на ScienceDirect теми
- Водороден сулфид - Токсикология - Ветеринарно ръководство на Merck