Софи М.Т. Уеренс
1 Факултет по здравеопазване и медицински науки, Университет в Съри, кампус Stag Hill, Guildford, Surrey GU2 7XH, Великобритания
Skevoulla Christou
1 Факултет по здравеопазване и медицински науки, Университет в Съри, кампус Stag Hill, Guildford, Surrey GU2 7XH, Великобритания
Черил Ишърууд
1 Факултет по здравни и медицински науки, Университет в Съри, Stag Hill Campus, Guildford, Surrey GU2 7XH, Великобритания
Бенита Мидълтън
1 Факултет по здравеопазване и медицински науки, Университет в Съри, кампус Stag Hill, Guildford, Surrey GU2 7XH, Великобритания
Мишел А. Гибс
1 Факултет по здравеопазване и медицински науки, Университет в Съри, кампус Stag Hill, Guildford, Surrey GU2 7XH, Великобритания
Саймън Н. Арчър
1 Факултет по здравеопазване и медицински науки, Университет в Съри, кампус Stag Hill, Guildford, Surrey GU2 7XH, Великобритания
Дебра Дж. Скене
1 Факултет по здравеопазване и медицински науки, Университет в Съри, кампус Stag Hill, Guildford, Surrey GU2 7XH, Великобритания
Джонатан Д. Джонстън
1 Факултет по здравеопазване и медицински науки, Университет в Съри, кампус Stag Hill, Guildford, Surrey GU2 7XH, Великобритания
Свързани данни
Обобщение
Резултати
Няма промяна в ритмите на SCN хормони, управлявани от часовник, маркери на съня или субективен апетит
Циркадните ритми на бозайниците се задвижват от главен часовник в рамките на супрахиазматичните ядра (SCN) на хипоталамуса и периферните часовници, разположени в цялото тяло [3]. За да функционира оптимално циркадната система, отделните часовници трябва да бъдат правилно синхронизирани един с друг и с външната среда. Ненормалните циркадни ритми или дефекти в синхронизационните пътища могат да доведат до циркадно несъответствие или десинхронност, които са свързани с лошо здраве и метаболитни нарушения [4, 5]. При повечето индивиди SCN часовникът се настройва на слънчево време чрез входни фотични пътища, произхождащи от ретината [6]; SCN след това синхронизира периферните часовници чрез невронални пътища, хормонални ритми, основна телесна температура и поведение като цикъла на хранене и гладуване [3]. Фотичните сигнали са от първостепенно значение за нулиране на човешките ритми [7]. Редовните нефотични сигнали обаче могат да регулират ритмите при нечовешки видове; например, временното ограничаване на наличността на храна нулира фазата на периферните часовници на гризачи [8, 9], с по-фини ефекти върху SCN на гризачите [10]. Проучванията при хора разкриват, че постпрандиалните реакции зависят от времето на хранене [11, 12, 13, 14], но малко се знае за способността на храненията сами по себе си да променят времето на човешките циркадни ритми.
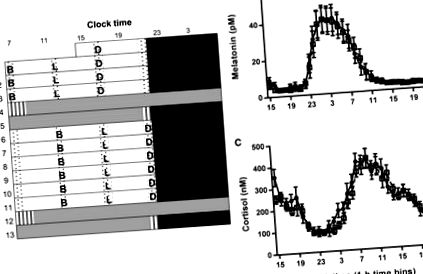
Изследвахме 5-часово закъснение в три изокалорични дневни хранения (закуска, обяд и вечеря) с идентично съдържание на макроелементи в циркадните ритми, използвайки 13-дневен лабораторен протокол (Фигура 1 А). Всеобхватната хипотеза беше, че забавянето на времето за хранене забавя периферните ритми, но не и маркерите на SCN часовника. Фазовите промени бяха индиректно оценени чрез хранене × взаимодействия по време на деня в ANOVA анализ на групирани данни и директно оценени чрез косинорен анализ на данни за отделни участници (вж. STAR Методи).
Протокол за проучване и фаза на SCN-управлявани хормонални ритми
Тъй като е известно, че нарушаването на съня модулира метаболитната физиология [15], ние оценихме субективната сънливост през всяка постоянна рутина, използвайки скалата на Каролинска сънливост (KSS). Наблюдаваха се очакваните временни вариации, но нямаше значителен ефект от времето на хранене (Фигура S1). Освен това не успяхме да открием никакви ефекти от времето на хранене върху обективните маркери на съня, оценени чрез актиграфия (Фигура S1). Оценихме влиянието на времето на хранене върху субективния апетит, използвайки визуална аналогова скала (VAS), но отново не открихме значим ефект (Фигура S2).
Плазмената глюкоза, но не инсулинът или триглицеридите, ритмите се влияят от времето на хранене
Концентрацията на глюкоза в плазмата показва значителни ефекти от времето на деня, храненията и храненето × взаимодействие по време на деня (Фигура 2 А). За да се определи количествено ефектът от времето на хранене върху фазата на глюкозния ритъм, ние използвахме косинорен анализ. Глюкозната акрофаза настъпи 1,31 ± 0,82 часа преди DLMO след ранни хранения, но 4,38 ± 0,83 часа след DLMO след късни хранения. 5-часовата промяна във времето на хранене забавя относителната фаза на глюкозните ритми с 5,69 ± 1,29 часа (Фигура 2 D).
5-часово закъснение по време на хранене забавя циркадния ритъм на плазмената глюкоза
(A – C) Концентрация на глюкоза (A), инсулин (B) и триглицерид (C) в двучасови плазмени проби, събрани при постоянни рутинни условия. Данните са нанесени като средно ± SEM. Черните кръгове с плътни линии представляват данни след ранното хранене (0,5, 5,5 и 10,5 часа след събуждане). Белите квадратчета с пунктирани линии представляват данни след 5-часово закъснение във всяко хранене.
(A) Имаше значителни ефекти от времето (F (14,126) = 3,71, p Фигура 2 B). Анализът на Cosinor оценява инсулинова акрофаза на 7,99 ± 1,99 часа след DLMO след ранно хранене и 11,36 ± 0,89 часа след DLMO след късно хранене (Фигура 2 Д).
Налице е значителен ефект от времето на деня, но няма съществен ефект от хранене или хранене × време-дневно взаимодействие върху плазмената концентрация на триглицериди (Фигура 2 С). Анализът на Cosinor изчислява, че триглицеридната акрофаза е 6,59 ± 0,62 часа след DLMO след ранно хранене и 7,38 ± 0,30 часа след DLMO след късно хранене (Фигура 2 F).
Диференциална реакция на часовниковите генни ритми в бяла мастна тъкан и кръв
За да проверим хипотезата, че забавеното хранене забавя молекулярните циркадни ритми в периферните тъкани, ние измерихме часовникови транскрипти в серийни биопсии на бяла мастна тъкан (WAT), използвайки усъвършенстване на нашия публикуван по-рано протокол [16, 17]. Генната експресия беше измерена при седемте участници, от които успяхме да получим пет биопсии, по една на всеки 6 часа, и в двете постоянни процедури. Данните бяха получени чрез RT-PCR за три гена на каноничен часовник и Z бе отбелязан преди анализ (Фигури 3 A-3C). Налице е значителен ефект от времето на деня, но няма общ ефект от храненето и върху трите гена. Имаше значително взаимодействие между хранене × време на ден за PER2, но не и за PER3 или BMAL1. Анализът на Cosinor също разкрива значителен ефект от времето на хранене върху фазата PER2, но не и върху фазата на PER3 или BMAL1 (Фигури 3 D – 3F).
5-часово закъснение по време на хранене забавя часовите генни ритми в бялата мастна тъкан
(A – C) Профили на временна експресия на PER2 (A), PER3 (B) и BMAL1 (C) в 6-часови биопсии на бяла мастна тъкан, събрани в постоянни рутинни условия. Данните са нанесени като средно ± SEM. Черните кръгове с плътни линии представляват данни след ранното хранене (0,5, 5,5 и 10,5 часа след събуждане). Белите квадратчета с пунктирани линии представляват данни след 5-часово закъснение във всяко хранене. Двупосочните повторни измервания ANOVA разкриха значителен ефект от времето за PER2 (F (4,24) = 56,81, p Фигура 2 А). За да изследваме това по-подробно, сравнихме средната концентрация на глюкоза на всеки участник в двете постоянни процедури. Наблюдава се значително намаляване на средната концентрация на глюкоза след късно хранене (Фигура 4 А), като всички десет от участниците проявяват по-ниска плазмена глюкоза след късно хранене. Няма обаче значително намаление на средната концентрация на плазмен инсулин (Фигура 4 В) или триглицерид (Фигура 4 С) след късно хранене. След това сравнихме пиковите и най-ниските стойности за всеки участник във всяка постоянна рутина, за да определим дали по-ниската концентрация на глюкоза се дължи на намален пик, най-ниска стойност или и двете (Фигура 4 D). Налице е общ ефект от храненията и значителна разлика между пиковите и най-ниските стойности. Нямаше съществено взаимодействие между двата фактора, което обаче показва подобно понижаване на пиковата и най-ниската плазмена глюкоза след късните хранения.
Средната концентрация на глюкоза в плазмата при постоянни рутинни условия се намалява след 5-часово закъснение по време на хранене
Контакт за споделяне на реагенти и ресурси
Допълнителна информация и искания за ресурси и реактиви трябва да бъдат насочени към и ще бъдат изпълнени от водещия контакт Джонатан Д. Джонстън ([email protected]).
Подробности за експерименталния модел и предмет
- Времето за хранене може да направи или счупи клетките ви; Circadian Rhythm Technology Networks
- Колко важно е времето за хранене Nutrition Action
- Храносмилателна система на човека - Калций Британика
- Чернодробна енцефалопатия при дребни животни - Храносмилателна система - Ветеринарен наръчник на Merck
- Козето месо може да спаси нашата хранителна система, но ние се страхуваме твърде много, за да го изядем HuffPost Life