1 Катедра по акушерство и гинекология, Институт за изследване на здравето на децата и Институт за изследване на Лоусън, Университет на Западен Онтарио, 1151 Ричмънд Стрийт, Лондон, Онтарио
2 Dental Science Building, стая 2027, Университет на Западен Онтарио, 1151 Ричмънд Стрийт, Лондон, Онтарио, Канада
Резюме
1. Въведение
Затлъстяването се отнася до прекомерно натрупване на мастна тъкан и се определя от Световната здравна организация (СЗО) като индекс на телесна маса (ИТМ: тегло (kg)/дължина (m 2)) по-голям или равен на 30 [1]. Затлъстяването е обявено за основен здравословен проблем и честотата му се е увеличила повече от два пъти в световен мащаб от 1980 г. насам, като над 200 милиона мъже и близо 300 милиона жени са класифицирани като затлъстели през 2008 г. според СЗО. Затлъстяването е свързано с множество неблагоприятни последици за здравето, включително диабет тип 2, инсулинова резистентност, хипертония, сърдечно-съдови заболявания и някои видове рак [2, 3]. Изчислено е, че преките разходи, свързани със затлъстяването, представляват между 0,7% и 2,8% от общите разходи за здравеопазване в страната, като медицинските разходи на затлъстелите лица са приблизително 30% по-големи от техните връстници с нормално тегло [4]. По този начин социалните и икономически разходи, свързани със затлъстяването в развитите страни, вече са добре признати.
Съобщава се, че настоящите стратегии за интервенция за предотвратяване и управление на затлъстяването и свързаните с него заболявания са ограничени до постнаталния живот с фокус върху упражненията, приема на сол, диетичните интервенции и отказването от тютюнопушенето [5]. Тези интервенции имат ограничен успех и не е изненадващо, че битката срещу затлъстяването и свързаните с него заболявания, особено в богатите индустриализирани страни, в момента се губи. Gluckman и Hanson [5] предполагат, че е важно да се съсредоточи вниманието върху въпросите за майчиното здраве и хранене по време на бременност, които сега се считат за играещи основна роля в началото на затлъстяването.
В този преглед обобщаваме епидемиологични и проучвания върху животни, свързващи неблагоприятни вътреутробно среда, особено IUGR, за натрупване на постнатална мастна тъкан. Ние също така подчертаваме потенциалните механизми, лежащи в основата на връзките между IUGR и дългосрочното разширяване на мастната тъкан, и подчертаваме някои идеи за по-нататъшни изследвания в IUGR модели.
2. Концепцията за програмиране на плода
3. Мастна тъкан
3.1. Различните видове мастна тъкан
Два вида мастна тъкан, бяла мастна тъкан (WAT) и кафява мастна тъкан (BAT), съжителстват в повечето видове бозайници. WAT има съществена роля в съхранението на енергия, като осигурява дългосрочен резерв на гориво под формата на триацилглицероли, които могат да бъдат мобилизирани по време на лишаване от храна с освобождаването на мастни киселини за окисляване в други органи [18]. От друга страна, НДНТ е специализирана в разсейването на енергия чрез производството на топлина [19].
При бозайниците WAT се разпределя неравномерно през тялото и е представен от две основни мастни депа, които се определят от местоположението им: подкожно и висцерално [30]. При хората подкожните депа се състоят от мастна тъкан под кожата предимно в седалището, бедрата и корема. Депото на висцералната мастна тъкан включва запасите от мезентериална, оментална, периренална, ретроперитонеална и перикардна мазнина [31]. При овцете, голям животински модел на затлъстяване при възрастни, WAT присъства в областта на маточната, подкожната и задната част на краката [32–34]. WAT депа при гризачи (плъхове и мишки) съществуват в две основни депа за подкожна мастна тъкан, едно предно и задно, разположени в отделни анатомични места [35]. Предното депо е сложно, заема гръбната област на тялото между и под лопатките, аксиларната и проксималната области на предните крайници и цервикалната област. Задното депо е разположено в основата на задните крака и в дорсолумбалната, ингвиналната и седалищната област. Висцералните мастни депа, подобно на хората, са разположени в гръдната и коремната кухини: медиастинични, мезентериални, ретроперитонеални, периренални и перигонадни депа.
Вторият тип мастна тъкан, НДНТ, е специализиран в разсейването на енергия чрез производството на топлина [19]. Характеризира се с това, че има тъмен цвят в сравнение с WAT, който възниква от неговата васкуларизация и многобройни митохондрии [36, 37] и изглежда има по-плътно снабдяване на нервите от WAT [38]. При НДНТ многолокуларните мастни клетки обикновено съдържат много малки вакуоли от липиди и големи митохондрии с плътно опаковани успоредни кристи [39, 40], където разединяващият протеин 1 (UCP1) е силно експресиран и се разглежда като специфичен за НДНТ маркер [41] . Във връзка с UCP1, редица други гени, включително йодтиронин дейодиназа от тип 2, трансмембранният гликопротеин Elovl3, активираният от мастните киселини транскрипционен фактор, активиран от пероксизомен пролифератор рецептор-α (PPARα), активираният ядрен коактиватор пероксизомен пролифератор рецептор-γ коактиватор 1α (PGC-1α), а гените на хомеобокс в развитието HoxA1 и HoxC4 са преференциално изразени в НДНТ [37, 42]. За сравнение, експресията на лептин, ядрения корепресор RIP140, матричния протеин фибрилин-1 и човешките гени HoxA4 и HoxC8 в развитието в НДНТ са ниски в сравнение с тяхната по-голяма експресия, наблюдавана в WAT [37, 42].
Отдавна се предполага, че белите и кафявите адипоцити имат общ произход и също се подлагат на много подобна програма за морфологична диференциация, контролирана от PPARγ и членове на семейството на транскрипционните фактори C/EBP [43]. Неотдавнашни проучвания обаче показват, че кафявите адипоцити възникват от трипотентни експресиращи 1-експресиращи клетки в централния дермомиотом чрез динамично участие на PRD1-BF-1-RIZ1 хомоложен домен-съдържащ протеин-16 (PRDM16) [43, 44]. В допълнение, PRDM16 коактивира транскрипционната активност на PGC-1α, PGC-1β, PPARα, и PPARγ чрез директно взаимодействие и по този начин стимулира развитието на преадипоцитите в кафяви адипоцити [43]. Този диференциален произход вероятно е определящ за еволюционната роля на BAT и WAT при бозайниците.
В човешкия плод и новороденото НДНТ се намира главно в цервикалния, аксиларния, периненалния и периадреналния депа [45, 46] и играе важна роля в неотделянето на производството на топлина през неонаталния живот и по този начин осигурява защита срещу летално излагане на студ (хипотермия) . При възрастни депата на НДНТ се намират в регион, простиращ се от шията до гръдния кош, особено в междускапуларните, надключичните, цервикалните, аксиларните и паравертебралните региони [47, 48] и сега се счита, че тези депа са свързани с телесното тегло регламент [49]. За сравнение, НДНТ при гризачи се намира главно в горната част на гърба (интерскапуларна НДНТ) [50] и се появява за първи път през последните дни на бременността, узрява през неонаталния период и остава на относително стабилно ниво за продължителността на живота на животните [51]. НДНТ се вижда и в подкожното предно депо и медиастиничните и периреналните места при възрастни гризачи, поддържани в нормални условия [35]. При други видове ситуацията е съвсем различна. Например, агнетата се раждат с почти 100% НДНТ [52, 53], като по-голямата част от тази мастна тъкан е разположена около бъбреците [33, 34]. Постнатално в младия живот, локализацията на НДНТ се превръща в стернални, ключични, перикардни и епикардни депа в допълнение към периненалното депо [34].
3.2. Онтогения на мастните тъкани
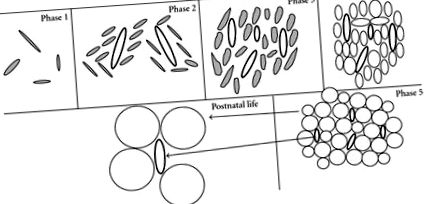
За сравнение, три отделни етапа на пренатална диференциация на WAT се предполагат при плъхове [56]. В етап 1 се развива рядка мрежа от големи капиляри. На етап 2 повечето от клетките са с форма на вретено и околната съединителна тъкан съдържа много малко кръвоносни съдове, последвани от образуване на капилярно легло. Етап 3 се характеризира със зряло капилярно легло и заоблени адипоцити. Най-ранните ембрионални подкожни мастни клетки се откриват на 15-16 ден от бременността (продължителност на бременността)
21–23 дни) [57]. Периреналната мастна тъкан при плъхове се появява главно около раждането, т.е. 12 часа преди и след раждането [58]. Само два до пет дни разделят образуването на първите периренални мастни клетки и появата на мезентериални мастни клетки, които развиват последните. В резултат на това минимални количества мастна тъкан (1%) се отлагат преди раждането и узряването на тази тъкан настъпва предимно след раждането [59].
При плъховете кафявите адипоцитни предшественици са паренхимни вретенови клетки, тясно свързани с мрежа от капиляри [60]. Тъй като клетките и съдовете се размножават, те се организират в лобули от съединителнотъканни прегради. Когато клетките започнат да натрупват липиди, те първоначално са еднолокулярни, но с по-нататъшно натрупване на липиди се появяват множество цитоплазмени липидни вакуоли. Образуването на НДНТ се извършва в лопатката на плъхове между 15 и 17 ден от бременността [60, 61] и е налице през целия живот [50]. Изследванията при хора не са толкова специфични, колкото при плъхове; проучванията обаче показват, че фетална НДНТ се наблюдава в шийните, гръдните и коремните вътрешности и в раменния пояс и шията приблизително на 23 седмици от бременността [62].
В постнаталната среда разширяването на мастната тъкан се случва главно след раждането чрез увеличаване на размера на адипоцитите и уголемяване на мастните капиляри (Фигура 1) под действието на ензими като липопротеинова липаза, регулатор на адипоцитния липиден пълнеж [63, 64]. Адипоцитната хиперплазия след раждането изглежда ограничена; въпреки това проучванията съобщават за неговото активиране за обновяване на адипоцитите [65], което предполага, че WAT и BAT при хората, както и при гризачите, все още съдържат клетки-предшественици, способни да се диференцират в адипоцити в зряла възраст [66–68].
4. Дългосрочни последици от IUGR върху развитието на мастните тъкани
IUGR или ограничение на растежа на плода (FGR), което се отнася до плод, който не отговаря на своя генетичен потенциал за растеж, се характеризира с тегло на или под 10-ия процентил за гестационна възраст и засяга приблизително 7–15% от бременностите в целия свят [69]. Връзката между IUGR и постнаталното развитие на затлъстяването е докладвана при епидемиологични проучвания при хора и при животински модели [70, 71] и се предполага, че тяхното взаимодействие е основен фактор за настоящата глобална епидемия от затлъстяване [5, 70].
4.1. Ефекти от IUGR и ниското тегло при раждане върху дългосрочното разширяване на мастната тъкан в животински модели
4.2. Човешко ниско тегло при раждане и по-късно натрупване на мастна тъкан
Първите проучвания, насочени към ниското тегло при раждане в резултат на ограничаване на растежа на плода, водещо до последващо разширяване на мастната тъкан при възрастни, използват данни, получени от проучванията на потомството, родено след холандския глад от 1944-1945 г. [87]. Излагането на глад през първата половина на бременността е довело до ниско тегло при раждане и това е свързано значително с по-високи нива на затлъстяване и по-голямо разпределение на мастната тъкан и корема при мъжете на 19-годишна възраст. Последващо проучване на тази кохорта отчита по-висок ИТМ и обиколка на талията при 50-годишни жени, изложени на глад в началото на бременността (първи триместър) в сравнение с неекспонираните жени [12]. Връзката между ниското тегло при раждане и по-късното затлъстяване се подчертава и от проучвания върху биетническа популация (мексиканско-американска и неиспанска бяла) в САЩ. В тези проучвания нормотензивните и недиабетните възрастни индивиди, чието тегло при раждане е било в най-ниския тертил, имат значително по-голям модел на отлагане на мастна тъкан (+ 14%, измерено чрез съотношението на субкапсуларната и трицепсната кожна гънка) от индивидите, чието тегло при раждане е било най-високо третичен, независимо от пола, етническата принадлежност и настоящия социално-икономически статус [88].
5. Вътрематочни механизми отзад В матката Програмиране на по-късно затлъстяване
Изследванията върху животни и хора са фокусирани върху няколко вътрематочни механизма, които могат да програмират мастната тъкан на плода за по-късно затлъстяване. По-конкретно, промените в морфологията и метаболизма на мастната тъкан на плода, променените пътища, регулиращи апетита, и модифицирането на нивата на хормоните и епигенома в плода са подчертани като критични регулатори в развитието на затлъстяването след IUGR (Фигура 2).
5.1. Ролята на развитието на феталната мастна тъкан в по-късното разширяване на мастната тъкан
5.2. Лептин, IUGR и по-късно развитие на мастните тъкани
5.3. В матката Излагане на глюкокортикоиди и постнатална мастна тъкан
Оста на хипоталамо-хипофизарно-надбъбречната жлеза (HPA) е предложено да участва в патофизиологията на по-късното затлъстяване след раждането IUGR [109]. Механизмите са лошо дефинирани, но данните от проучвания върху животни сочат, че нежеланите събития в ранния живот могат да повлияят на невроендокринното развитие на плода, което води до дългосрочни промени в зададените стойности на няколко основни хормонални оси, включително увеличаване на надбъбречната секреция на глюкокортикоиди. В действителност, мастната тъкан от ранните ограничени от хранителни вещества овчи фетуси показва промени в глюкокортикоидната сигнализация (повишен глюкортикоиден рецептор и 11-
-хидроксистероидна дехидрогеназа 1 (11β-HSD1) израз, но намаля 11β-Изобилие от HSD2) на 140-ия ден от бременността и на 6-ия месец след раждането [110]. Както 11β-HSD2 превръща кортизола в неговия неактивен метаболит кортизон [111] и се смята, че предпазва определени тъкани от излишък на експозиция на кортизол [112], тези резултати предполагат, че глюкокортикоидното действие може да се засили при потомството, изложено на ограничаване на хранителните вещества вътреутробно, като по този начин се увеличава тяхната податливост към по-късно затлъстяване. Поради това се предполага, че това вътреутробно повишена чувствителност към мастна глюкокортикоиди, наблюдавана в близко време при майчините плодове на овце, ограничени с хранителни вещества, може впоследствие да доведе до патофизиологично развитие на висцерално затлъстяване в по-късен живот, като задейства придобиването на характеристики на бялата мастна тъкан след раждането [110].
5.4. Фетален епигеном и постнатално развитие на мастната тъкан
6. Заключение и перспективи
Тази статия предоставя рамкова работа за това как процесите на адипогенеза и липогенеза могат да бъдат променени при IUGR и ниско тегло при раждане, като поставят началото на затлъстяването по-късно в живота. Той представя доказателства както от проучвания върху животни, така и при хора, които показват, че повишената липогенна и адипогенна способност на адипоцитите, хиполептинемията, променената глюкокортикоидна сигнализация и епигенетичните модификации по време на живота на плода вероятно играят основна роля в вътреутробно произход от затлъстяването по-късно Като се има предвид, че дискретни молекулярни промени в мастната тъкан на плода са показали, че влияят неблагоприятно върху развитието на мастната тъкан на индивиди с IUGR по-късно в живота, съществува реална необходимост да се предприемат надлъжни проучвания (преди раждането, по време на ранния постнатален живот и зряла възраст) върху развитието на мастната тъкан и установяват окончателно кои гени и пътища в тази тъкан имат причинно-следствена роля в вътреутробно произход на затлъстяването.
Препратки
- Определя ли се продължителността на живота in utero ADC Fetal; Неонатално издание
- Вътрематочно ограничаване на растежа и наднормено тегло, затлъстяване и спиране на растежа при юноши от местното население
- Индуцирано от хипоксия вътрематочно ограничаване на растежа увеличава чувствителността на плъховете към високо съдържание на мазнини
- Високите нива на глюкоза в кръвта на майката в ранна бременност са свързани с променен растеж на плода и
- Влияние на повишеното висцерално затлъстяване с нормално тегло върху прогресията на артериалната скованост