Тошио Маеда
1 Катедра по клинична фармацевтика и фармацевтична практика, Висше училище по фармацевтични науки, Университет в Шизуока, Шизуока 422-8526, Япония
Сатоми Мики
2 Централен изследователски институт, Wakunaga Pharmaceutical Co., Ltd., Акитаката, Хирошима 739-1195, Япония
Наоаки Морихара
2 Централен изследователски институт, Wakunaga Pharmaceutical Co., Ltd., Акитаката, Хирошима 739-1195, Япония
Йошиюки Кагава
1 Катедра по клинична фармацевтика и фармацевтична практика, Висше училище по фармацевтични науки, Университет в Шизуока, Шизуока 422-8526, Япония
Свързани данни
Всички данни, генерирани или анализирани по време на това проучване, са включени в тази публикувана статия.
Резюме
Въведение
Безалкохолната мастна чернодробна болест (NAFLD) е едно от най-разпространените чернодробни заболявания в световен мащаб. NAFLD включва анормално натрупване на триглицериди (TG) в хепатоцитите (1). NAFLD прогресира чрез неалкохолен стеатохепатит (NASH) до цироза и хепатоцелуларен карцином. NAFLD се счита за чернодробна проява на метаболитен синдром (2–4) и е тясно свързана с чернодробната инсулинова резистентност и абнормен метаболизъм на глюкозата (5,6). Епидемиологичните проучвания показват, че NAFLD е свързана с развитието на диабет тип II (T2D) и че подобряването на NAFLD ще доведе до намален риск от развитие на T2D (7). Следователно NAFLD и T2D изглежда са тясно свързани. Неотдавнашно проучване показа, че активирането на транскрипционен фактор 3 е ключова молекула, свързваща NAFLD с нарушена глюкозна хомеостаза при диабетни мастни плъхове на Zucker и при пациенти с NAFLD (8).
През последните години редица проучвания разкриха, че чревната микробиота може да допринесе за риска от затлъстяване (9), диабет (10), дислипидемия (11) и NAFLD (12,13) при хора и животински модели. Нарушаването на чревния микробиотен състав е наблюдавано при пациенти, страдащи от NAFLD (14). Количествата на чревната микробиота се различават значително при пациенти с T2D и здрави индивиди (15). Доказано е, че диетата с високо съдържание на мазнини, която предизвиква NAFLD и инсулинова резистентност, може да причини дисбаланс в състава на чревната микробиота на мишки и че животните без микроби са защитени от вредния ефект на диетата с високо съдържание на мазнини (16,17 ). При плъхове, хранени с диета с високо съдържание на мазнини, е установено, че дисбалансът на чревната микробиота е значително свързан с прогресията на NAFLD (18). Доказано е, че пробиотиците (Lactobacillus rhamnosus, Lactobacillus acidophilus и Bifidobacterium bifidum) модулират чревната микробиота и подобряват чувствителността към инсулин при мишки, хранени с диета с високо съдържание на мазнини (16). Следователно манипулирането на чревния микробиом чрез пробиотици или пребиотици е важно средство за предотвратяване и лечение на NAFLD и инсулинова резистентност при пациенти, както и при модели на гризачи (14,16,19).
Ефектите на AGE върху ненормалния метаболизъм на мастните киселини и инсулиновата резистентност, свързани с чревната микробиота в животински генетичен модел с NAFLD, все още не са проучени, поне доколкото ни е известно. По този начин, в настоящото проучване, ефектите на AGE върху мастния черен дроб, инсулиновата резистентност и чревната микробиота и тяхната възможна връзка са изследвани чрез хранене с добавена от AGE диета на мишки ddY-H, животински модел с NAFLD и инсулинова резистентност.
Материали и методи
Диета, допълнена с AGE
Стандартни пелети от чау (CLEA Diet Diet CE-2, CLEA Japan, Inc.), допълнени с или без 4% (тегл.) ВЪЗРАСТ, са предоставени от Wakunaga Pharmaceutical Co., Ltd.
Експериментален дизайн
Използвани са общо 16 мъжки мишки ddY-H и 16 мъжки мишки ddY-L (и двете на възраст 6 седмици), получени от нашата собствена колония. Мишките бяха разделени на 2 групи, а именно групата AGE и контролната група, с по 8 мишки във всяка група. Телесното тегло на мишките ddY-H и ddY-L е 39,78 ± 1,82 и 31,40 ± 2,61, съответно. Те бяха настанени при 22 ° C до 24 ° C с 50 до 60% влажност при условия на изкуствено осветление с 12-часов цикъл светлина/тъмнина и се поддържаха със свободен достъп до диетата, допълнена със или без 4% (w/w) ВЪЗРАСТ и вода ad libitum от 6 до 13 седмична възраст. На 13-седмична възраст се извършва събиране на фекални проби за анализ на микробиота и тест за толерантност към глюкоза, измерване на абсорбцията на TG от червата и оценка на различни метаболитни параметри. Грижите за животните и експериментите бяха извършени в съответствие с насоките за грижа и използване на лабораторни животни от Университета в Шизуока, а експериментите с животни бяха прегледани и одобрени от Комитета за преглед на животните и етиката на Университета в Шизуока (№ 136004).
Лечение с антибактериални лекарства
Мишките ddY-H и ddY-L от нашата колония бяха хранени със стандартни пелети от чау (CLEA Rodent Diet CE-2, CLEA Japan, Inc.), както е описано по-горе. Антибактериални лекарства (10 mg/kg ампицилин, 10 mg/kg еритромицин, 5 mg/kg метронидазол и 10 mg/kg неомицин) се прилагат перорално на мишки на възраст от 6 до 13 седмици, както е описано по-рано (41) преди теста за глюкозен толеранс и измерването на нивата на чернодробен TG. Антибактериалните лекарства са закупени от Tokyo Chemical Industry Co., Ltd.
Индекс на телесна маса (ИТМ)
ИТМ се изчислява по следната формула: Телесно тегло (g)/телесна дължина2 (cm2), както е описано по-рано (38).
Събиране на фекални проби и анализ на микробиота
Измерване на нивата на серумна глюкоза и инсулин
Кръв се получава след 12 h-бързо (21: 00-09: 00). Нивата на серумна глюкоза, инсулин и лептин бяха определени с помощта на теста за глюкоза CII Wako (Wako Pure Chemical Industries, Ltd.) и съответно комплекта за миши инсулин ELISA (Morinaga Institute of Biological Sciences, Inc.). Индексът на инсулинова чувствителност и инсулиновата резистентност се оценяват от нивата на глюкозата и инсулина по следния начин: Глюкоза (mg/dl)/инсулин (ng/dl) и глюкоза (mg/dl) × инсулин (ng/ml)/100, съответно (37).
Тест за толерантност към глюкоза
Мишките са гладували в продължение на 4 часа (09: 00-13: 00) и са приемали орално глюкоза (3 g/kg). Общо 20 µl кръв бяха събрани от опашната вена на всяка мишка след 0, 30, 60 и 120 минути. Измерват се нивата на серумна глюкоза и се изчислява AUC на концентрацията на глюкоза във времето (37).
Измерване на съдържанието на TG в серума и черния дроб
Всички мишки бяха умъртвени за получаване на серум и черен дроб в 13:00 след 4-часово гладуване. Нивата на серумен TG бяха измерени с помощта на триглицериден E-тест (Wako Pure Chemical Industries, Ltd.). За определяне на чернодробните нива на TG, TG в 0,2 g черен дроб се екстрахира с 4 ml 2-пропанол и аликвотната част на филтрата се измерва с помощта на триглицериден E-тест (Wako Pure Chemical Industries, Ltd.) (39).
Измерване на абсорбцията на мазнини от червата
За да се оцени абсорбцията на мазнини от червата, на мишките се прилага перорално масло (10 ml/kg телесно тегло). След 1, 2, 4 и 6 часа се събират 20 ul кръв от опашната вена на всяка мишка и се измерват серумни концентрации на TG, както е описано по-горе. Площта на повишена концентрация на TG след натоварване на маслиново масло в серумната крива на концентрация на TG-време беше изчислена за оценка на абсорбцията на TG, както е описано по-рано (39).
Статистически анализ
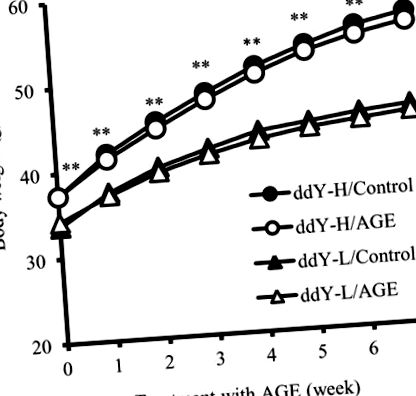
Всички данни са изразени като средните стойности ± SD. Еднопосочен дисперсионен анализ (ANOVA) е използван за сравняване на средните стойности между различните групи, а тестът на Tukey е използван при post hoc множествено сравнение. Стойност на P Таблица I). Телесното тегло на ddY-H мишките е значително по-голямо от това на ddY-L мишките в началния момент (на възраст 6 седмици) и през целия експериментален период. Въпреки това, AGE добавките не оказват влияние върху телесното тегло на нито един от типовете мишки (фиг. 1). На 13-седмична възраст BMI на ddY-H мишките е значително по-голям от този на ddY-L мишките. Добавянето на AGE също не повлиява ИТМ и при двата вида мишки (Таблица I). По този начин, въпреки че затлъстяването се наблюдава при мишките ddY-H, AGE не влияе върху приема на храна, телесното тегло и ИТМ и при двата вида мишки.
Мишките бяха хранени със стандартна диета със и без 4% AGE в продължение на 7 седмици. Измерван е хранителен прием на всяка мишка (g/49 дни) през експерименталния период. ИТМ на всяка мишка след хранене в продължение на 7 седмици се измерва, както е описано в Материали и методи. Всяка стойност представлява средното ± SD на 8 мишки.
Мишките бяха хранени със стандартната диета със и без 4% AGE в продължение на 7 седмици и кръвта беше изтеглена след 12-часово бързо. Всяка стойност представлява средното ± SD на 8 мишки.
Чернодробно съдържание на TG при мишки. Всяка колона представлява чернодробното съдържание на TG в мишки, хранени с диетите в продължение на 7 седмици. Всяка колона представлява средното ± SD за 8 мишки. ** P ## P Фиг. 4А, серумната концентрация на TG в мишките ddY-H и ddY-L достига максималното ниво за 1 h и след това постепенно намалява. Концентрацията на TG в мишките ddY-H е била 1,7 пъти по-висока в сравнение с тази при мишките ddY-L в пиковото време, а AUC през 6-часовия период при мишките ddY-H е била увеличена 2,3 пъти, което предполага по-висока абсорбция на TG от червата при ddY-H мишки. Прилагането на AGE значително намалява чревната абсорбция на мазнини с 33% при ddY-H мишки, но не и при ddY-L мишки (Фиг. 4). Тези резултати предполагат, че AGE потиска натрупването на TG в черния дроб на мишки ddY-H чрез намаляване на чревната абсорбция на мазнини, поне отчасти.
Концентрации на серумен TG при мишки, на които се прилага зехтин. След като се хранят с диетите в продължение на 7 седмици, на мишките се прилага перорално зехтин (10 ml/kg BW) и серумните нива на TG се определят в посочените часови точки. (А) Всеки символ представлява средната стойност на нивото на TG за 8 мишки след приложение на зехтин. (B) AUC в панел А. Всяка колона представлява средното ± SD за 8 мишки. ** P ## P Фиг. 5. Не се наблюдава разлика между съотношението на микробиота при ddY-H мишки и ddY-L мишки на 5-седмична възраст. Въпреки това, при мишки ddY-H на възраст от 9 до 13 седмици, относителното присъствие на Lactobacillales е увеличено, докато това на Bifidobacterium и Prevotella е намалено. Нивото на подкластер Clostridium XIVa и Bacteroides не е променено. От друга страна, незначителната микробиота, клостридий клъстер XVIII и клостридий клъстер XI са намалени на 13 седмици, докато клостридий клъстер IV остава непроменен (Таблица III). Намаляването на броя на Bifidobacterium в изпражненията на мишки ddY-H се потвърждава чрез култивиране на изпражненията върху BS агаризирана среда при анаеробни условия и чрез изследване, използвайки PCR в реално време и метода 2 -ΔΔCq. AGE храненето обърна променения модел на микробиота в изпражненията на мишки ddY-H: Относителното присъствие на Lactobacillales беше намалено, докато това на Bifidobacterium, Clostridium cluster XVIII и Prevotella беше увеличено (Таблица III). При мишки ddY-L обаче не е открит ефект на AGE. Следователно съставът на микробиотата в изпражненията на мишките ddY-H стана подобен на този на мишките ddY-L (Таблица III).
Мишките бяха хранени, както е описано на фиг. 1. Извършва се екстракция на обща ДНК от изпражненията, полимеразна верижна реакция и анализ на T-RFLP за състава на микробиота във фекалиите. Дължината и пиковата площ на T-RF в електроферограмите бяха разделени на 29 OTU. OTUs са количествено определени като процент от индивидуалната OTU площ за обща OTU площ под кривата. Всяка стойност представлява средното ± SD на 6 мишки.
- Битка; мастен черен дроб; затлъстяване на болестта чрез идентифициране и заглушаване на генни мутации Генетична грамотност
- Основан на доказателства преглед на употребата на статини при пациенти с безалкохолна мастна чернодробна болест
- Анализ на експресионните спектри на piRNA в модел на мишка без алкохолна мастна чернодробна болест, индуциран от
- 12 стратегии за отстраняване на мастни чернодробни заболявания - пазари на начин на живот
- Благоприятни ефекти на китайските билки при лечението на мастни чернодробни заболявания - ScienceDirect