Катедри по гастроентерология и хепатология и
Адрес за заявки за препечатване и друга кореспонденция: D. J. Chiang, катедра по гастроентерология и хепатология, LRI-NE40, клиника в Кливланд, 9500 Euclid Ave., Кливланд, OH 44195 (имейл: [имейл защитен]).
Патобиология, клиника в Кливланд, Кливланд, Охайо
Катедри по гастроентерология и хепатология и
Патобиология, клиника в Кливланд, Кливланд, Охайо
Резюме
Затлъстяването е глобална епидемия с повече от 1 милиард възрастни с наднормено тегло и поне 300 милиона пациенти със затлъстяване по целия свят. Диабетът се характеризира с дефект в секрецията на инсулин или намаляване на чувствителността към инсулин, което води до повишена кръвна глюкоза на гладно. Както затлъстяването, така и повишената глюкоза на гладно са рискови фактори за неалкохолна мастна чернодробна болест, болестен спектър, който включва чернодробна стеатоза (неалкохолен мастен черен дроб), неалкохолен стеатохепатит (NASH), фиброза и цироза. Повишеното затлъстяване и инсулиновата резистентност допринасят за прогресирането от NASH до фиброза чрез развитието на профибротично миле в черния дроб, включително повишена хепатоцелуларна смърт, повишено генериране на реактивни кислородни видове и променен баланс на адипокин/цитокин. Този преглед ще обобщи последните постижения в нашето разбиране за патологичните взаимодействия между прекомерното натрупване на мазнини, инсулиновата резистентност и чернодробната фиброгенеза и ще обсъди специфични молекулярни пътища, които могат да представляват интерес за развитието на терапевтични интервенции за предотвратяване и/или обръщане на чернодробната фиброза.
„Наднормено тегло“ и „затлъстяване“ се определят като необичайно или прекомерно натрупване на мазнини, което представлява риск за здравето. Груба популационна мярка за затлъстяване е индексът на телесна маса (ИТМ), с ИТМ 30 или повече, считан за затлъстял, и ИТМ, равен на или повече от 25, считан за наднормено тегло. Затлъстяването се превърна в глобална епидемия с повече от 1 милиард възрастни с наднормено тегло и най-малко 300 милиона пациенти със затлъстяване по целия свят (47а). Диабетът се характеризира с дефект в секрецията на инсулин или намаляване на чувствителността към инсулин, което води до повишена кръвна глюкоза на гладно. Както затлъстяването, така и повишената глюкоза на гладно са рискови фактори за неалкохолна мастна чернодробна болест (NAFLD), болестен спектър, който включва чернодробна стеатоза (безалкохолен мастен черен дроб, NAFL), неалкохолен стеатохепатит (NASH), фиброза и цироза. Проспективните проучвания предполагат връзката между затлъстяването и развитието на диабет тип 2 и чернодробната фиброза (47). Този преглед ще обобщи последните постижения в нашето разбиране за патологичните взаимодействия между прекомерното натрупване на мазнини, инсулиновата резистентност и чернодробната фиброгенеза и ще идентифицира определени молекули или пътища, които могат да бъдат използвани за терапевтични интервенции.
Механизми на взаимодействие
Затлъстяване и NAFL.
Излишният прием на калории над енергийните разходи води до съхранение на енергия под формата на телесни мазнини. Доказано е, че наддаването на тегло от 10% чрез прехранване с бързо хранене и заседнал начин на живот при 18 млади здрави индивида увеличава чернодробните мазнини с 2,5 пъти за 4 седмици (19). Мазнините се съхраняват като триглицериди в черния дроб. Данните от изследвания на стабилни изотопи показват, че серумната свободна мастна киселина от липолиза на висцерална мастна тъкан е основният източник на чернодробни триглицериди при NAFLD. В допълнение, de novo чернодробната липогенеза също се увеличава значително при пациенти с NAFLD (10). Чернодробната генна експресия на протеин 1с, свързващ стерол регулаторен елемент, ключов транскрипционен активатор на липогенни гени, както и на ацетил-CoA карбоксилази и синтаза на мастни киселини се увеличава при пациенти с NAFLD (14).
NAFL и инсулинова резистентност.
Основните механизми, които допринасят за индуцирана от затлъстяване инсулинова резистентност, не са напълно разбрани. Последните проучвания показват, че затлъстяването може да доведе до чернодробна инсулинова резистентност чрез активиране на проинфламаторните M1 макрофаги в мастните тъкани и освобождаването на провоспалителни цитокини като интерлевкин (IL) -6 и фактор на туморна некроза (TNF) -α (40). Провъзпалителните цитокини могат да намалят клетъчния отговор на инсулин и да доведат до инсулинова резистентност. IL-6 блокира инсулиновия сигнален път поне отчасти чрез индуциране на супресор на цитокиновия сигнал-3 (29). В допълнение, възпалителният стрес може да регулира производството на IL-6 в адипоцитите чрез активиране на c-Jun NH2-терминалната киназа (JNK1) (38). Няколко наблюдателни проучвания при хора също показват, че чернодробното натрупване на липиди (стеатоза) участва в патогенезата на инсулиновата резистентност (44).
NAFL и NASH.
NAFL прогресира до NASH при 40% от пациентите с течение на времето (25, 48). Множество, взаимосвързани пътища допринасят за прогресирането от стеатоза до стеатохепатит. Излишното доставяне на нестерифицирани свободни мастни киселини (NEFA) в черния дроб увеличава митохондриалното и пероксизомно β-окисление и насърчава микрозомалната индукция на CYP4A1 и CYP2E1; това води до повишено производство на реактивни кислородни видове (ROS) (22). Тогава повишената ROS повишава токсичността на органела чрез повишено липидно пероксидиране и възпаление. Всъщност, чернодробна митохондриална дисфункция се открива при пациенти със стеатоза (39). Освен това при пациенти с NASH се наблюдават структурни аномалии в митохондриите, включително мегамитохондрии и паракристални тела на включване (39) и значително намаляване на активността на митохондриалните дихателни верижни комплекси (35). В допълнение към тези вредни ефекти върху митохондриите, NEFA също индуцира апоптоза на хепатоцитите чрез повишаване на Fas, активиране на JNK и дестабилизация на лизозомите (23).
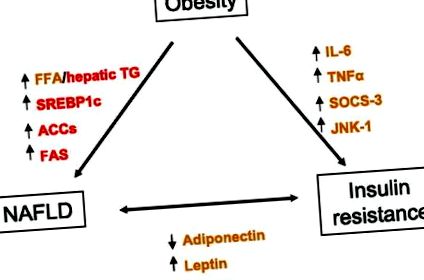
Адипокините и възпалителните цитокини от адипоцитите могат да медиират патологични взаимодействия между мастната тъкан и черния дроб. Тъй като адипокините притежават както про-, така и противовъзпалителни функции, дисбалансът между конкретни адипокини и цитокини може да доведе до увреждане на черния дроб при стеатохепатит. При пациенти с NAFLD плазмените нива на адипонектин, за които се смята, че произлизат от адипоцити, са намалени и обратно свързани с чернодробната инсулинова резистентност и чернодробно възпаление (16). Високите TNF-α и ниските плазмени нива на адипонектин се предлагат като независими предиктори на NASH при пациенти с NAFLD (16). От друга страна, серумният лептин и резистин са в положителна корелация с инсулинова резистентност, чернодробна стеатоза и чернодробно увреждане (7, 32). Тези проучвания предполагат патогенна връзка между индуцирана от затлъстяване инсулинова резистентност и NAFLD (фиг. 1).
Фиг. 1.Предложени механизми на взаимодействие между затлъстяването, инсулиновата резистентност и неалкохолната мастна чернодробна болест (NAFLD). Медиаторите са кодирани с цвят въз основа на източника на произход (червен, черен дроб; кафяв, мастна тъкан). FFA, свободна мастна киселина; TG, триглицерид; SREBP1c, стерол регулаторен елемент, свързващ протеин 1c; ACC, ацетил-КоА карбоксилаза; FAS, синтаза на мастни киселини; IL-6, интерлевкин-6; TNF-α, фактор на туморна некроза-α; SOCS-3, супресор на цитокиновата сигнализация-3; JNK, c-Jun NH2-терминална киназа.
NASH и фиброза.
Чернодробните звездни клетки (HSC) са специфични за черния дроб перицити, локализирани в зона между хепатоцитите и синусоидалния ендотел, наречена пространство на Disse (11). В здрав черен дроб, неподвижните HSC съхраняват 80% от витамин А в организма като ретинилови естери в тяхната цитоплазма (11). В остро наранен черен дроб HSCs губят запасите си от витамин А, трансдиференцират се в контрактилни миофибробласти, ремоделират извънклетъчната матрица (ECM) и допринасят за заздравяването на чернодробна рана. За разлика от това, при хронично наранен черен дроб, HSCs насърчават развитието на фиброза чрез прекомерно производство на ECM и намален метаболизъм на ECM (11).
Въпреки че 30-40% от хората с проста стеатоза напредват към NASH, 74% от пациентите с NASH прогресират до по-тежко чернодробно увреждане, включително фиброза и цироза (25). Повишеното затлъстяване и инсулиновата резистентност при затлъстели лица допринасят за прогресирането на NASH до фиброза. Счита се, че увеличеното присъствие на мъртви и умиращи хепатоцити, повишената ROS и промененото производство на адипокин/цитокини насърчават профибротична среда в черния дроб. Ще опишем накратко всеки от тези допринасящи фактори в следващите раздели на този преглед.
Основна разлика между NAFL и NASH е увеличеният брой апоптотични и/или некротични хепатоцити, открити в черния дроб (17). Тези мъртви и/или умиращи клетки предоставят на HSCs критични сигнали за насърчаване на тяхното активиране; тези сигнали могат да действат както директно, така и/или индиректно върху HSC. Например, клетките на Kupffer, активирани отчасти от клетъчната смърт на хепатоцитите, произвеждат продукти на трансформиращ растежен фактор-β, ROS и липидна пероксидация, всяка от които е мощен стимул за активиране на HSC (17).
Фиг. 2.Потенциални фармацевтични цели, които представляват интерес за прогресирането на неалкохолен стеатохепатит (NASH) до фиброза в условията на затлъстяване и инсулинова резистентност. ROS, реактивни кислородни видове; TGF-β, трансформиращ растежен фактор-β; MCP-1, моноцитен хемоаттрактант протеин-1; CTGF, растежен фактор на съединителната тъкан.
За разлика от увеличеното производство на провоспалителни медиатори, инсулиновата резистентност и затлъстяването често са свързани с намаляване на мощния мастно-възпалителен медиатор, адипонектин. Намаленият адипонектин улеснява или обостря повишеното производство на възпалителни медиатори, както и HSC активиране и фиброза. В действителност, фиброзата е по-тежка при адипонектиновите нокаутиращи мишки, поддържани на диета с високо съдържание на мазнини, в сравнение с контролите от див тип, докато приложението на адипонектин отслабва индуцираната от CCl4 фиброза при мишки (42). In vitro адипонектинът мощно потиска индуцирания от тромбоцитите растежен фактор-BB-индуцирана пролиферация и миграция на HSC (18). И накрая, пациентите с NASH, които са диабетици, резистентни към инсулин и/или затлъстяване, често показват намалени плазмени нива на адипонектин (42). Неотдавнашни проучвания обаче показват, че повишеният адипонектин е свързан с прогресираща фиброза при пациенти с хроничен хепатит В (15). Тези данни предполагат, че регулирането на експресията на адипонектин и неговото въздействие върху черния дроб по време на хронично увреждане и заболяване вероятно ще бъде по-сложно от първоначално предложеното.
Синергия между затлъстяването и инсулиновата резистентност при прогресия на фиброзата.
- Затлъстяването при майки и риск от гестационен диабет Грижа за диабет
- Нови възможности за лечение на затлъстяване и захарен диабет тип 2 (разказ на разказ) -
- Механизъм, свързващ захарен диабет и затлъстяване
- Медикаментозно затлъстяване Индивидуални, икономически и медицински последици Journal of Ethics American
- Безалкохолна мастна чернодробна болест при пациенти със захарен диабет Клиницист ?  ¢ à ? â ? ¬Ã ? â s