Мохамад Овес
1 Катедра по селскостопанска микробиология, Факултет по селскостопански науки, Алигарх Мюсюлмански университет, Алигарх, Индия,
Мохамад Сагир Хан
1 Катедра по селскостопанска микробиология, Факултет по селскостопански науки, Алигарх мюсюлмански университет, Алигарх, Индия,
Алмас Зайди
1 Катедра по селскостопанска микробиология, Факултет по селскостопански науки, Алигарх мюсюлмански университет, Алигарх, Индия,
Архам С. Ахмед
2 Център за върхови постижения в областта на материалознанието (наноматериали), Департамент по приложна физика. Мюсюлмански университет Алигарх, Алигарх, Индия,
Фахим Ахмед
3 Училище за нано и усъвършенствано инженерство на материали, Национален университет Чангвон, Чангвон, Република Корея,
Еяз Ахмад
4 Интердисциплинарен отдел по биотехнологии, Мюсюлмански университет Алигарх, Алигарх, Индия,
Асиф Шервани
4 Интердисциплинарен отдел по биотехнологии, Мюсюлмански университет Алигарх, Алигарх, Индия,
Мохамад Овайс
4 Интердисциплинарно биотехнологично звено, Алигарх мюсюлмански университет, Алигарх, Индия,
Амеер Азам
2 Център за върхови постижения в областта на материалознанието (наноматериали), Департамент по приложна физика. Мюсюлмански университет Алигарх, Алигарх, Индия,
5 Център по нанотехнологии, Университет Крал Абдулазиз, Джеда, Саудитска Арабия,
Замислил и проектирал експериментите: M. Oves MSK. Изпълнява експериментите: M. Oves ASA FA AS. Анализира данните: M. Oves MSK AZ. Реактиви/материали/инструменти за анализ, допринесени: MSK AA EA M. Owais AA. Написа хартията: M. Oves MSK.
Резюме
Въведение
Като се има предвид значението на произведените на биоматериали наноматериали, настоящото проучване е предназначено да открие бактериален щам, произхождащ от замърсените с тежки метали места и да характеризира щама чрез молекулярни и биохимични подходи. Бактериалният щам беше допълнително тестван за неговата способност за намаляване на хром и нитрати. Бактериалният щам също се използва за синтезиране на AgNP при стайна температура в отсъствието на какъвто и да е редуциращ агент. Получените AgNPs впоследствие бяха охарактеризирани с помощта на някои от стандартните аналитични техники като UV-видими, анализатор на размера на наночастиците, SEM, XRD и FTIR спектроскопия. В допълнение към антибактериалната активност както на Грам-положителни, така и на Грам-отрицателни бактерии, цитотоксичността на биофабрикуваните AgNPs е тествана върху чернодробната функция, червените кръвни клетки, спленоцитите и HeLa клетъчните линии.
Материали и методи
Изолиране и характеризиране на бактериите
Почвените проби бяха събрани в стерилни полиетиленови торби (15–12 cm 2) от ризосферата на полетата от сладък грах (Pisum sativum), разположени в покрайнините на Газиабад, Утар Прадеш, Индия. В исторически план агрономическото поле се напоява последователно от промишлени канализационни води на река Хиндон. За да се изолира бактериалният щам, се извършва анализ на серийно разреждане в нормален физиологичен разтвор и 10 uL разредена суспензия се разстила върху средата с хранителен агар (NA). Плаките се инкубират при 28 ± 2 ° С в продължение на три дни. Избрани са и са характеризирани общо 20 бактериални щама. Биохимичните дейности бяха тествани чрез използване на цитрат, производство на индол, тест за метилово червено, редукция на нитрати, Voges Proskauer, тест за каталаза, използване на оксидазни въглехидрати (декстроза, манитол и захароза), хидролиза на нишесте и тест за втечняване на желатина [32].
Идентификация, базирана на 16S рДНК
От общо 20 бактериални щама, щам OS4 е идентифициран чрез анализ на 16S rDNA генна последователност. Частичното секвениране на 16S рДНК на щама OS4 е направено в търговската мрежа от Sequencing Service, Macrogen Inc., Сеул, Южна Корея, като се използват универсални праймери, 518F (5′CCAGCAGCCGCGGTAATACG3 ′) и 800R (5′TACCAGGGTATCTAATCC3 ′). По-късно данните за нуклеотидната последователност бяха депозирани в базата данни на Gen-Bank, NCBI. Онлайн програмата NCBI nBLAST беше използвана за идентифициране на свързаните последователности с известна таксономична информация, която вече присъства на уебсайта на NCBI (http://www.ncbi.nlm.nih.gov/BLAST), за да идентифицира точно бактериалния щам OS4. Филогенетичното дърво е конструирано по метода за присъединяване на съседи [33] на софтуерната програма MEGA 4.1 [34].
Оптимизиране на условията за намаляване на растежа и шествалентния хром
Ефектът на жизнеспособните бактериални популации и рН върху редукцията на хексавалентен хром, Cr (VI), се оценява, като се използва хранителен бульон (NB), изменен със 100 µg ml -1 на Cr 6+. Стерилизираната среда се регулира до рН от 2 до 12 с 1 М HCL или 1 М NaOH. A-100 µl експоненциално отгледана култура на S. maltophilia OS4 се инокулира в NB среда, съдържаща до 100 µgml −1 Cr (VI) и се инкубира при 35 ± 2 ° C в инкубатор за разклащане в орбита при 120 rpm до 48 h. За редукция на Cr 6+ 1 ml култура от всяка колба се центрофугира (6000 rpm) в продължение на 10 минути при 20 ° C и Cr 6+ в супернатанта се определя по метода 1,5 – дифенил карбазид [35], [36 ].
Средни и растежни условия за приготвяне на супернатанта
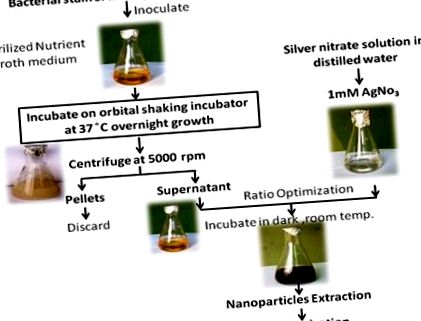
Бактериалният изолат OS4 се инокулира в стерилна NB среда (рН 7.2). Бактериите се оставят да растат при 35 ± 2 ° С в продължение на 24 часа в 500 ml Erlenmeyer колба с работен обем 300 ml с разбъркване при 120 rpm в инкубатор за разклащане в орбита (Remi CIS 24BL, Индия). След това хранителната среда се центрофугира при 5000 rpm, за да се получи безклетъчен супернатант [37].
Подготовка и характеризиране на AgNP
За да се получат AgNPs, 2 ml супернатант, екстрахиран от експоненциално отгледана бактериална култура, се добавя към 98 ml 1 mM разтвор на AgNO3 [38]. Реакционната смес се инкубира на тъмно при стайна температура. Всички стъпки по последователен начин са дадени на фигура 1 .
За повече подробности вижте Материали и методи.
Пречистване на AgNPs
За синтеза на AgNPs се използва бактериална супернатанта. Био-редукцията на сребро се наблюдава чрез UV-vis спектрите на абсорбция като функция от времето на реакционната смес. Синтезираните частици се промиват шест пъти чрез центрофугиране и се диспергират в двойно дестилирана вода, за да се отстранят останалите неконвертирани сребърни йони. Те бяха прехвърлени в диализна торба с границата от 12 kDa. AgNPs бяха ресуспендирани в 1 ml HEPES буфер (20 тМ, рН 7.4), допълнен със захароза, за да достигнат плътност от 2.5 g/ml. Разтворът се поставя на дъното на епруветка за центрофуга (15 ml). 12 ml от линеен градиент на захароза (0,25–1,0 М) плътност се наслоява върху суспензията на наночастиците и се подлага на центрофугиране (10 000 оборота в минута при 4 ° С в продължение на 4 часа) и се събира за по-нататъшно характеризиране. Концентрацията на наночастици в разтвор се определя чрез ICP-AES (Liberty RL) [39].
UV-видими и нанофокс спектър анализ
Намаляването на сребърните йони (Ag +) беше внимателно наблюдавано чрез измерване на UV-видимия спектър на реакционната среда, инкубирана за една нощ след разреждане на малко количество аликвотни части, приготвени в двойно дестилирана вода [40]. Тъй като AgNPs са разтворими във вода, се наблюдава промяната в цвета. По време на фазата на синтез се забелязва образуване на жълтеникавокафяв цвят. Концентрацията на получените AgNPs беше измерена с помощта на UV-vis спектрометър (Thermo Spectronic 20D +) между 250 и 600 nm дължина на вълната, използвайки кварцови кювети с дължина на оптичния път с дължина 10 mm. Допълнителни анализи на разпределението на наночастиците и стабилността в разтвора са наблюдавани от анализатора за размер на частиците Nanophox [18].
FTIR анализ на спектъра
Използва се RXI FTIR спектрометър с KBr лъчев сплитер, за да се установи участието на биологични части в синтеза на частици. За да се отстранят остатъците от свободна биомаса, остатъчният разтвор след реакцията се центрофугира при 8000 rpm в продължение на 30 минути и получените пелети се смесват в 20 ml стерилна двойно дестилирана вода и се цикломиксират за 10 минути на вихрови смесители. След това процесът на центрофугиране и повторно диспергиране се повтаря три пъти. FTIR спектрите на AgNO3, бактериална биомаса и AgNPs са записани като KBr пелети с разделителна способност 4 cm -1 в областта на вълновите числа 400-4000 cm -1 [41].
Анализ на рентгенова дифракция и сканиране на полеви емисии с електронна микроскопия
Рентгенодифракционен анализ (XRD) беше извършен с помощта на Rigaku Miniflex рентгенов дифрактометър с Cu-Kα излъчвания (λ = 0.15406 nm) в 2θ диапазон от 20 ° до 80 °. Освен това морфологията на AgNPs беше изследвана чрез сканираща електронна микроскопия на полеви емисии (FESEM) на Hitachi SU6600. Листът от пробите се приготвя върху медна решетка с покритие от въглерод чрез пускане на малко количество от пробата и преди измерванията решетките се оставят да изсъхнат при стайна температура [42].
Пуснете кинетика на AgNP
AgNPs бяха поставени в диализна торба с отрязани 12 kDa. Торбата се суспендира в буферен разтвор на HEPES (20 ml, рН 7,4). Непрекъснатото освобождаване на AgNPs беше измерено за период от 48 часа. Изчислява се скоростта на освобождаване и редът на кинетиката. Концентрацията на освободеното сребро се определя с атомно-абсорбционен спектрофотометър (GBC, Австралия). Накратко, разтворът на AgNPs се обработва при 100 ° C в концентрирана азотна киселина в маслена баня в продължение на 2 h за пълно разтваряне и след това се измерва концентрацията на среброто от въздух/ацетиленов пламък чрез използване на сребърен пламък, дебит на горивото от 0,9 до 1,2 L/min и температура на атомизиране 1100 ° C [43]. Процентът на отделеното сребро се изчислява, като се използва уравнение:
където Wc е общото съдържание на сребро в диализната торба, а Wt е съдържанието на сребро в буферния разтвор в даден момент.
Животински модел за изследвания на ефикасността и токсичността
За тестове за остра токсичност женски мишки BALB/c с тегло 18 ± 2 g и на възраст 8–10 седмици са получени от съоръжението за отглеждане на животни на Interdisciplinary Biotechnology Unit, A.M.U., Aligarh. Животните бяха хранени със стандартна диета с гранули и имаха достъп до вода ad libitum. Техниките, използвани за кървене и инжектиране, са били стриктно спазвани в съответствие с мандатите, одобрени от правителството на Индия, комисия по етика на животните за контрол и наблюдение на експерименти върху животни.
Подготовка на клетки
Клетките на далака бяха изолирани от мишки и раздразнени в среда RPMI 1640. След центрофугиране, едноклетъчната суспензия се третира с ACK-лизиращ буфер (8.29 g/L NH4Cl, 1 g/L KHCO2, 37.2 mg/L EDTA/2Na), за да лизира червените кръвни клетки. След центрофугиране клетките се поддържат в среда RPMI 1640, допълнена с антибиотичен и антимикотичен разтвор (Sigma) и 10% топлинно инактивиран фетален телешки серум (FCS; сигма). Клетките се култивират в 96-ямкови плаки с плоско дъно в ямка в 0,1 ml хранителна среда за анализ на клетъчна пролиферация и се стимулират с AgNPs (0-500 µgml -1). Спленоцитите се култивират в продължение на 24 часа при 37 ° С във влажна атмосфера, съдържаща 5% СО2 и 95% въздух. Тук използваните спленоцити бяха предварително активирани чрез използване на 5 µg/ml ConA за 48 часа инкубация.
Определяне на поглъщането на AgNP от HeLa клетки
Клетъчната линия HeLa се поддържа в хранителна среда RPMI 1640, допълнена с 10% топлинно инактивиран фетален телешки серум. Клетките се посяват с плътност 104 клетки върху стъклени покривни стъкла и се култивират в продължение на 24 часа при 37 ° С. Впоследствие клетките бяха изложени на AgNPs. Плаките се инкубират в продължение на 1 час. Клетките се фиксират с 2% параформалдехид в продължение на 2 часа, последвано от промиване с HBSS. Фиксираните клетки се наблюдават под микроскоп.
MTT анализ на спленоцити
Цитотоксичността на AgNP върху миши спленоцити се определя по предварително докладван метод, стандартизиран в нашата лаборатория [18]. След стимулация с AgNPs (0-500 µgml -1) в продължение на 24 часа при 37 ° С, спленоцитите се центрофугират и промиват два пъти със свежа среда RPMI 1640 и се отглеждат в 0,5 mgml -1 MTT (разтворени в PBS и филтрирани през 0,2 mm мембрана) при 37 ° C. След 4 часа вътреклетъчните кристали на формазан се разтварят в диметилсулфоксид и стойностите на абсорбция се измерват при 570 nm. Стойностите на абсорбцията са изразени като скорост на клетъчна пролиферация (%), според контролната група като 100%.
MTT анализ на клетъчни линии HeLa
Клетъчната линия HeLa се поддържа в хранителна среда RPMI 1640, допълнена с 10% топлинно инактивиран фетален телешки серум. Клетките се посяват с плътност 5 × 104 клетки на гнездо в U-дъно с 96 гнезда и се култивират в продължение на 24 часа при 37 ° С. Впоследствие клетките бяха изложени на различни концентрации на AgNPs (0-500 µgml -1). Плаките се инкубират в продължение на 48 часа и клетъчната пролиферация се измерва чрез добавяне на 20 uL МТТ (тиазолил син тетразолиев бромид) багрило (5 mg/ml във фосфатно буфериран физиологичен разтвор) на гнездо. Плаките се инкубират още 4 часа при 37 ° С в овлажнена камера, съдържаща 5% СО2. Формазановите кристали, образувани поради редукция на багрилото от жизнеспособни клетки във всяка ямка, се разтварят в 150 uL диметилсулфоксид и абсорбцията се отчита при 570 nm. Стойностите на абсорбцията са изразени като скорост на клетъчна пролиферация (%), според контролната група като 100%.
Тест за остра токсичност за AgNP
Чернодробната токсичност се проследява чрез прилагане на режим на еднократна доза от 100 µg/ml за определяне на биохимичните профили на серумна аспартат аминотрансфераза (AST) и аланин аминотрансфераза (ALT) чрез съответни комплекти за откриване (COGENT, Span Diagnostics Ltd., Индия). Кръв се събира чрез ретро орбитална пункция от мишки от две групи, включително (i) нелекувани и (ii) третирани след 24 часа. Кръвта се оставя да се съсирва при стайна температура и серумът се отделя. Аспартат аминотрансферазата и аланин аминотрансферазата се определят в серума съгласно съответните насоки, предоставени от производителя.
Тест за лизис на RBC за AgNP
Тестът за лизис на еритроцити in vitro се провежда като предварителен тест за токсичност, който се оценява чрез измерване на хемоглобина, отделен в резултат на изтичане на мембрана или прекъсване, причинено от излагане на ниски дози на наночастиците. Накратко, прясна кръв, получена от здрав заек, се събира в антикоагулантен разтвор (етилендиамин тетра оцетна киселина) и се центрофугира при 1000 × g в продължение на 10 минути при 4 ° С. Както палтото на Бъфи, така и плазмата бяха изхвърлени. Измитите еритроцити се разреждат с изотоничен буфер (20 mM PBS), за да се получи 50% хематокрит. Степента на хемолиза беше изследвана чрез инкубиране на RBC суспензията с различни концентрации, вариращи от 100 до 300 µg/ml AgNPs при 37 ° C за 1 h. Инкубираните разтвори се центрофугират при 1500 × g след 1 h и супернатантата се събира и анализира чрез ултравиолетова видима спектроскопия (λmax = 576 nm) за освободен хемоглобин. Процентът на хемолизата се определя по следното уравнение:
където Abst е абсорбцията на супернатанта от проби, инкубирани с частиците, Absc е абсорбцията на супернатанта от контролите (нормален физиологичен разтвор), а Abs100% е абсорбцията на супернатанта на контролите, инкубирани в присъствието на 1% Triton® X -100, което причинява пълен лизис на червените кръвни клетки (общ лизис).
Антимикробен анализ
Биофабрикуваните AgNPs са тествани за бактерицидна активност чрез метод за дифузия на агар добре както срещу Грам положителни Staphylococcus aureus, така и срещу Грам отрицателни Escherichia coli и Serratia marcescens. Чистата култура на всяка бактерия се субкултивира в NB среда. Всеки бактериален щам се разпределя равномерно върху отделните плаки с помощта на стерилен стъклен разпръсквач. Кладенци с диаметър 8 mm се пробиват в NA плочи с помощта на гел пункция. Чрез използване на микропипета суспензии от наночастици (12,5, 25 и 50 ug) се изсипват във всяка ямка върху всички плаки. След това плаките се инкубират при 35 ± 2 ° С в продължение на 48 часа и се измерва нивото на зоната на инхибиране на бактериалния растеж [44].
Резултати и дискусия
Характеризиране на бактериален щам
- Антибиотична ефикасност при пневмонит след поглъщане на парафин (керосин) при деца - пълен текст
- Двойно-сляпо, рандомизирано контролирано 12-седмично последващо изпитание за оценка на ефикасността и безопасността
- 5 начина за използване на колоидно сребро
- Аляска Круиз Silver Explorer iExpedition
- Аюрведична медицина за ползи и ефикасност на щитовидната жлеза