Pajau Vangay
1 Биомедицинска информатика и изчислителна биология, Университет на Минесота, Минеаполис, MN 55455, САЩ
Тоня Уорд
2 Биотехнологичен институт, Университет на Минесота, Сейнт Пол, MN 55108, САЩ
Джефри С. Гербер
3 Отдел по инфекциозни болести, Детска болница във Филаделфия, Филаделфия, Пенсилвания 19104, САЩ
Дан Найтс
2 Биотехнологичен институт, Университет на Минесота, Сейнт Пол, MN 55108, САЩ
4 Катедра по компютърни науки и инженерство, Университет на Минесота, Минеаполис, MN 55455, САЩ
Резюме
Антибиотиците са най-често срещаните лекарства, предписвани за деца. Последните епидемиологични данни показват връзка между ранната употреба на антибиотици и фенотипите на заболяването в зряла възраст. Употребата на антибиотици по време на ранна детска възраст предизвиква дисбаланси в чревната микробиота, наречена дисбиоза. Отговорите на чревния микробиом към антибиотиците и неговата потенциална връзка с развитието на заболяването са особено сложни за изследване в променящите се черва на бебето. Тук ние синтезираме съвременни знания, свързващи антибиотици, дисбиоза и болести и предлагаме рамка за изучаване на свързаната с антибиотици дисбиоза при деца. Препоръчваме бъдещи проучвания на медиираните от микробиома ефекти на антибиотиците, фокусирани върху четири вида дисбиоза: загуба на основни таксони, загуба на разнообразие, промени в метаболитния капацитет и цъфтеж на патогени. Създаването на голяма и разнообразна кохорта за определяне на здравословното развитие на микробиома на бебето е от съществено значение за напредъка на диагностиката, интерпретацията и евентуалното лечение на детска дисбиоза. Този подход също ще помогне да се предоставят основани на доказателства препоръки за употребата на антибиотици в кърмаческа възраст.
Въведение
Антибиотиците са най-често срещаните лекарства, отпускани с рецепта, давани на деца (Chai et al., 2012). Епидемиологичните проучвания установяват връзки между употребата на антибиотици в ранна детска възраст и появата на заболявания като затлъстяване, диабет и астма в по-късния живот. Надлъжните проучвания на употребата на антибиотици са показали дълбоки краткосрочни и дългосрочни ефекти на антибиотиците върху разнообразието и състава на чревната микробиота. И накрая, голям и нарастващ брой проучвания предполагат причинно-следствена роля за микробиомен дисбаланс (дисбиоза) при множество заболявания (Biedermann and Rogler, 2015). Разбирането на краткосрочните и дългосрочните ефекти на употребата на антибиотици в ранна възраст върху разнообразието и състава на чревната микробиота е от решаващо значение за идентифициране на рисковете, свързани с нововъзникващите тенденции на предписване. Съществуващата литература обаче има ограничено пряко въздействие върху микробната дисбиоза като връзка между антибиотиците в детството и развитието на болести в по-късен живот.
В този преглед ние синтезираме многобройни допълнителни източници, включително микроекологични проучвания, свързващи антибиотици и дисбиоза, механистични проучвания, свързващи специфични видове дисбиоза със специфични резултати от заболяването и прегледи на епидемиологични проучвания, подкрепящи антибиотиците и повишен риск от заболяване. Чрез този подход ние идентифицирахме четири основни типа дисбиоза, свързана с антибиотици, и представихме рамка за обсъждане и измерване на детската дисбиоза в контекста на няколко основни заболявания. Нашите анализи показват значителни съществуващи доказателства за редица причинно-следствени механизми, чрез които микробиомът медиира риска, свързан с антибиотици.
Прекомерна употреба на антибиотици
По-голямата част от употребата на антибиотици се случва в амбулаторни условия, където до една трета от предписанията са ненужни. През 2010 г. децата получиха 74,5 милиона амбулаторни предписания за антибиотици - по едно за всяко дете в САЩ - което представлява една четвърт от всички лекарства за деца (Hicks et al., 2013). Многобройни проучвания показват, че антибиотиците често се предписват ненужно (Gonzales et al., 2001; McCaig et al., 2003; Nash et al., 2002), с оценки до 50% (Kronman et al., 2014). Близо 30% от децата получават рецепта за антибиотик по време на посещение в първична медицинска помощ (McCaig et al., 2003), най-често неподходящо, за вирусни инфекции на горните дихателни пътища (Gonzales et al., 2001; Nash et al., 2002; Nyquist и др., 1998). Прекомерната употреба на широкоспектърни антибиотици за условия, реагиращи на тесноспектърни агенти, драстично се увеличава (Hersh et al., 2013). Дори след коригиране на разликите във възрастта на пациента, съпътстващите заболявания и социодемографските фактори, децата с едни и същи инфекции могат да получат значително различен процент на предписване на антибиотици в зависимост от практиката или посетения клиницист (Fierro et al., 2014; Gerber et al., 2014) . Този феномен също изглежда универсален: процентите на предписване на антибиотици на глава от населението варират в широки граници в щатите на САЩ (Hicks et al., 2013) и европейските страни (Goossens et al., 2005) без разумна причина за географските разлики в процентите на бактериални инфекции.
Нормално развитие на хост-микробиом
Стомашно-чревно развитие
Развитието на GI-асоциирана лимфоидна тъкан (GALT), включително мезентериални лимфни възли, пластири на Peyer и лимфоцити в собствената ламина е завършено при доносени бебета при раждане (Forchielli and Walker, 2005). Например бокаловите клетки, отговорни за производството на муцин, са функционални до 12 гестационна седмица (Montgomery et al., 1999), както и панелните клетки, които могат да секретират дефензини и лизозими съответно до 13 и 20 гестационна седмица (Louis и Lin, 2009; Maheshwari and Zemlin, 2009; Rumbo and Schiffrin, 2005). Въпреки че доносените бебета се раждат с напълно развити храносмилателни пътища, екзогенната стимулация чрез излагане на хранителни антигени, хормони, растежни фактори и бактерии е необходима, за да предизвика правилна функция през целия живот (Forchielli and Walker, 2005).
Развитие на микробиомите
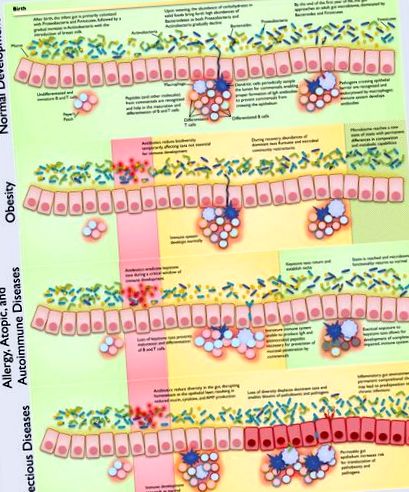
Класовете на заболяванията са свързани с каскадни видове дисбиоза, с важни зависимости от хода на развитието на микробиома гостоприемник. Имайте предвид, че класовете заболявания и типовете дисбиоза не са непременно взаимно изключващи се. Предложените представени механизми са подкрепени с обширни доказателства в литературата, както от механистични проучвания, така и от епидемиологични проучвания. Поради много големия брой препратки, цитиранията, представени на тази фигура, могат да бъдат намерени в Таблица 1 .
Важни взаимодействия между домакин и микробиом
Съзряването на чревната имунна система зависи от паралелното развитие на чревния микробиом (Фигура 1); са открити без микроби животни със значителни имунологични дефекти в GALT (Macpherson и Harris, 2004), както и неправилно развитие на петна на Peyer и мезентериални лимфни възли (Round and Mazmanian, 2009). Пластирите на Пайер и мезентериалните лимфни възли се развиват пренатално, а изолираните лимфоидни фоликули се развиват постнатално, но всички тези тъкани изискват взаимодействие с ключови членове на чревния микробиом, за да се осигури правилна диференциация и спецификация и пълно развитие на адаптивния имунитет (Cherrier и Eberl, 2012; Maynard et al., 2012). Имунната система трябва да поддържа противовъзпалително състояние (Tsuji и Kosaka, 2008) в червата, особено по време на излагане на значителен брой безвредни антигени от коменсали, хормони и храна.
Други основни влияния върху развитието на микробиомите
Начинът на раждане оказва влияние върху микробиома на кърмачетата, тъй като общият микробиом (кожа, устна лигавица, назофарингеален аспират и меконий) на вагинално доставени бебета прилича на вагинален и чревен микробиом на майката, докато бебетата, родени чрез цезарово сечение, имат общи микробиоми микробиома на майчината кожа (Dominguez-Bello et al., 2010). По-конкретно, микробиомите на вагинално доставени бебета се състоят най-вече от Lactobacillus, Prevotella, Atopobium или Sneathia spp, докато микробиомът на бебетата, донесени чрез цезарово сечение, съдържа Staphylococcus spp (Dominguez-Bello et al., 2010) и по-малко Bifidobacterium (Biasucci et al., 2010).
Рамки за изучаване на детската дисбиоза и свързаните с нея болести
Механизмите и здравните последици от детската дисбиоза са сложни и многофакторни и се усложняват допълнително, когато се обмисля и развитието на бебето (чревен микробиом, имунна система и техните взаимодействия). Използвайки системен подход, ние разглеждаме пет взаимозависими рамки за разбиране на дисбиозата, които се фокусират върху различни аспекти на механизмите, които водят до заболяване. Ние обсъждаме тези концептуални рамки по отношение на техните относителни достойнства за яснота, потенциал за организация и способност да изразяват многофакторни пътища на заболяването. Ние ограничаваме хипотезите си до тези, които предполагат дългосрочни ефекти върху здравето на един или повече кратки отделни курса на антибиотици, тъй като това е най-често срещаният тип излагане на антибиотици при човешки деца (Gevers et al., 2014). Всяка перспектива има силни страни в способността си да обобщава някои аспекти на детската дисбиоза. Като цяло, ние откриваме, че комбинацията от перспективи, ориентирани към дисбиозата и болестта, е най-полезна за обсъждане на механизмите на заболяването.
Изглед, ориентиран към дисбиозата
Изглед, ориентиран към заболяването
Възраст-центричен изглед
Дисбиозата може да се разреши с пълно възстановяване и минимално въздействие върху здравето на гостоприемника или може да има драстични нежелани последици в зависимост от етапа на развитие на гостоприемника. Развитието на микробиома и имунната система гостоприемник може да бъде категоризирано удобно, макар и приблизително, на четири основни етапа: (1) 0 до 6 месеца, (2) 6 до 12 месеца, (3) 12 до 24 месеца и (4) 24 месеца и повече. Детето е най-уязвимо за развитие на имунологични дефекти по време на Етап 1, когато адаптивното имунно взаимодействие с ключови таксони е най-критично (van der Velden et al., 2001; Prescott et al., 1999; Rautava et al., 2004). Към етап 4 чревният микробиом установява новообразуван застой, когато достигне зрялост, извършвайки всякакви съществуващи функционални промени, които биха могли да предразположат гостоприемника към бъдещи заболявания. Въпреки че уязвимостите на всеки етап от развитието са важни съображения за разбирането на дисбиозата, разглеждането на сегрегираните етапи пречи на характеризирането на механизмите, които обхващат множество етапи.
Изглед, ориентиран към отговора
(А) Микробиомите на бебешките черва се развиват бързо и изпитват големи промени по време на ранна детска възраст, преди да станат неразличими от възрастните микробиоми до 2-годишна възраст. Дисбиозата при бебета може да измести (без възстановяване) или да забави (бавно възстановяване) развитието по нормалната траектория на растеж.
(Б) Проби са получени от едно бебе с течение на времето (Koenig et al., 2011; и разстоянието от микробиоми (Bray-Curtis) до себе си на 2-годишна възраст е начертано във времето. Фекалните проби, събрани непосредствено след антибиотиците, са обозначени в синьо Изглаждащ сплайн (в светло синьо) разкрива забележима промяна в траекторията на развитие след употреба на антибиотици, отразявайки отклонението в траекторията, предвидено на фигура 2А.
Възглед, ориентиран към възстановяването
Текущи доказателства за свързаните с детската дисбиоза механизми на заболяванията
При разглеждането на няколко алтернативни лещи, чрез които да обсъдим и организираме детска дисбиоза, решихме да използваме комбинация от перспективите, ориентирани към дисбиозата и болестта, за обобщаване и синтезиране на съществуващите знания за потенциалните болестни механизми (Таблица 1). Тази комбинирана рамка ни позволява да картографираме множество причини за едно и също заболяване, като същевременно следим различните етапи на развитие и лечение, които са в основата на различните известни или предложени механизми. Въпреки че причинно-следственият път между дисбиозата и заболяването може да приеме много форми, ние представяме четири важни класа заболявания в основните допринасящи видове дисбиоза.
маса 1
Референции Синтезиране на механични и епидемиологични доказателства, свързващи антибиотици, промени в чревния микробиом и болест
| Инфекциозни заболявания | |
| Антибиотици и болести | Ayres et al., 2012; Brandl et al., 2008; Buffie et al., 2012; Croswell et al., 2009; Noverr et al., 2004; Deshmukh et al., 2014; Lawley et al., 2008; Секиров и др., 2008 |
| Антибиотици и микробиом | Ayres et al., 2012; Brandl et al., 2008; Buffie et al., 2012; Croswell et al., 2009; Deshmukh et al., 2014; Donskey et al., 2000; Lawley et al., 2008; Noverr et al., 2004; Секиров и др., 2008 |
| Микробиом и болест | Abt et al., 2012; Asahara et al., 2001; Buffie et al., 2012; Deshmukh et al., 2014; Lawley et al., 2008; Mai et al., 2011; Mazmanian et al., 2008; Shu et al., 2000; Wang et al., 2009 |
| Алергия, атопични и автоимунни заболявания | |
| Антибиотици и болести | Droste et al., 2000; Horton et al., 2014; Hviid и сътр., 2011; Johnson et al., 2005; Marild et al., 2013; McKeever et al., 2002; Ong et al., 2014; Russell et al., 2012; Стефка и др., 2014 |
| Антибиотици и микробиом | Arnold et al., 2011; Russell et al., 2012; Стефка и др., 2014 |
| Микробиом и болест | Arnold et al., 2011, Abrahamsson et al., 2012; Atarashi et al., 2013; Bisgaard et al., 2011; Bjorksten et al., 2001; Cani et al., 2008; Giongo et al., 2011; Лий и Мазманян, 2010; Lundell et al., 2014; Olszak et al., 2012; Russell et al., 2012; Sellitto et al., 2012; Sjögren et al., 2009; Stefka et al., 2014; Wen et al., 2008; Wu et al., 2010 |
| Затлъстяване | |
| Антибиотици и болести | Айслев и др., 2011; Bailey et al., 2014; Cho et al., 2012; Cox et al., 2014; Trasande et al., 2013 |
| Антибиотици и микробиом | Айслев и др., 2011; Cho et al., 2012; Cox et al., 2014 |
| Микробиом и болест | Айслев и др., 2011; Cho et al., 2012; Cox et al., 2014; Ley et al., 2006; Ridaura et al., 2013; Turnbaugh et al., 2009 |
Затлъстяване
Алергия и атопични разстройства
Автоимунни заболявания
Инфекциозни заболявания
- Информация за алкохолни чернодробни заболявания Планината Синай - Ню Йорк
- Закуска за хронично бъбречно заболяване Бъбречна диета Меню Щаб
- 10 храни, които да добавите към вашата диета за автоимунно заболяване TheThirty
- Alopecia areata и целиакия не влияят на безглутенова диета върху растежа на косата - Резюме -
- 10 храни за борба с болестите при кучета