Резюме
Предистория/Цели
9- [2- (фосфонометокси) етил] гуанин (PMEG) е едно от най-активните антипролиферативни съединения в поредица ациклични нуклеозидни фосфонати и е активен при интраперитонеални тумори P388 при мишки.
Методи
Ние синтезирахме октадецилоксиетил (ODE) и хексадецилоксипропилови естери на PMEG и сравнихме тяхната антипролиферативна активност с немодифициран PMEG в първични човешки фибробласти и CaSki, Me-180 и HeLa човешки клетъчни линии на рак на маточната шийка in vitro.
Резултати
ODE-PMEG имаше отлична антипролиферативна активност in vitro в този панел от човешки рак на маточната шийка. Сравнихме ефектите на ODE-PMEG и ODE-цидофовир (ODE-CDV) в модел на солиден тумор, като използвахме човешки клетъчни линии на рак на маточната шийка Me-180 при голи мишки с атиматична форма. Интратуморално инжектиране на 25 μg ODE-PMEG или 100 μg ODE-CDV дневно в продължение на 21 дни, последвано от наблюдение в продължение на 20–35 дни, доведе до почти пълно изчезване на измеримия рак на маточната шийка.
Заключение
ODE-PMEG може да бъде подходящ за локално или локално лечение на цервикална дисплазия.
Въведение
Съобщава се, че ацикличният нуклеозид фосфонат (S) -1- [3-хидрокси-2- (фосфонилметокси) -пропил] -цитозин (цидофовир, CDV) инхибира селективно пролиферацията на човешки папиломавирус ДНК + ракови клетки in vitro [1,2, 3,4,5], при животни [2] и при мъже [6]. Съобщава се, че CDV намалява нивата на Е6 онкопротеина, което води до увеличаване на p53 и pRb, позволявайки на клетката да си възвърне контрола върху клетъчния цикъл, забавяйки пролиферацията и водещо до апоптоза [2,3,4].
Антивирусната активност на CDV срещу няколко двуверижни ДНК вируси (човешки цитомегаловирус, ваксиния, кравешка шарка) може да се увеличи на няколко трупа чрез естерификация с алкоксиалкилови групи като хексадецилоксипропил (HDP) или октадецилоксиетил (ODE) [7,8,9,10] . Доказано е, че това се дължи на силно увеличено навлизане на клетките на липидно модифицираното лекарство и по-високи вътреклетъчни нива на CDV-дифосфат, активният инхибитор на вирусни ДНК полимерази [11]. Подобни резултати бяха отбелязани при HDP естери на (S) -HPMPA в заразени с HIV-1 клетки [12,13,14]. Както беше отбелязано по-горе, се съобщава, че CDV е силно антипролиферативен срещу ракови клетки на маточната шийка [1,2,3,4,5]. Изследвахме ефекта на ODE-CDV и няколко други CDV аналога върху пролиферацията на първични фибробласти и човешки клетъчни линии на рак на маточната шийка in vitro. ODE-CDV е няколко трупа, по-активни в инхибирането на пролиферацията на ракови клетки на маточната шийка, отколкото CDV, и показва 2,5 до 140-кратна селективност за раковите клетки на маточната шийка в сравнение с нормалните човешки фибробластни препуциуми (HFF) [1].
Наскоро синтезирахме HDP и ODE естери на поредица от други ациклични нуклеозидни фосфонати, включително 9- [2- (фосфонометокси) етил] гуанин (PMEG) и ги тествахме за антивирусна активност срещу HIV-1 в човешките Т лимфобластни левкемични клетъчни линии, CEM и MT-2. Като част от антивирусната оценка, ние извършихме in vitro оценки на цитотоксичността и установихме, че ODE-PMEG е силно антипролиферативен в MT-2 клетки с 50% инхибиторна концентрация (IC50) от 1 × 10 −7 μM. IC50 в CEM-SS клетки е 6 × 10 −5 μM [15]. Въпреки че ODE-PMEG изглеждаше силно активен в заразени с HIV-1 клетки, индексът на селективност беше много нисък и беше направено заключението, че очевидният антивирусен ефект може да се обясни с подчертаните антипролиферативни ефекти на ODE-PMEG [15]. За да видим дали тези открития се простират до бързо разделящи се човешки ракови клетки на маточната шийка, ние оценихме антипролиферативната активност на немодифицирани PMEG, HDP-PMEG и ODE-PMEG в три човешки клетъчни линии на рак на маточната шийка, CaSki, Me-180 и HeLa, и при нормален HFF клетки. И накрая, имплантирахме Me-180 ракови клетки на шийката на матката в хълбока на голи мишки с атимус, позволихме да се образуват солидни тумори и оценихме антитуморните ефекти на локалните инжекции на ODE-CDV и ODE-PMEG in vivo.
Материали и методи
Синтез на алкоксиалкилови естери на PMEG
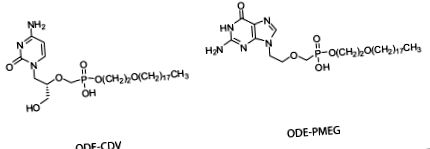
HDP-PMEG и ODE-PMEG са синтезирани, пречистени и характеризирани, както е описано по-горе [15]. Синтезът и оценката на HDP-CDV и ODE-CDV са докладвани по-рано [7,14]. Чистотата на съединенията, използвани в това проучване, се оценява на> 98%. Данните за протонен ядрено-магнитен резонанс и масспектроскопия за тези съединения са докладвани по-рано [7,10,15]. Структурите на ODE-CDV и ODE-PMEG са показани на фигура фигура 1 1 .
Структури на ODE-CDV и ODE-PMEG.
Клетъчни линии и клетъчна култура
Нормални HFF клетки (CRL-1634, Hs27) са получени от American Type Culture Collection (Manassas, Va., USA) и се поддържат в минимална основна среда, съдържаща 10% фетален говежди серум (Gibco, Grand Island, NY, USA). Клетъчните линии на рака на маточната шийка, свързани с HPV подтипове 16, 68 и 18, CaSki (CRL-1550), Me-180 (HTB-33) и HeLa (CCL-2), също са получени от Американската колекция за култури на типове и се поддържат в McCoy's 5Средна или минимална основна среда, съдържаща 10% фетален говежди серум [1].
Анализи за клетъчно разпространение
Клетъчните линии се посяват при 5 × 10 3 на гнездо в 96-гнездови плаки, като се използва среда с добавен 10% фетален говежди серум и се инкубират за около 24 часа, както е описано по-горе [1]. Приготвя се 10 mM основен разтвор на PMEG във вода; 10 mM запаси HDP-PMEG и ODE-PMEG бяха приготвени в 10% DMSO в дестилирана вода. Направени са серийни разреждания на лекарството в среда, съдържаща 2% фетален говежди серум, за да се получи крайна концентрация от 6% фетален говежди серум, добавена към ямките и инкубирана при 37 ° С в продължение на 5 дни. Определянето на клетъчната пролиферация се извършва с помощта на XTT Cell Proliferation Kit II, съгласно инструкциите на производителя (Roche Molecular Biochemicals, Mannheim, Германия). Накратко, реагентите се смесват и се добавят в ямките и се поставят в шейкър за 15 минути, последвано от инкубация при 37 ° С за около 30 минути. OD450 се определя с помощта на ELISA четец за плаки (Biotek Instruments, Winooski, Vt., USA). Данните бяха нанесени и IC50 беше оценен с помощта на графичен софтуер (Prizm, GraphPad Software, Сан Диего, Калифорния, САЩ).
Me-180 Тумори при голи мишки от атимична форма
Женски атимични голи мишки Balb/c (Charles River) се инжектират подкожно с 5 × 10 6 Me-180 ракови клетки на маточната шийка. Туморите бяха оставени да се установят за 14 дни. След това бяха направени измервания на тумора от апарати за измерване на две измерения на тумора в милиметри. Тези размери са умножени за оценка на общия обем на тумора. Измерванията на изходния обем на тумора са приблизително 30–35 mm. След това мишките бяха рандомизирани в три групи от по 8 мишки, всяка и третирани с интратуморна инжекция от 0,9% физиологичен разтвор или посочените дози ODE-CDV или ODE-PMEG. Интратуморният инжекционен обем е 50 μl. Измерванията на размера на тумора и телесното тегло се правят 3 пъти седмично за посочените времена. В експериментите с ODE-CDV, мишки, носещи тумор, се дозират чрез интратуморална инжекция от 50 μg (2 mg/kg) или 100 μg (4 mg/kg) дневно в продължение на 21 дни. Теглото и размерът на тумора се оценяват 3 пъти седмично до ден 21. След спиране на лечението животните се поддържат до ден 56, когато размерът на тумора е преоценен (фиг. (Фиг. 2). 2). В експериментите с ODE-PMEG, животните са дозирани чрез интратуморално инжектиране на 25 μg (1 mg/kg) или 12.5 μg (0.5 mg/kg) ODE-PMEG, както е посочено за 21 дни, докато контролните мишки получават 0.9% физиологичен разтвор . Размерът на тумора се измерва 3 пъти седмично в продължение на 40 дни (фиг. (Фиг. 3 3).
Ефект от ежедневните интратуморални инжекции на ODE-CDV в продължение на 21 дни върху Me-180 тумори in vivo.
Ефект на ежедневни или през ден интратуморални инжекции в продължение на 21 дни ODE-PMEG върху солидни тумори Me-180 при голи мишки на атимични животни in vivo.
Резултати
Антипролиферативната активност на PMEG се оценява след 5-дневна експозиция в първични HFF клетки и в 3 човешки клетъчни линии на рак на маточната шийка, като се използва анализ на XTT клетъчна пролиферация и IC50 се оценява и сравнява с HDP-PMEG и ODE-PMEG (таблица (таблица 1 ). 1). В повечето клетъчни линии на рак на маточната шийка HDP-PMEG и ODE-PMEG са 600–400 000 пъти по-инхибиторни от немодифицираните PMEG. Изключение се наблюдава при HDP-PMEG в клетките Me-180. При нормални HFF клетки се забелязват по-малки 3- до 9-кратно повишаване на антипролиферативната активност за HDP-PMEG и ODE-PMEG спрямо много ниските IC50 стойности, отбелязани в клетъчните линии на рака на маточната шийка.
маса 1
Антипролиферативна активност на PMEG, HDP-PMEG и ODE-PMEG в първични HFF клетки и CaSKi, Me-180 и HeLa цервикални ракови клетки in vitro
| Първични HFF клетки | |||
| PMEG | 45 ± 42 (2) | - | - |
| HDP-PMEG | 18 ± 21 (3) | 2.5 | - |
| ODE-PMEG | 5,0 ± 1,7 (3) | 9.0 | - |
| CaSki клетки (HPV 16) | |||
| PMEG | 18 ± 3,2 (3) | - | 2.5 |
| HDP-PMEG | 0,027 ± 0,01 (3) | 667 | 667 |
| ODE-PMEG | 0,002 ± 0,003 (6) | 9 000 | 2 500 |
| Ме-180 клетки (HPV 68) | |||
| PMEG | 9,3 ± 2,5 (3) | - | 4.8 |
| HDP-PMEG | 11,4 ± 6,9 (3) | 0.8 | 1.6 |
| ODE-PMEG | 0,002 ± 0,003 (3) | 4650 | 2 500 |
| HeLa клетки (HPV 18) | |||
| PMEG | 14,4 ± 11,5 (4) | - | 3.1 |
| HDP-PMEG | 5 × 10 −4 ± 5 × 10 −4 (4) | 28 800 | 36 000 |
| ODE-PMEG | 3,5 × 10 −5 ± 1 × 10 −4 (3) | 411 000 | 143 000 |
IC50 намалява броя на жизнеспособните клетки с 50% в анализа на XTT клетъчна пролиферация. Данните за IC50 са средни ± SD. Числата в скоби са броят на повторенията. Селективност на различните лекарства за ракови клетки спрямо първични HFF клетки (Селективност = IC50 HFF/IC50 ракови клетки). Разликата на сгъване е кратното увеличение на антипролиферативната активност спрямо немодифицираното нуклеотидно лекарство.
Сравнихме антипролиферативната активност на ODE-PMEG с тази, съобщена по-рано за ODE-CDV в HFF клетки и клетъчни линии на рак на маточната шийка [1]. В първичните HFF клетки ODE-CDV и ODE-PMEG имат сравними IC50 стойности, 4.2 и 5.0 μM (таблица (таблица2). 2). Въпреки това, при човешки ракови клетки на шийката на матката in vitro ODE-PMEG е значително по-инхибиторен от ODE-CDV: 850 пъти по-голям в клетките CaSki, 195 пъти по-голям в Me-180 и 857 пъти по-голям в клетките HeLa (таблица ( таблица2). 2). ODE-PMEG беше най-активното съединение със стойности на IC50 в раковите клетки на маточната шийка, вариращи от 0,035 до 2 nM (таблица (таблица 2). 2). Това представлява преференциално инхибиране на пролиферацията чрез ODE-PMEG на човешки ракови клетки на шийката на матката от> 2500 спрямо стойностите на IC50 в първичните HFF клетки.
Таблица 2
Сравнение на антипролиферативните ефекти на ODE-CDV с ODE-PMEG в първични HFF клетки и в човешки клетъчни линии на рак на маточната шийка CaSki, Me-180 и HeLa
| CDV | 853 | 910 | 627 | 516 |
| ODE-CDV | 4.2 | 1.7 | 0,39 | 0,03 |
| PMEG | 45,0 | 18,0 | 9.3 | 14.4 |
| ODE-PMEG | 5.0 | 0,002 | 0,002 | 3,5 × 10 −5 |
CDV и ODE-CDV данните са от Hostetler et al. [1]. Данните за PMEG и ODE-PMEG са от таблица table1 1 .
Дискусия
Ацикличните нуклеозидни фосфонати като CDV, (S) -HPMPA и PMEG имат ограничено клетъчно поемане и етерифицирането с HDP и ODE групи е доказано, че увеличава поемането на клетките с повече от 100 пъти in vitro [11,13,14]. За първи път докладваме за синтеза на ODE-PMEG през 2006 г. като част от проучване на способността на алкоксиалкилови естери на ациклични нуклеозидни фосфонати да инхибират репликацията на HIV-1 в заразените клетки [15]. ODE-PMEG е силно цитотоксичен в МТ-2 лимфобластни Т клетки с IC50 стойност -7 μM, докато немодифицираният PMEG е поне 1000 пъти по-малко цитотоксичен [15]. IC50 за ODE-PMEG в CEM-SS клетки, линия на човешка Т клетъчна левкемия, е 6 × 10 -5 μM; По-рано беше съобщено, че за самия PMEG има IC50 стойност от 0.7 μM в CEM-SS клетки [16]. По този начин ODE-PMEG е няколко хиляди пъти по-антипролиферативен от PMEG в CEM-SS клетки in vitro.
По-рано съобщихме, че ODE-CDV е в пъти по-антипролиферативна от немодифицираната CDV в панел от човешки клетъчни линии на рак на маточната шийка [1]. В този доклад сравнихме ODE-CDV и ODE-PMEG срещу няколко човешки клетъчни линии на рак на маточната шийка (таблица (таблица1) 1) и установихме, че те силно инхибират разпространението на рака на маточната шийка. ODE-PMEG е значително по-активен от ODE-CDV до 195 пъти в ракови клетки на шийката на матката на Me-180 (таблица (таблица 2). 2). Активността на ODE-PMEG в солидни тумори Me-180 при голи атимни мишки също е по-голяма от ODE-CDV, но само с коефициент 4.
По отношение на механизма на противотуморната активност, PMEG е доказано, че е най-активен от ацикличните нуклеозидни фосфонати, предизвикващи антипролиферативни ефекти в CEM-SS човешки лимфоцитни левкемични клетки in vitro [16] и е доказано, че е ефективен срещу интраперитонеална P338 левкемия при мишки [17]. PMEG се метаболизира чрез анаболно фосфорилиране до PMEG дифосфат (PMEGpp), който е мощен инхибитор на човешки полимерази α и δ [18] и полимераза ∊ [19]. PMEG може да бъде включен в ДНК и функционира като задължителен терминатор на веригата; само полимераза ∊ може да възстанови завършената с PMEG верига [19].
GS-9219 е пролекарство, което поражда вътреклетъчно PMEGpp. В хроничните лимфоцитни левкемични клетки PMEGpp се вгражда в ДНК в отговор на ултравиолетовото активиране, инхибирайки възстановяването на ДНК и водещо до счупване на вериги и апоптоза [20]. Предполага се, че тези ефекти на PMEGpp са в основата на неговата антитуморна активност [18,19,20]. Волфганг и сътр. [21] наскоро съобщиха проучвания в ракови клетки на маточната шийка с GS-9191, пролекарство, което води до вътреклетъчно PMEG след хидролиза на изопропилфенилаланилови защитни групи върху фосфоната, последвано от дезаминиране към PMEG. PMEG се превръща чрез анаболно фосфорилиране в PMEGpp, активния метаболит. GS-9191 инхибира пролиферацията на различни човешки клетъчни линии на рак на маточната шийка със стойности на IC50, вариращи от 0,03 до 284 nM [21].
Таблица 3
Сравнение на антипролиферативната активност на ODE-PMEG и GS-9191 в клетъчни линии на рак на маточната шийка in vitro
- 6 Accutane странични ефекти, които ми се случиха
- 6 често срещани странични ефекти за изгаряне на мазнини, за които трябва да знаете! Truweight
- 6 често срещани странични ефекти на Paxil, за които трябва да знаете
- Употреба на бета-каротин, странични ефекти, взаимодействия, дозировка и предупреждение
- Ползи от бета-каротин, странични ефекти, дозировка и взаимодействия