1 Департамент по храните и храненето, Университет на Джорджия, Атина, Грузия 30602
1 Департамент по храните и храненето, Университет на Джорджия, Атина, Грузия 30602
1 Департамент по храните и храненето, Университет на Джорджия, Атина, Грузия 30602
Резюме
Ингвинална, епидидимна и ретроперитонеална мастна тъкан от слаби и затлъстели плъхове Zucker, на възраст 3–15 седмици, беше използвана за определяне на връзката между разпределението на размера на адипоцитите, наличието на паракринни растежни фактори в мастната тъкан и последващите промени в броя на адипоцитите. За всяко специфично депо и време, затлъстелите плъхове имат по-голям процент големи адипоцити, отколкото слабите плъхове. Положителна корелация (P разширяването на мастната тъкан, което се случва по време на развитието на затлъстяване, първоначално се характеризира с хипертрофия на мастните клетки (3, 4). Адипоцитите обаче нямат неограничен капацитет за разширяване и се увеличава броят на мастните клетки (3,4). Развитието на хиперпластична мастна тъкан, отбелязано както при генетично, така и при диетично затлъстяване, е свързано с най-тежките форми на затлъстяване (14) и има най-лошата прогноза за лечение (2,3). Разбирането на механизмите, които регулират растежа на мастната тъкан, може да увеличи усилията за разработване на успешни стратегии за превенция и лечение за ограничаване на натрупването на излишни телесни мазнини.
Фауст (10) предполага, че достигането на критичен размер на мастните клетки ще предизвика събитието (я), което води до увеличаване на броя на мастните клетки. Увеличението на средния размер на мастните клетки се появява преди промени в броя на мастните клетки и е известно, че се развива по депо-зависим начин както при генетично (16, 17), така и при индуцирано от диетата (11, 24) затлъстяване. Въпреки това, отбелязването на увеличение на средния размер на мастните клетки не подкрепя ясно хипотезата за критичния размер на мастните клетки. Определянето на профила на разпределение на размера на мастните клетки по-точно представя броя и размера на големите мастни клетки, присъстващи в тъканта (18, 29) и може да помогне да се очертае дали критичният размер предшества развитието на адипоцитна хиперплазия.
Регионалните разлики в хипертрофията на адипоцитите и хиперплазията предполагат, че местно произведените растежни фактори могат да участват в регулирането на адипогенезата (12). Преброяването и оразмеряването на адипоцитите може да определи промени в клетъчността, но са необходими други методи, за да се определи дали митогенни фактори, които могат да регулират развитието на хиперплазия, присъстват в мастната тъкан, когато мастните клетки достигнат критичен размер. Първичната култура на стромални съдови клетки от мастна тъкан е ефективен in vitro метод за изследване на фактори, които променят пролиферацията на преадипоцити (26, 28). Известно е, че медиите, изложени на клетки, изолирани от мастна тъкан или фрагменти от зряла мазнина, съдържат адипогенни фактори, които променят растежа на преадипоцитите в културата (7, 21, 22,30), но тези ефекти не са свързани със специфични промени в размера на адипоцитите разпределение.
Този проект е предназначен да изследва възможната връзка между промените в характеристиките на профила на разпределение на мастните клетки, наличието на локален митогенен фактор (и), получени от мастната тъкан, и развитието на хиперплазия на мастните клетки. Експерименталният протокол е избран, за да помогне да се определи дали увеличените адипоцити са отговорни за секрецията на растежни фактори, които регулират пролиферацията на мастните клетки. Zucker плъховете осигуряват генетичен модел, подходящ за изследване на ролята, която критичният размер на мастните клетки може да играе за развитието на затлъстяване, тъй като хипертрофията на адипоцитите предхожда хиперплазията в регионален модел и развитието (6, 16, 17). Параметрите на клетъчност на мастната тъкан за ингвиналните, епидидималните и ретроперитонеалните депа бяха определени при слаби и затлъстели плъхове на пет възрасти. Първичните преадипоцитни култури бяха използвани като система за биологичен анализ, за да се демонстрира присъствието на митогенни фактори в среда, кондиционирана в мастната тъкан, приготвена от горните депа. Изчислени са коефициенти на корелация, за да се определи дали определен размер на мастните клетки е свързан с in vitro пролиферативната активност на кондиционираната среда и in vivo развитието на хиперплазия.
Животни.
Постно (Фа/?) и затлъстяване (фа/фа) мъжки плъхове Zucker на възраст 3, 6, 9, 12 и 15 седмици са получени от колонията на Университета в Джорджия. Слаби и затлъстели 3-седмични плъхове Zucker не могат да бъдат разграничени чрез визуален преглед. Фенотипната идентификация на тази възрастова група е извършена чрез сравнения на серумните нива на инсулин (ICN Pharmaceuticals, Irving, CA), теглото на ингвиналната подложка спрямо телесното тегло и данните за клетъчност на мастната тъкан (20, 23). За останалите възрастови групи идентифицирането на фенотипа се извършва чрез визуална проверка. Плъховете след отбиване са настанени в окачени телени клетки в стая, регулирана от околната среда за температура (23 ± 3 ° C) и влажност (40-50%), с 12: 12-часов цикъл светлина-тъмнина. Плъховете имаха свободен достъп до гранулирана диета (Ralston Purina, Сейнт Луис, Мисури) и чешмяна вода през цялото време на проучването. Всички процедури за грижи за животните, използвани в това проучване, са одобрени от Институционалния комитет по грижа и употреба на животните в Университета на Джорджия.
В деня на вземане на пробата плъховете се упояват чрез интраперитонеална инжекция на натриев пентобарбитал (50 mg/kg телесно тегло). Ингвиналните, епидидималните и ретроперитонеалните мастни накладки бяха незабавно отстранени и претеглени. Поради ограничени количества мастна тъкан, подложки от два постни плъха се събират, за да осигурят адекватно количество. Аликвотни части от трите депа са взети за изследвания на адипоцитната клетъчност. Подготвена е среда от мастна тъкан от ингвиналното депо за всички възрастови групи, от епидидималните подложки за плъхове на възраст 6, 9, 12 и 15 седмици и от ретроперитонеалното депо за 9-, 12- и 15-седмично стари плъхове.
Клетъчност на мастната тъкан.
Размерът и броят на мастните клетки се определят чрез електронно количествено определяне, използвайки метода на Hirsch и Gallian (15), модифициран от Cartwright (5). Трикратни проби от мастна тъкан (50–70 mg) бяха фиксирани в разтвор, съдържащ 0,12 М осмиев тетроксид (Electron Microscopy Sciences, Форт Вашингтон, Пенсилвания) в 50 mM колидин (2,4,6-триметилпиридин) буфер. Пробите се фиксират за поне 1 седмица при стайна температура, изплакват се с 0,9% NaCl и след това се поставят в 8 М урея за няколко дни, за да се улесни отделянето на клетките от тъканта. Фиксираните адипоцити се изплакват с 0.9% NaCl през 240-милиметров найлонов екран и след това се събират на 20-милиметров найлонов екран (Tetko, Briarcliff Manor, NY). Проби от клетки, които отговарят на стандартите за качество по време на процеса на фиксиране, бяха анализирани на електронен брояч на частици Coulter (модел ZM, Coulter Electronics, Hialeah, FL). Оразмеряването е извършено чрез анализ с двоен праг при девет определени диапазона на размера (30–240 μm), калибрирани със стандарти за микросфера (Coulter Electronics). Преброяването във всички диапазони на размера се извършва в три екземпляра и се отчита като процентно разпределение. Броят на адипоцитите на подложка се изчислява чрез умножаване на средните клетки на милиграм проба по общата маса на съответното депо.
Подготовка на кондиционирана среда.
Мастната тъкан, която не се използва за изследвания на клетъчност, беше микродисектирана за отстраняване на видими кръвоносни съдове, фино смляна, изплакната три пъти в пресен балансиран солев разтвор на Ханкс (HBSS; Sigma Chemical, Сейнт Луис, Мисури), изсъхнала и претеглена. Аликвотни части от тъканите се инкубират в DMEM-хранителна смес F-12 Ham (DMEM-F-12, Sigma), съдържаща 72 mM гентамицин сулфат, 120 mM цефазолин и 27 mM амфотерицин В за 4 h при 37 ° C в овлажнен 5% CO2 атмосфера. Тъй като е известно, че броят на адипоцитите на милиграм тъкан се различава с възрастта и фенотипа, съотношението тъкан към среда е коригирано (1 g тъкан към 5–10 ml среда), за да приближи по-точно равен брой мастни клетки на милилитър средна. След инкубация, кондиционираната среда се отделя от тъканните фрагменти чрез филтриране през качествена хартия Whatman, стерилно се филтрира в асептични флакони и се съхранява замразена при -20 ° C.
Система за биоанализ: първична клетъчна култура.
Стромално-съдови клетки, включително преадипоцити, са получени от ингвиналната мастна тъкан на специфични без патогени мъжки плъхове Sprague-Dawley (80–100 g; Harlan Sprague Dawley, Indianapolis, IN) по методи, описани по-рано (27). Накратко, животните се анестезират чрез интраперитонеална инжекция на натриев пентобарбитал (50 mg/kg) и ингвиналната мастна тъкан се отстранява асептично и се обединява. Всеки грам смляна мастна тъкан се инкубира с 5 ml храносмилателен буфер, състоящ се от 0,1 М HEPES и 6,21 × 10 5 U/l колагеназа тип 1 (Worthington Biomedical, Freehold, NJ) за 90 минути в разклащаща се водна баня при 37 ° C . Диджестите се филтрират през найлонови мрежести екрани с отвори 240 и 20 μm, ресуспендират се в DMEM-F-12 и се центрофугират за 10 минути при 600 ж. Плаващите клетки, пълни с мазнини, бяха изхвърлени. Клетките в стромално-съдовите пелети се промиват с покривна среда (DMEM-F-12 с 10% фетален говежди серум), центрофугират се и след това се ресуспендират в среда за посяване. Аликвотна част от суспензията се смесва с петно на Rappaport и клетките се преброяват на хемоцитометър. Клетките се разреждат с посадъчна среда и се засяват върху 12,5 или 25 cm2 колби за тъканна култура при плътност 4,8 х 10 3 клетки/cm 2. Културите се инкубират при 37 ° С във влажна 5% CO2 атмосфера.
Система за биологичен анализ: анализ на разпространението.
Статистически анализ.
Данните бяха подложени на дисперсионен анализ с помощта на SuperAnova (версия 1.11, Abacus Concepts, Berkeley, CA), за да се определи ефектът от фенотипа, възрастта и депото върху параметрите на клетъчност на мастната тъкан и пролиферативния отговор на преадипоцитите в културата към наличието на мастна тъкан -кондиционирана среда. Контрастите с най-малки квадрати бяха използвани за сравнения между средствата. Простата линейна регресия и коефициентите на корелация на пробата бяха изчислени, за да се определи връзката между процента на клетките в специфични граници на размера, in vitro пролиферативната активност на кондиционираната среда и промените в броя на мастните клетки in vivo през следващия 3-седмичен период. Разликите бяха приети като значителни в P
Таблица 1. Характеристики на мастното депо при мъжки плъхове Zucker
Стойностите са средно-квадратни средни стойности ± SE; не. плъхове/група в скоби. Стойностите в един ред, които не споделят писмо, са значително различни (P F1-f P 50 μm. Допълнителна промяна в общия модел на разпределение на мастните клетки между двата фенотипа е установена при 6 седмици. При постните плъхове се наблюдава увеличаване на размера на мастните клетки, като по-голямата част от клетките в трите депа са засечени в диапазона от 30 до 70 μm. Въпреки това, докато плъховете със затлъстяване продължават да имат значително (P 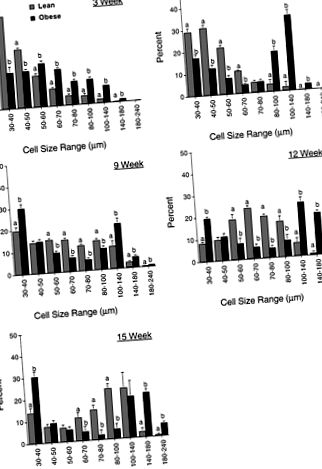
Фиг. 1.Профил на разпределение на размера на клетките за адипоцити от ингвиналната мастна подложка на слаби и затлъстели плъхове Zucker от различни възрасти. Показаните данни са средно-квадратни средни стойности ± SE за 5-9 животни на фенотип на дадена възраст. За всяка възрастова група стойностите в диапазон от размери, които не споделят буква, са значително различни (P
Фиг. 2.Профил на разпределение на размера на клетките за адипоцити от епидидималната мастна подложка на слаби и затлъстели плъхове Zucker от различни възрасти. Показаните данни са средно-квадратни средни стойности ± SE за 5–10 животни на фенотип на дадена възраст. За всяка възрастова група стойностите в диапазон от размери, които не споделят буква, са значително различни (P
Фиг. 3.Профил на разпределение на размера на клетките за адипоцити от ретроперитонеалната мастна подложка на слаби и затлъстели плъхове Zucker от различни възрасти. Показаните данни са средно-квадратни средни стойности ± SE за 4-8 животни на фенотип в дадена възраст. За всяка възрастова група стойностите в диапазон от размери, които не споделят буква, са значително различни (P
Пролиферация на in vitro преадипоцити.
Кондиционирана среда беше използвана за изследване на потенциала на паракринните вещества, секретирани от мастната тъкан, да повлияят на пролиферацията на преадипоцити в първична система от клетъчни култури. Тази система за биоанализ използва култивирани стромално-съдови клетки (включително преадипоцити), получени от ингвинални мастни възглавнички на нормални плъхове за тестване на пролиферативното влияние на кондиционирана среда, приготвена от ингвинални, епидидимални и ретроперитонеални мастни депа на слаби и затлъстели плъхове Zucker. Данните са коригирани, за да представят пролиферативната активност на среда, обусловена от излагане на 100 000 мастни клетки и се изразяват като разлика в усвояването на [3 H] тимидин от култури, третирани с базална контролна среда DMEM-F-12.
Както е показано на фиг.4A, преадипоцитите, изложени на кондиционирана среда, приготвена от ингвинална мастна тъкан на 3-, 6- и 12-седмични затлъстели плъхове, демонстрираха значително (P 3 Н] тимидин) в сравнение с култури, изложени на среда, приготвена от 15-седмични постни плъхове, при които пролиферативната активност е по-малка от основния контрол (-7,7 рМ [3 Н] тимидин).
Фиг. 4.[3 H] включване на тимидин в преадипоцитната фракция на първични клетъчни култури на плъхове, третирани с 25% среда, кондиционирана в мастната тъкан от ингвинална (A,н = 4-8), епидидимална (Б., н= 4–6) и ретроперитонеално (° С,н = 4) депа на слаби и затлъстели плъхове Zucker. Показаните данни са средно най-малките квадратчета ± SE. Данните бяха коригирани, за да представят активността на 100 000 адипоцити, присъстващи в мастната тъкан, използвани за приготвянето на кондиционирана среда и се изразяват като разлика в усвояването на [3Н] тимидин в сравнение с култури, третирани с базална контролна среда. За всяка възрастова група в конкретно депо стойностите, които не споделят писмо, са значително различни (P
Кондиционирана среда, приготвена от епидидимална мастна тъкан на 6- и 12-седмични затлъстели плъхове, има значително (P 3Н] тимидин) в сравнение със затлъстели плъхове (2.6 рМ [3Н] тимидин). В останалите възрастови групи (6, 12 и 15 седмици) няма значителна разлика между фенотипите по репликативния отговор на стромално-съдови клетки, изложени на кондиционирана среда от епидидимална мастна тъкан (данните не са показани).
Няма значителна разлика в пролиферацията на преадипоцити в клетъчни култури, третирани с кондиционирана среда от ретроперитонеална мастна тъкан на 9- или 15-седмични слаби и затлъстели плъхове (Фиг. 4° С). Въпреки това, когато е изложена на кондиционирана среда, приготвена от ретроперитонеална мастна тъкан на 12-седмични затлъстели плъхове, пролиферацията на преадипоцити е била значително (P
Таблица 2. Асоциация на параметрите на клетъчност и пролиферативна активност
Коефициенти на корелация на съотношението между съотношението на малките (30–60 μM), средните (60–100 μM) и големите (100–240 μM) адипоцити, способността на кондиционираната в мастната тъкан среда да стимулира пролиферацията на преадипоцити in vitro и in vivo промяна в броя на мастните клетки през следващ период от 3 седмици (т.е. от 9 до 12 седмици).
Благодарим на Тод Макданиел и на персонала на Бойд Дипломиран център за животни за развъждане и грижи за животни. Благодарим също на Аманда Латимер, Кристина Крас, Мий Йо Лох, Лори Лий и Летиция Хардеман за съдействието при събирането и обработката на проби.
СТЪПКИ
Това изследване беше подкрепено отчасти от Националния институт по диабет и храносмилателни и бъбречни заболявания грант DK-47246 и докторантска стипендия на Министерството на земеделието на САЩ към Б. Г. Маркис.
Разходите за публикуване на тази статия бяха покрити отчасти чрез плащането на такси за страница. Следователно статията трябва да бъде маркирана с „реклама”В съответствие с 18 U.S.C. §1734 единствено за посочване на този факт.
ПРЕПРАТКИ
ЗАБЕЛЕЖКИ НА АВТОРА
Адрес за заявки за повторно отпечатване: Д. Б. Хаусман, катедра „Храни и хранене“, Унив. на Грузия, Атина, GA 30602.
- Коремното затлъстяване е силно свързано със сърдечно-съдови заболявания и неговите рискови фактори през
- Относно; Асоциация за превенция на затлъстяването на домашни любимци
- Оценявайки ИТМ, големината на талията е жизненоважна за предотвратяване на влошаване на затлъстяването АКТБ интернист
- Оценка на ИТМ и използване на диаграми за растеж - Фондация за детско затлъстяване
- Асоциация между диетични фактори и калциев оксалат и магнезиев амониев фосфат
