Той Ху
1 катедра по медицинска микробиология, 2 катедра по физиология и 3 катедра по инсулт и съдови заболявания, изследователски център за болница "Св. Бонифаций", Университет в Манитоба, Уинипег, Манитоба, Канада
Грант Н. Пиърс
1 Катедра по медицинска микробиология, 2 катедра по физиология и 3 катедра по инсулт и съдови заболявания, Изследователски център за болница "Св. Бонифаций", Университет в Манитоба, Уинипег, Манитоба, Канада R3E 0W3
Гуангминг Жонг
1 катедра по медицинска микробиология, 2 катедра по физиология и 3 катедра по инсулт и съдови заболявания, изследователски център за болница "Св. Бонифаций", Университет в Манитоба, Уинипег, Манитоба, Канада
Резюме
J. Clin. Инвестирам. 103: 747–753 (1999).
Въведение
Атеросклерозата е основната причина за миокарден и мозъчен инфаркт. Въпреки че са идентифицирани много рискови фактори за атеросклероза, етиологията на атеросклерозата все още не е ясна. Сред многото идентифицирани рискови фактори хиперлипидемията е най-честият и важен фактор (1). В допълнение, скорошни проучвания (2–4) представиха убедителни доказателства, предполагащи ролята на инфекцията с Chlamydia pneumoniae при атеросклерозата. Първо, разпространението на антитела срещу C. pneumoniae в кръвта на пациенти с атеросклероза е по-високо от това при контролните субекти (5, 6). Второ, проучвания от различни лаборатории съобщават за директно откриване на C. pneumoniae в артериите на пациенти с атеросклероза, но не и в контролните артерии, включително тези, увредени след сърдечна трансплантация (7-9). Трето, ин витро инфекцията на макрофаги с C. pneumoniae може да предизвика образуването на пяна-клетки (10). Все още обаче не е известно дали инфекцията с C. pneumoniae играе причинно-следствена роля при атеросклерозата и дали серумният холестерол допринася за атерогенните ефекти на C. pneumoniae.
Човешките инфекции с хламидии често се причиняват от щамове на два вида хламидии, C. trachomatis и C. pneumoniae. Човешките щамове на C. trachomatis причиняват различни очни и урогенитални инфекции, докато мишият щам на C. trachomatis причинява миши пневмония, която следователно е определена като агент за пневмонит на мишки (MoPn). C. pneumoniae е новоизолиран хламидиален вид от дихателните пътища на човека (11). Инфекцията с C. pneumoniae е често срещана и приблизително 50% от възрастните по света имат антитела срещу C. pneumoniae (12). Въпреки че наскоро респираторните инфекции при хора с C. pneumoniae напоследък са свързани с атеросклероза, очните и урогениталните инфекции с C. trachomatis не са показани в нито една сърдечно-съдова патогенеза. Ще бъде интересно да се сравнят ефектите на тези две хламидиални инфекции върху развитието на атеросклероза, тъй като такова сравнение ще улесни разбирането на точните роли на C. pneumoniae инфекцията при атеросклерозата.
Методи
Организми.
Организмите на щама C. pneumoniae AR39 (Washington Research Foundation, Сиатъл, Вашингтон, САЩ) са отгледани в клетки Hep-2 (24), а мишият щам C. trachomatis MoPn е отгледан в клетки HeLa, както е описано по-горе (25, 26) . Живите организми се пречистват, аликвотират в буфер захароза-фосфат-глутаминова киселина (pH 7,4) и се съхраняват при –80 ° C, докато се използват за инокулация на мишки.
Експериментален дизайн.
Морфометрично определяне на атеросклероза.
Напречни сечения и хистология.
Оцветяване с хламидиален антиген.
Някои разрези на аортната дъга бяха подложени на оцветяване с хламидиален антиген. След проникване на ацетон и третиране с 0,2% H2O2 за гасене на ендогенната пероксидаза, срезовете бяха оцветени с моноклонално антитяло срещу хламидиален LPS (EV1-H1, миши IgG2a; любезно предоставено от H. Caldwell от Rocky Mountain Laboratories, Национален институт по здравеопазване, Hamilton, Montana, USA; ref. 27) и специфично за C. pneumoniae антитяло (D1E8, миши IgG1; нашите непубликувани данни). Първичното свързване с антитела се изследва с кози антимиши IgG, конюгиран с хрянова пероксидаза (Cedarlane Laboratories Ltd., Hornby, Онтарио, Канада). За визуализиране на свързването на антителата е използван неразтворим 4-хлоро-1-нафтолов субстрат (Sigma Chemical Co., St. Louis, Missouri, USA). Съседните серийни участъци от пробите, оцветени положително за хламидиални антигени с току-що описаните антитела, бяха използвани за оцветяване с контролен изотип. Всички оцветени проби са заснети под микроскоп Zeiss (Thornwood, Ню Йорк, САЩ), оборудван с камера с диференциално смущение с контрастно охлаждане, използвайки обективи от 20 × или 63 ×.
Анализ на серумен липопротеин.
Кръв се събира от всяка мишка преди аортна перфузия. Серумите са използвани както за титруване на антихламидиални антитела, така и за анализ на липидите. Общият серумен холестерол, триацилглицерол и липопротеин с висока плътност (HDL) се измерват с Hitachi 917 система за анализ (Boehringer Mannheim Canada, Laval, Quebec, Canada) чрез услуга от Катедрата по клинична биохимия, здравен научен център (Winnipeg, Манитоба, Канада). Липопротеинът с ниска плътност (LDL) се изчислява, както следва: LDL концентрация (mmol/l) = общ холестерол - (HDL + триацилглицерол × 0,46).
Титруване на специфични за хламидийния антиген антитела в миши серуми.
Миши серумни антитела се измерват, използвайки C. pneumoniae AR39 или C. trachomatis MoPn, заразени с HeLa клетки, заразени с организъм като антигени в имуноцитохимичен анализ. Заразените с хламидия HeLa клетки се оставят да се прикрепят към 96-ямкови плаки за тъканна култура и прикрепените монослоеве се фиксират с 4% параформалдехид (Sigma Chemical Co.), последвано от проникване с 0.5% сапонин (Sigma Chemical Co.). Антисеруми, серийно разредени в PBS, се прилагат върху заразените HeLa-клетъчни монослоеве. Първото свързване с антитела беше открито с кози антимиши IgG, конюгиран с хрянова пероксидаза и неразтворим 4-хлоро-1-нафтолов субстрат. Най-високото разреждане на даден серум, което все още може да разкрие очевидни тела на хламидиално включване, беше определено като титър на този серум. Имуноцитохимичният анализ е широко използван за откриване на хламидиални антигени (4), а титрите на антителата, получени с помощта на този анализ, са възпроизведени с помощта на стандартния ELISA (25).
Статистически анализ.
За анализ на разликите между различните животински групи е използван t-тестът на Student (несдвоен).
Резултати
Индукция на аортна атеросклероза при LDLR KO мишки с диета с висок холестерол.
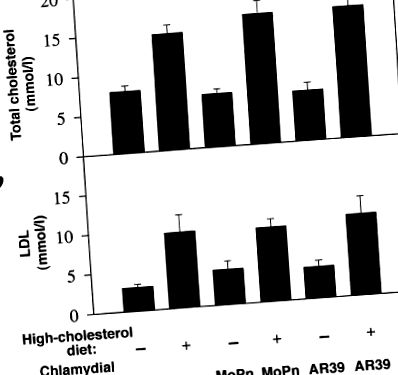
След лечение за период от девет месеца, общото ниво на серумен холестерол от 5–8 mmol/l е установено при LDLR KO мишки, хранени с обикновена миша чау, докато мишките, хранени с 2% добавена с холестерол диета, показват увеличение от два до три пъти в общото ниво на серумен холестерол (фиг. (фиг. 1 а). Общият холестерол се състои предимно от LDL (фиг. (фиг. 1 б и данни не са показани), което е в съответствие с предишни наблюдения (15) Хламидиалната инфекция с щамовете C. pneumoniae AR39 или щамовете MoPn на C. trachomatis не променя нито общия холестерол, нито нивата на LDL в серума. Увеличението на нивото на серумния холестерол изглежда корелира с развитието на аортна атеросклеротична лезия (Фиг. (Фиг. .2). 2). Всички мишки, хранени с обикновена мишка, показват почти нормална аортна луминална повърхност (фиг. (Фиг. 2, 2, панел а) и нормална структура на аортната стена на напречни сечения (фиг. (Фиг. .2, 2, панел ж). Въпреки това, след като са били хранени с диета с висок холестерол в продължение на девет месеца, всички мишки се развиват d типични атеросклерозни лезии в зоните на аортната дъга и сънните артерии (фиг. (Фиг. 2, 2, панел б). Анализът на напречното сечение разкрива, че тези лезии са предимно мастни ивици без очевидна фиброзна капачка (фиг. (Фиг. 2 2, панел h), което е в съответствие с предишни наблюдения (16).
Общ холестерол (а) и липопротеин с ниска плътност (б) нива (показани в средно ± SE по оста y) в серумите на LDLR KO мишки като функция от добавяне на диетичен холестерол и инфекция с двата различни щама на хламидия (по оста x). Независимо от хламидиалната инфекция, мишките, хранени с диета с висок холестерол (само диета с висок холестерол [n = 7] или плюс инфекция с MoPn [n = 4] или AR39 [n = 7]), показват два до три пъти по-висок серумен общ холестерол (а) или нива на липопротеин с ниска плътност (b), отколкото мишките, хранени с обикновена миша чау (нормална храна без [n = 7] или с MoPn [n = 4] или AR39 [n = 7] инфекция). LDLR-KO, нокаут за липопротеинови рецептори с ниска плътност.
Представителни изображения на луминална повърхност на аортната мишка (отгоре) и напречни сечения на аортната дъга (отдолу) след оцветяване с хематоксилин и еозин. Aorta от шест групи мишки бяха изолирани за наблюдение на луминална повърхностна лезия без предварително оцветяване (панели a – f). Показана е луминалната повърхност на всяка цяла аорта от дъгата на аортата (вляво) до бифуркацията (вдясно). Светлите атеросклеротични лезии бяха лесно забележими при аорта от мишки, хранени с диета с високо съдържание на холестерол (панели b, d и f), но не и при мишки, хранени с нормална хранителна диета (панели a, c и e) . Някои от лезиите бяха допълнително оцветени със суданско червено за проверка на липидното съдържание (данните не са показани) след получаване на изображенията. Частите на аортната дъга от току-що описаните проби бяха използвани за направа на разрези за оцветяване с хематоксилин и еозин (панели g -1) за оценка на тежестта на лезията. Снимките са направени с микроскоп Zeiss с помощта на 20 × обектив.
Както AR39, така и MoPn антигените са открити в аортата на мишки, заразени интраназално със съответните хламидиални щамове.
Представителни изображения на хламидиален антиген, открити в аортни сечения, получени от мишки, хранени с нормална хранителна диета (а-° С) или мишки, хранени с диета с висок холестерол (д-е). Напречните сечения бяха оцветени с антихламидиално LPS моноклонално антитяло и оцветяването беше разкрито чрез имунохистохимия, както е описано в Методи. Изображения a и d са от мишки без хламидиална инфекция; b и e са от мишки, заразени с MoPn; и c andf са от мишки, заразени с AR39. Изображения a – f са получени с помощта на 20-кратен обектив. Изображенията g – i са получени под обектив с размери 63 ×, съответно от вградените области в изображения d – f. Очевидно включване на подобни на тялото структури се наблюдават ясно на изображения h и i.
Титруване на серумни антитела срещу хламидиален MoPn (а) и AR39 (б) организми при мишки, хранени с нормална или допълнена с холестерол диета със или без хламидиална инфекция, както е посочено в долната част на фигурата и е описано на фиг. Фиг. 1 1 легенда.
Дискусия
В заключение, резултатите от това проучване не само демонстрираха, че инфекцията с C. pneumoniae може директно да стимулира атерогенезата, но и, което е по-важно, предоставиха нова информация относно механизмите на хламидийното участие при съдови заболявания. Хламидиалните атерогенни ефекти зависят от наличието на повишен серумен холестерол. Нашите резултати освен това предполагат, че не всички инфекциозни агенти, открити в лезиите на съдовете, са допринесли за напредването на лезиите и че C. pneumoniae може да притежава уникално биологично свойство за своята атерогенеза. Една потенциална слабост на това проучване, която може да ограничи нашите заключения, е малкият размер на извадката, използван за относително дълъг експериментален период. При такива експерименти е възможна променливост на резултатите. Констатациите трябва да се считат за предварителни по своя характер, но представляват достатъчен интерес, за да стимулират по-нататъшно проучване на тази тема, използвайки този и други модели.
Благодарности
Благодарим на Уейн Фостър за съдействието при придобиването на дигитализирани изображения и на Dongji Zhang за съдействието при мишна интраназална инокулация по време на началния етап на проучването. Тази работа беше подкрепена от безвъзмездни средства от Фондация „Сърце и инсулт“ в Манитоба и от Съвета за медицински изследвания на Канада. G. Zhong е стипендиант на Съвета за медицински изследвания на Канада.
- Ефектите на холестерола върху тялото
- Механизмът на диетичните ефекти на холестерола върху метаболизма на липидите при плъхове Липиди в здравето и
- Хранителната среда, нейните ефекти върху диетичната консумация и потенциал за измерване вътре
- Помислете за това Когнитивните ефекти на съдовата болест - Американски колеж по кардиология
- Тази шоколадова торта може да ви помогне да намалите холестерола си ябълки и боб