Резюме
Централната невронна регулация на храненето и автономния отток не винаги са паралелни в енергийната хомеостаза и дисфункцията на автономните невронни вериги, а не поведението на хранене, може да бъде основен причинителен фактор за затлъстяването.
Повече от половината от мъжете и жените в САЩ на 20 и повече години сега се считат за наднормено тегло и почти една четвърт са клинично затлъстели. Експертите спорят дали всеки с наднормено тегло трябва да свали излишните килограми, за да запази здравето си. Тъй като в повечето случаи затлъстяването е свързано с преяждане, много изследвания са фокусирани върху централните невронни механизми на хранителното поведение. Затлъстяването е резултат от увеличен енергиен прием и намален енергиен разход. Централната нервна система (ЦНС) регулира енергийната хомеостаза и телесното тегло чрез регулиране на приема на храна, а също и от автономната нервна система.
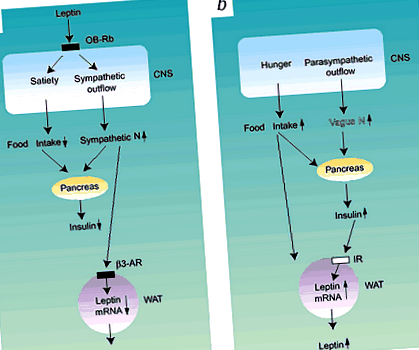
Лептинът е хормон, участващ в регулирането на ЦНС на приема на храна и автономния отток. Продуктът на LEP ген (известен също като ob), лептинът се експресира в бяла мастна тъкан и на по-ниски нива, в стомашен епител и плацента 1. От неотдавнашното му откритие, лептинът се предлага да сигнализира на ЦНС за намаляване на приема на храна (фиг. 1), увеличаване на симпатиковия отток и увеличаване на енергийните разходи, което води до загуба на тегло (катаболни ефекти). Нарушенията на секрецията на лептин и сигнализирането причиняват повишен прием на храна (фиг. 1), парасимпатиков отток и съхранение на енергия и водят до наддаване на тегло (анаболни ефекти). Следователно недостатъчната секреция на лептин и резистентността към лептин могат да бъдат включени в основната патогенеза на затлъстяването 1,2 .
а, лептинът увеличава симпатиковата нервна активност, която инхибира секрецията на инсулин и лептин (автономни вериги) и инхибира храненето (хранителни вериги). b, Увеличеният прием на храна и активността на вагусния нерв стимулират секрецията на инсулин на панкреаса, което може да доведе до увеличаване на експресията и секрецията на лептин от бялата мастна тъкан. ЦНС, централна нервна система; N, нервна система; OB-Rb, лептинов рецептор b; IR, инсулинов рецептор; β3-AR, β3-адренергичен рецептор, WAT, бяла мастна тъкан.
Лептиновият рецептор (LEPR) се изразява в области на хипоталамуса, участващи в регулирането на енергийния метаболизъм 1,2. Въпреки че взаимосвързаните пътища, които медиират действието на лептин в ЦНС, са сложни, тази идея за включване и изключване на регулацията на енергийния метаболизъм в ЦНС вероятно е в съответствие с класическите теории за нервната регулация на енергийния баланс: активирането на центъра за ситост на хипоталамуса намалява храната прием и увеличава симпатиковия нервен отток, което води до катаболни ефекти, докато активирането на центъра на глада увеличава приема на храна и парасимпатиковия нервен отток, което води до анаболни ефекти 3,4 (фиг. 1). Централните нервни механизми, регулиращи храненето и функцията на автономната нервна система, се появяват паралелно. Въпреки това, въпреки преяждането, някои хора могат да поддържат нормално телесно тегло или дори да намалят телесното тегло, което показва, че промените в поведението при хранене не винаги корелират с промени в телесното тегло и други фактори, различни от поведението на хранене, могат да бъдат включени в регулирането на телесното тегло. И така, предава ли ЦНС сигнали за прием на храна и стимулация на автономната нервна система по подобен начин?
Циркулиращият лептин сигнализира на ЦНС първо бързо да увеличи симпатиковия отток и след това да инхибира приема на храна 5 (фиг. 1а). Симпатиковата нервна система увеличава липолизата, термогенезата и енергийните разходи, докато потиска панкреатичната секреция на инсулин 4 и експресията на лептин в бяла мастна тъкан чрез β3 адренергичния рецептор 6 (Фиг. 1а). По този начин съществува система за отрицателна обратна връзка между стимулацията на симпатиковата нервна система и производството на лептин (Фиг. 1а). Мишки (ob/ob), при които лептиновият ген е бил нарушен, а мишки (db/db) и плъхове (fa/fa) с генетични нарушения на сигнала за лептинов рецептор показват хиперфагия, хиперинсулинемия и намален симпатиков отток, което води до затлъстяване в началото на живота 1,2,3 .
Регулирането на инсулина също е важно за контролиране на телесното тегло. Инсулинът, секретиран от β клетките на панкреатичните островни острови в отговор на приема на храна, увеличава транспортирането на горива като глюкоза и триглицериди в мастните клетки. Състоянията с недостатъчен инсулин вероятно ще намалят употребата на вътреклетъчно гориво, което води до намаляване на мастната маса. Следователно намалената секреция на инсулин при диабет тип 1 и тежък диабет тип 2 води до загуба на тегло, въпреки хиперфагията. В модела на стрептозотозин на диабет тип 1, при който β-клетките, секретиращи инсулин, се наблюдава загуба на тегло въпреки хиперфагията, свързана с намалени нива на лептин в плазмата и повишена експресия на невропептид Y, орексигенен пептид в хипоталамуса 10,11. Това е за разлика от ob/ob мишките, които имат хиперинсулинемия и затлъстяване, свързани с хиперфагия, намалени нива на лептин в плазмата и повишена експресия на невропептид Y иРНК в хипоталамуса 1,2,3. Следователно хиперфагията и ниските нива на плазмен лептин не винаги са свързани с увеличаване на телесното тегло.
В допълнение към регулирането на приема на храна, автономната нервна система е важна за регулирането на производството на инсулин от β клетки на панкреаса. Панкреасът се инервира от симпатикови и парасимпатикови неврони, а увеличеният парасимпатиков отток към панкреаса (медииран от блуждаещия нерв) стимулира секрецията на инсулин чрез мускаринови ацетилхолинови рецептори 3,4,9 (фиг. 1)б). Хиперинсулинемията, медиирана от повишена активност на вагусния нерв, а не от хиперфагия, може да бъде основната причина за затлъстяване, предизвикано от електрически лезии на вентромедиалния хипоталамус, хронична интрацеребровентрикуларна инжекция на невропептид Y, а също и при плъхове fa/fa и ob/ob мишки 3, 12 . Нормалните нива на базовия плазмен инсулин и телесното тегло на хиперфагични млади мишки с дефицит на 5-НТ2с рецептор показват, че тяхната хиперфагия възниква без нервна стимулация на секрецията на инсулин 8. Късната хиперинсулинемия при затлъстели мишки с дефицит на 5-НТ2с рецептор е вторична последица от мутацията 8. Тези открития показват, че панкреатичната секреция на инсулин, стимулирана от блуждаещия нерв, играе важна, но сложна роля в развитието на затлъстяването.
Адипоцитите експресират адренергични рецептори и следователно се влияят от симпатиковата стимулация, но не и от парасимпатиковата система. Въпреки това, ефектите на парасимпатиковата нервна система върху метаболизма на мазнините могат да бъдат медиирани от инсулин, който оказва анаболен ефект върху енергийния метаболизъм (фиг. б). Инсулинът също така служи за увеличаване на експресията и секрецията на лептин от бяла мастна тъкан 13,14,15. Тогава лептинът увеличава симпатиковия отток и енергийните разходи.
По този начин, в допълнение към добре проучените молекули, участващи в регулирането на приема на храна и енергийния метаболизъм, автономните невронни вериги също трябва да функционират правилно, за да може увеличеният енергиен прием да бъде компенсиран от увеличения енергиен разход. Дисфункцията на автономните невронни вериги трябва да се разглежда в допълнение към поведението на хранене като основна причина за медиирано от ЦНС затлъстяване.
Препратки
Friedman, J. M. & Halaas, J. L. Leptin и регулирането на телесното тегло при бозайници. Природата 395, 763–770 (1998).
Elimquist, J.K., Maratos-Flier, E., Saper C.B. & Flier, J.S. Разкриване на пътищата на централната нервна система, залегнали в основата на отговорите на лептина. Nature Neurosci. 1, 445–450 (1998).
Брей, Г.А. & Йорк, Д.А. Хипоталамусно и генетично затлъстяване при опитни животни: автономна и ендокринна хипотеза. Физиол. Преп. 59, 791–809 (1979).
Shimazu, T. Невронна регулация на метаболизма на чернодробната глюкоза при бозайници. Диабет Metab. Преп. 3, 185–206 (1987).
Колинс, S. и др. Роля на лептина в регулирането на мазнините. Природата 380, 677 (1996).
Mantzoros, C.S., и др. Активирането на β3 адренергичните рецептори потиска експресията на лептин и медиира независим от лептин инхибиране на приема на храна при мишки. Диабет 45, 909–914 (1996).
Кързън, Г., Гибсън, Е. Л. & Qluyomi, A.Q. Потискането на апетита от често използвани лекарства зависи от 5-НТ рецепторите, но не и от наличността на 5-НТ. Тенденции Pharmacol. Sci. 18., 21–25 (1997).
Ноногаки, К., Страк, А. М., Далман, М. Ф. & Tecott, L. H. Независима от лептин хиперфагия и диабет тип 2 при мишки с мутирал серотонинов 5-НТ2с рецепторен ген. Nature Med. 4, 1152–1156 (1998).
Nonogaki, K. & Iguchi, A. Стрес, остра хипергликемия и хиперлипидемия: роля на автономната нервна система и цитокини. Тенденции Endocr. Metab. 8, 192–197 (1997).
Хавел, П. Дж. и др. Отбелязано и бързо намаляване на циркулиращия лептин при стрептозотоцинови диабетични плъхове: обръщане от инсулин. Am. J. Physiol. 274, R1482 – R1491 (1998).
Малабу, САЩ. и др. Ефекти от хроничното приложение на ванадат при индуциран от STZ диабет. Диабет 43, 9–15 (1994).
Sainsbury, A. и др. Хронична инфузия на централен невропептид Y при нормални плъхове: състояние на хипоталамо-хипофизарно-надбъбречната ос и вагусно медиация на хиперинсулинемия. Диабетология 40, 1269–1277 (1997).
Саладин, Р. и др. Преходно увеличение на експресията на затлъстели гени след прием на храна или приложение на инсулин. Природата 377, 527–529 (1995).
Biden, G., Chen, X., Kolaczynski, J.W. & Polansky, М. Ефекти от продължителната хиперинсулинемия върху серумния лептин при нормални хора. J. Clin. Инвестирам. 100, 1107–1113 (1997).
Barr, V.A. и др. Инсулинът стимулира както секрецията на лептин, така и производството му от бяла мастна тъкан на плъхове. Ендокринология 138, 4463–4472 (1997).
Информация за автора
Принадлежности
Център за невробиология и психиатрия на Калифорнийския университет по психиатрия в Сан Франциско, 401 Parnassus Avenue, Сан Франциско, 94143-0984, Калифорния, САЩ
Можете също да търсите този автор в PubMed Google Scholar
- Затлъстяване и генетика - Природа - Подхранване - Асоциация по медицина на затлъстяването Основна
- Стрес, диета и коремно затлъстяване Y Nature Medicine
- Сънна апнея и затлъстяване - Асоциация по медицина на затлъстяването Основна
- Нов доклад на CDC за лоши и добри новини за затлъстяването Stony Brook Medicine
- И така, какво все пак е специалист по медицина при затлъстяване Bariatric Times