Майкъл Фукс
Отделение по гастроентерология, хепатология и хранене, Катедра по вътрешни болести, Медицински факултет на Университета на Вирджиния, П.О. Box 980341, Richmond, VA 23298-0341, САЩ
Резюме
В момента безалкохолната мастна чернодробна болест (NAFLD) се развива като най-често срещаното чернодробно заболяване в световен мащаб. Той може да прогресира до чернодробна цироза и рак на черния дроб и е готов да представлява най-честата индикация за чернодробна трансплантация в близко бъдеще. Патогенезата на NAFLD е многофакторна и не е напълно изяснена, но представлява състояние на инсулинова резистентност, характеризиращо се с клъстер от сърдечно-съдови рискови фактори, включително затлъстяване, дислипидемия, хипергликемия и хипертония. Важно е, че NAFLD също се е развил като независим рисков фактор за сърдечно-съдови заболявания. За съжаление досега не съществува установено лечение за NAFLD. Доказано е, че активираният с жлъчна киселина ядрен фарнезоиден X рецептор (FXR) играе роля не само в жлъчната киселина, но и в липидната и глюкозната хомеостаза. Специфичното насочване на FXR може да бъде елегантен и много ефективен начин за пренастройка на нерегулирани метаболитни пътища, медиирани от ядрен рецептор. Този преглед обсъжда сложната реакция на организма към активирането на FXR с неговите полезни действия, но също така и потенциални нежелани странични ефекти.
1. Въведение
Една характеристика на съвременната ни цивилизация е лесният и неограничен достъп до нездравословна и калорична плътна храна. Типична американска диета снабдява черния дроб с
20 g мазнини всеки ден, което се равнява на половината от общото съдържание на триглицериди в черния дроб. В комбинация с малка нужда от физическа активност поради технологичния напредък, една от последиците от нашия заседнал и прекомерен начин на живот е безалкохолната мастна чернодробна болест (NAFLD).
NAFLD е основен здравен проблем, който засяга до 60 милиона американци и се развива като най-често срещаното чернодробно заболяване в световен мащаб [1, 2]. Това е няколко пъти по-високо от другите често срещани хронични чернодробни заболявания като хепатит С и свързано с алкохола чернодробно заболяване. Докато по-голямата част от пациентите с NAFLD са със затлъстяване, състоянието може да възникне при липса на затлъстяване или други характеристики на метаболитния синдром. При пациенти с диабет и болестно затлъстяване е установено, че разпространението на NAFLD достига съответно 62% и 96% [3, 4].
Най-ранният стадий на NAFLD е мастният черен дроб, който се определя като наличие на цитоплазмени капчици триглицериди в повече от 5% от хепатоцитите [5]. Въпреки че често се самоограничава, при 12–40% може да прогресира до неалкохолен стеатохепатит (NASH) [6]. NASH се отличава от обикновения мастен черен дроб по наличието на увреждане на хепатоцитите, като балониране и апоптоза на хепатоцити, възпалителен инфилтрат и/или отлагане на колаген. За период от 10-15 години 15% от пациентите с NASH ще прогресират до чернодробна цироза [7]. След като цирозата се развие при липса на вирусен хепатит, чернодробната декомпенсация настъпва със скорост от 4% годишно, докато десетгодишният риск от развитие на рак на черния дроб е 10% [7, 8]. Въпреки че ракът на черния дроб, вторичен за NASH, обикновено се развива в условията на цироза, канцерогенезата може да възникне при липса на напреднало чернодробно заболяване. Поради това не е изненадващо, че NAFLD е готов да се превърне в основна индикация за чернодробни трансплантации. Подобно на други причини за хронично чернодробно заболяване, NASH се повтаря след чернодробна трансплантация почти универсално [9].
2. Основни патофизиологични концепции и лечение на NAFLD
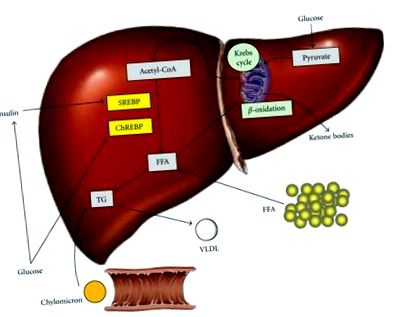
Образуване, придобиване и отстраняване на чернодробни триглицериди (TG). Мастният черен дроб е резултат от дисбаланс между свободните мастни киселини (FFA) и TG входа и FFA и TG изхода. FFA произлиза от периферна тъкан, ендогенен синтез или диета под формата на хиломикрони. Приемът на въглехидрати повишава нивата на глюкоза и инсулин, като по този начин насърчава липогенезата чрез активиране на транскрипционни фактори стерол регулаторен елемент, свързващ протеин 1c (SREBP) и реагиращ на въглехидрати елемент, свързващ протеин (ChREBP). Намаляването на тежестта на FFA включва β-окисление в митохондриите, съхранение като TG или износ като липопротеин с много ниска плътност (VLDL).
Лечението на NAFLD трябва или да предотврати прогресирането на заболяването до чернодробна цироза, или да обърне вече установения NASH, съответно. Въпреки многото постижения в нашето разбиране за патогенезата на NAFLD, понастоящем няма налично установено лечение. Промените в начина на живот и упражненията за намаляване на телесното тегло и лечението на съпътстващ диабет и дислипидемия се приемат като терапия от първа линия, но не е доказано, че убедително намалява риска от прогресиране на заболяването [16]. Следователно проучването на нови пътища за лечение на тази често срещана болест е от решаващо значение.
3. Активираният с жлъчна киселина ядрен рецептор Farnesoid X (FXR)
Ядрените рецептори са група транскрипционни фактори, които се състоят от 48 члена при хората. Те имат обща структура, състояща се от лиганд-независим активиращ домен за взаимодействие с кофактори, централен ДНК свързващ домен и уникален свързващ домен на лиганд, позволяващ димеризация на рецептора и взаимодействия на корегулатора. Повечето ядрени рецептори функционират или като хомодимери, или като хетеродимери с ретиноидния X рецептор. Свързването на лиганда насърчава конформационни промени, улесняващи освобождаването на корепресори и водещи до конформационни промени на хроматина, позволяващи достъп на транскрипционната машина до съответните промотори. При активиране на лиганда, корепресорният комплекс се дисоциира и коактиваторният комплекс се набира, което позволява стартиране на транскрипцията. Счита се, че контролът на ядрената транскрипционна активност се осъществява и чрез посттранслационни модификации [17–19].
През 1995 г. е открит протеин, който взаимодейства с човешкия ретиноеиден X рецептор и е наречен протеин 14, взаимодействащ с ретиноевия X рецептор [20]. Тъй като той се активира от междинен продукт на мевалонатния път, фарнезол, той е преименуван на фарнезоиден X рецептор [21]. Още четири години по-късно три независими групи [22–24] откриха жлъчните киселини като ендогенни лиганди за FXR. От еволюционна гледна точка FXR генът е силно запазен, което предполага, че играе важна роля при много видове. На тъканно ниво FXR се експресира предимно в черния дроб, червата, бъбреците и надбъбречната жлеза. Експресията в сърдечната и мастната тъкан е ниска [25]. Поколението на мишки с аблация на гена Fxr идентифицира FXR като главен регулатор в хомеостазата на жлъчните киселини [26]. Впоследствие са идентифицирани нови функции на FXR, включително защита на чревната бариера и модулиране на вродения имунитет [27, 28] и туморогенезата [29, 30]. Най-важните роли на FXR вероятно са в регулирането на метаболитните процеси.
4. FXR като ключов играч в множество метаболитни процеси
Дълго време физиологичните ефекти на жлъчните киселини се дължат главно на техните физикохимични свойства [31]. През последните няколко години беше очевидно, че жлъчните киселини действат като сигнални молекули [32], регулирайки не само собствената си хомеостаза по време на ентерохепаталната циркулация, но и метаболизма на триглицеридите, холестерола и глюкозата.
4.1. Метаболизъм на жлъчните киселини
Основна физиологична роля на FXR в метаболизма на жлъчните киселини е да предпазва хепатоцитите от вредните ефекти на повишените нива на жлъчните киселини чрез инхибиране на ендогенния синтез на жлъчна киселина и ускоряване на биотрансформацията и екскрецията на жлъчните киселини. В тази връзка, медиираните от FXR ефекти се появяват по строго координиран начин на нивото на хепатоцитите и ентероцитите и са разгледани подробно другаде [33].
4.2. Триглицерид и метаболизъм на холестерола
От години е известно, че жлъчните киселини могат да модулират липидния метаболизъм при хората. Намаляването на трансхепаталния поток на жлъчните киселини намалява холестерола на липопротеините с ниска плътност и увеличава нивата на липопротеините с висока плътност и нивата на триглицеридите на липопротеините с много ниска плътност. Противоположни ефекти се наблюдават при разширяване на пула на жлъчните киселини [34–36]. Проучвания при мишки с Fxr генна аблация или прилагане на FXR агонисти предоставиха ключова информация, демонстрираща централната роля на FXR в липидната хомеостаза.
4.3. Глюкозна хомеостаза
4.4. Чернодробно възпаление и фиброгенеза
Възпалението и отлагането на колаген в черния дроб са ключови хистопатологични характеристики на NASH. FXR изглежда антагонизира чернодробните възпалителни процеси чрез антагонизиране на пътя на ядрения фактор каппа В [64]. Друг защитен FXR механизъм включва индукция на антимикробни фактори в червата [65]. Тъй като FXR се експресира в чернодробни звездни клетки на гризачи, които играят критична роля в чернодробната фиброза, не е изненадващо, че FXR агонистите предпазват от чернодробна фиброза [66]. Изглежда, че това се медиира от намалена чернодробна експресия на различни профибротични растежни фактори, включително трансформиращ растежен фактор β1, тъканен инхибитор на металопротеиназа 1, α1 (I) колаген, α гладкомускулен актин, матрична металопротеиназа 2 и α2 (I) колаген и микроРНК -29а [67–69]. Ако обаче този механизъм работи и при хора с по-ниско ниво на експресия на FXR, остава да се определи [70]. Тези данни предполагат, че насочването на FXR може да повлияе на прогресията от NAFLD към NASH.
5. FXR и атеросклероза
Про- и антиатерогенни ефекти на FXR активирането. По отношение на атеросклерозата, активирането на FXR може да бъде свързано с полезни и потенциални отрицателни ефекти. Освен ако не е тестван върху хора, не може да се предскаже със сигурност дали про- или антиатерогенните ефекти са доминиращи и развитието на специфични FXR модулатори може да помогне да се избегнат някои или повечето от негативните ефекти. VCAM: протеин за адхезия на съдови клетки. ICAM: вътреклетъчна адхезионна молекула.
6. Резюме и перспектива
FXR играе ключова роля в контрола на транскрипцията на безброй целеви гени, които контролират метаболитните пътища, свързани с NAFLD. По силата на тази роля FXR участва критично в развитието и напредъка на NAFLD. Следователно насочването към FXR предлага нови вълнуващи перспективи за лечение на NAFLD. Въпреки това, когато се тълкуват данните, получени в клетъчни култури и модели на гризачи на човешки заболявания, трябва да се обърне внимание на разликите между тези модели и хората. Едно особено предизвикателство при проектирането на FXR агонисти е разделянето на желаните терапевтични ефекти от нежеланите странични ефекти. Дизайнът на специфични за органи или гени FXR лиганди може да повиши специфичността и да намали страничните ефекти на този терапевтичен подход. По-доброто разбиране на ефекта от клетъчната сигнализация на FXR и неговите протеини на корегулатора има потенциала да помогне при откриването на нови селективни терапевтични модулатори и разработването на нови и по-ефективни терапевтични средства. И накрая, също така трябва да се има предвид, че отговорът на модулацията на FXR рецептора може да се различава при пациентите с NAFLD и NASH.
- Продължителното хранене с високо съдържание на мазнини насърчава безалкохолната мастна чернодробна болест и променя червата
- Ролята на храненето в патогенезата и профилактиката на безалкохолни мастни чернодробни заболявания
- Ролята на храненето в патогенезата и профилактиката на безалкохолни мастни чернодробни заболявания
- Интервенция за физическа активност за пациенти без диабет с безалкохолно мастно чернодробно заболяване a
- Безалкохолна мастна чернодробна болест - храна; Списание за хранене