Saeed Katiraei
1 Катедра по човешка генетика, Медицински център на Университета в Лайден, Лайден, Холандия
2 Лаборатория за експериментална съдова медицина в Айнтховен, Медицински център на Университета в Лайден, Лайден, Холандия
Лиза Р. Ховинг
1 Катедра по човешка генетика, Медицински център на Университета в Лайден, Лайден, Холандия
2 Лаборатория за експериментална съдова медицина в Айнтховен, Медицински център на Университета в Лайден, Лайден, Холандия
Лиан ван Бийк
1 Катедра по човешка генетика, Медицински център на Университета в Лайден, Лайден, Холандия
2 Лаборатория за експериментална съдова медицина в Айнтховен, Медицински център на Университета в Лайден, Лайден, Холандия
Шарида Мохамедхосейн
1 Катедра по човешка генетика, Медицински център на Университета в Лайден, Лайден, Холандия
2 Лаборатория за експериментална съдова медицина в Айнтховен, Медицински център на Университета в Лайден, Лайден, Холандия
Франсоаз Карлоти
2 Лаборатория за експериментална съдова медицина в Айнтховен, Медицински център на Университета в Лайден, Лайден, Холандия
3 Катедра по медицина, отдел по нефрология Университетски медицински център в Лайден, Лайден, Холандия
Janna A. van Diepen
4 Катедра по вътрешни болести, Radboud UMC, Неймеген, Холандия
Патрик С. Н. Ренсен
2 Лаборатория за експериментална съдова медицина в Айнтховен, Медицински център на Университета в Лайден, Лайден, Холандия
5 Катедра по медицина, отдел по ендокринология Лайденски университетски медицински център, Лайден, Холандия
Михай Г. Нетеа
4 Катедра по вътрешни болести, Radboud UMC, Неймеген, Холандия
Ко Вилемс ван Дейк
1 Катедра по човешка генетика, Медицински център на Университета в Лайден, Лайден, Холандия
2 Лаборатория за експериментална съдова медицина в Айнтховен, Медицински център на Университета в Лайден, Лайден, Холандия
5 Катедра по медицина, отдел по ендокринология Лайденски университетски медицински център, Лайден, Холандия
Джими Ф. П. Берби
2 Лаборатория за експериментална съдова медицина в Айнтховен, Медицински център на Университета в Лайден, Лайден, Холандия
5 Катедра по медицина, отдел по ендокринология Лайденски университетски медицински център, Лайден, Холандия
Ванеса ван Хармелен
1 Катедра по човешка генетика, Медицински център на Университета в Лайден, Лайден, Холандия
2 Лаборатория за експериментална съдова медицина в Айнтховен, Медицински център на Университета в Лайден, Лайден, Холандия
Концептуализация: SK PCNR KWvD MGN JAvD FC JFPB VvH.
Официален анализ: SK LvB SM VvH.
Разследване: SK LRH LvB SM JAvD JFPB VvH.
Надзор: SK PCNR KWvD MGN JAvD FC JFPB VvH.
Писане - оригинален проект: SK KWvD JFPB VvH.
Писане - преглед и редактиране: LRH PCNR MGN JAvD FC.
Свързани данни
Данните са налични в хранилището за данни figshare на https://doi.org/10.6084/m9.figshare.4876574.v1.
Резюме
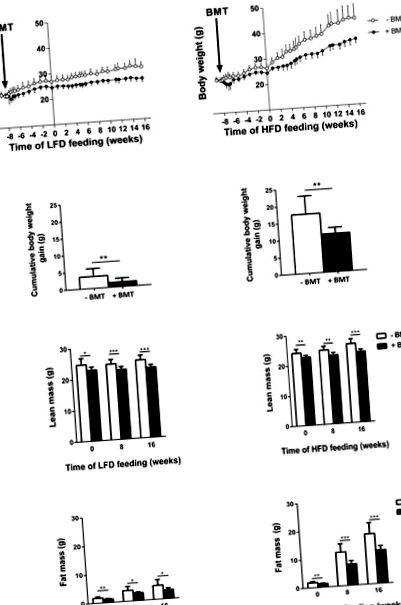
Експерименталната трансплантация на костен мозък (BMT) при мишки обикновено се използва за оценка на ролята на специфичните за имунните клетки гени в различни патофизиологични условия. Прилагането на BMT при изследване на затлъстяването е затруднено от значителното намаляване на затлъстяването, предизвикано от диета с високо съдържание на мазнини. Поставихме за цел да характеризираме метаболитните тъкани, които могат да бъдат засегнати от процедурата за BMT и да влошат индуцирания от HFD отговор. Мъжки мишки C57BL/6 са подложени на сингенен BMT, използвайки смъртоносно облъчване. След период на възстановяване от 8 седмици те са били хранени с нискомаслена диета (LFD) или HFD в продължение на 16 седмици. Индуцираното от HFD затлъстяване е намалено при мишки след BMT в сравнение с контролни мишки, хранени с HFD, характеризиращи се както с намалена мазнина (-33%; p Фиг. 1А и 1В). След преминаването на диетата към LFD или HFD при t = 0 седмици, нарастването на телесното тегло се отклонява между лекувани с BMT и контролни мишки (Фиг. 1А и 1В). Това беше най-очевидно за мишки с BMF, хранени с HFD. Анализът на телесния състав чрез Echo-MRI показва намалена чиста маса (фиг. 1С) и мастна маса (фиг. 1D), както върху LFD, така и при HFD при мишки, третирани с BMT, в сравнение с контролите. Намаленото наддаване на телесно тегло обаче се дължи главно на намаленото разширяване на мастната маса, особено при мишките, лекувани с HFD, лекувани с BMT. Индивидуални измервания на непряка калориметрия, използващи метаболитни клетки, разкриват, че намаляването на наддаването на телесно тегло не може да бъде обяснено нито с намален прием на храна, нито с увеличен разход на енергия при лекувани с LFD или HFD мишки, лекувани с BMT. Няма разлика в окисляването на мазнини или окисляването на въглехидрати между третирани с BMT и контролни мишки (S1 Фиг.).
(A) BMT намалява теглото на черния дроб, тимуса, далака и панкреаса както на LFD, така и на HFD. (B) Линейният регресионен анализ на теглото на панкреаса и телесното тегло показва по-ниско тегло на панкреаса при лекувани с BMT мишки, независимо от телесното тегло. Стойностите са средни стойности ± SD; n = 7–12; * p Фиг. 5А). За да се изследва дали самият BMT също повлиява плазмените нива на глюкоза на гладно независимо от телесното тегло, беше направен анализ на линейна регресия върху нивата на глюкоза на гладно спрямо телесното тегло за лекувани с BMT и контролни мишки поотделно. Третираните с BMT мишки са склонни да имат по-висока концентрация на плазмена глюкоза на гладно със сходни телесни тегла (Фигура 5В: регресионни линии за сравнение: Fslopes = 0,065, p = NS, Fintercepts = 3,72; p = 0,06). Интересното е, че концентрацията на инсулин в плазмата на гладно е била само по-ниска при лекувани с BMT мишки, отколкото при контролите, когато са били хранени с HFD (-68%; p Фиг. 5C). Тези намалени концентрации на инсулин при мишки, лекувани с метаболизъм, лекувани с BMT, може да са резултат от по-ниско производство на инсулин и следователно са измервани плазмените нива на С-пептида на гладно. Всъщност BMT намалява плазмените нива на C-пептид на гладно в сравнение с контролите само при HFD-хранени мишки (-37%; p Фиг. 5D). Теглото на панкреаса положително корелира с нивата на С-пептида (R2 = 0,244; p Фиг. 5Е), което показва, че намаленият обем на панкреаса при BMT мишки е свързан с по-ниска секреция на инсулин. В съответствие с намалената секреция на инсулин, лекуваните с HFD мишки, лекувани с BMT, са по-непоносими към глюкоза по време на IVGTT, отколкото контролните мишки, което се отразява от увеличения полуживот на глюкозен клирънс (Фигура 5F).
(А) Плазмената глюкоза на гладно при лекувани с BMT и контролни мишки не се различава по отношение на LFD или HFD. (B) Лекуваните с BMT мишки са склонни да имат по-високи плазмени концентрации на гладно за сходно телесно тегло. (C) Третираните с BMT мишки са понижили нивата на плазмен инсулин на гладно само при HFD. (D) Третираните с BMT мишки са понижили плазмените концентрации на С-пептид върху HFD. (E) Съществува линейна връзка между теглото на панкреаса и плазмените концентрации на C-пептид на гладно. (F) IVGTT разкрива, че лекуваните с BMT мишки имат по-висок полуживот на плазмен глюкозен клирънс, само при HFD. Стойностите са средни стойности ± SD; n = 7–12; * p (35M, tif)
S2 Фиг
(А) Концентрацията на триглицериди във фекалиите не се различава между третирани с BMT и контролни мишки. (B) Има малко по-малко свободни мастни киселини в изпражненията на HFD, хранени с BMT-третирани мишки, в сравнение с контролната група.
- BMT намалява индуцираното от HFD наддаване на тегло, свързано с намален брой преадипоцити и инсулин
- Друг недостатък на напълняването на гъбички на ноктите на краката
- 4 съвета за подпомагане на възрастните хора да наддават на тегло
- Антидепресанти и наддаване на тегло
- Джок; s Диетични истории за увеличаване на теглото Фентъзи хранилка