Фей Ли
4 Фред Хътчинсън Център за изследване на рака, Сиатъл, WA 98109 и 5 Междудисциплинарни магистърски програми по хранителни науки, Университет във Вашингтон, Сиатъл, WA 98195
Мередит А. Дж. Хълар
4 Фред Хътчинсън Център за изследване на рака, Сиатъл, WA 98109 и 5 Междудисциплинарни магистърски програми по хранителни науки, Университет във Вашингтон, Сиатъл, WA 98195
Ивон Шварц
4 Фред Хътчинсън Център за изследване на рака, Сиатъл, WA 98109 и 5 Междудисциплинарни магистърски програми по хранителни науки, Университет във Вашингтон, Сиатъл, WA 98195
Йохана В. Лампе
4 Фред Хътчинсън Център за изследване на рака, Сиатъл, WA 98109 и 5 Междудисциплинарни магистърски програми по хранителни науки, Университет във Вашингтон, Сиатъл, WA 98195
Свързани данни
Резюме
Въведение
Интервенционните проучвания показват, че диетата може да повлияе на бактериалния състав на червата (23–28). Неотдавнашно проучване показа, че брюкселското зеле, кръстоцветният зеленчук, променя разнообразието и метаболитните дейности на чревните бактерии при плъхове, свързани с човешки фекални бактерии (29). Доколкото ни е известно, ефектът от приема на кръстоцветни зеленчуци върху бактериалния състав на червата при хората не е проучен до момента. Ние предположихме, че кръстоцветните зеленчуци ще имат селективен ефект върху определени чревни бактерии, участващи в метаболизма на съставните части на кръстоцветните зеленчуци (например фибри, глюкозинолати и др.). Целта на това проучване беше да се изследва степента, до която приемът на кръстоцветни зеленчуци променя чревния бактериален състав в рандомизирано, кръстосано проучване на добавки от кръстоцветни зеленчуци.
Материали и методи
Човешки субекти.
Това проучване е спомагателно за рандомизирано, кръстосано, контролирано проучване за хранене, което е предназначено да тества отговора на избраните биотрансформационни ензими към добавките от кръстоцветни зеленчуци (30). Участниците бяха здрави, непушачи мъже и жени, на възраст 20-40 години и наети на базата на генотипове GSTM1, GSTT1 и CYP1A2. Съществува обширен списък с критерии за изключване, които определят допустимостта на участниците за родителското проучване (30). Тези, които имат отношение към настоящото проучване, включват: анамнеза за стомашно-чревни разстройства; известни алергии/непоносимост към всякакви храни, използвани в проучването за хранене; употреба на антибиотици през последните 3 месеца; текущо използване на лекарства без рецепта и лекарства без рецепта; и тежък и чест запек, налагащ лечение от медицински специалист и/или чести медикаменти. Демографската информация [възраст, пол, раса, телесно тегло и ръст] беше събрана и генотипите бяха измервани при скрининг. Всички дейности бяха одобрени от Институционалния съвет за преглед на Центъра за изследване на рака на Фред Хътчинсън и бе получено информирано, писмено съгласие от участниците в проучването.
Диетична намеса.
Събиране на фекални проби.
Фекални проби бяха събрани от 17 участници в един момент в края на базалния и двукристоцветния зеленчуков период. Участниците бяха снабдени с фекални тръби за събиране с лъжичка в капака (76 × 20 mm; Sarstedt), съдържащи 5 ml RNAlater (Ambion). Указано им е да съберат 2 аликвотни части от изпражнения с размер на грахово зърно веднага по време на дефекацията и да поставят изпражненията в тръбите за събиране и да се разбъркат добре чрез разклащане. Пробите бяха доставени в лабораторията в рамките на 24 часа и съхранявани при -80 ° C.
ITC анализ на пикочните пътища.
Двадесет и четиричасови колекции на урина бяха получени от участници на d 13 от всеки период на диета. Общата екскреция на ITC в урината (изчислена като общ дитиокарбамат) се определя чрез HPLC, както е описано по-горе (32).
Общо фекално бактериално извличане на ДНК.
Фекални проби в RNAlater се хомогенизират с помощта на OMNI тъканен хомогенизатор 115 и се разпределят в аликвоти в 300-μL аликвотни части. Фекалната бактериална геномна ДНК беше извлечена с помощта на миниатюрен комплект за изпражнения на QIAamp ДНК (Qiagen) с 1 минута биене на зърна (21).
tRFLP.
Анализът на tRFLP се провежда, като се използва модификация на методи, описани по-рано (21). Бактериалният 16S рРНК ген се амплифицира с помощта на флуоресцентно маркиран праймер. PCR продуктите се пречистват и след това се обработват с 0,025 mmol/L от всеки dNTP и 2 U от Klenow (exo -) (New England BioLabs), за да се запълнят 5'-надвисите при 37 ° C за 30 минути (33). Ензимът Klenow се дезактивира при 70 ° С в продължение на 10 минути и ДНК се усвоява през нощта при 37 ° С с 5 U Alu I в 20-μL реакционен обем. Разградената ДНК (20 ng) от всяка проба се използва за анализ на tRFLP. Анализът на фрагменти беше проведен с помощта на капилярна електрофореза върху ABI 3100 (Applied Biosystems) в Genomics Shared Resource на Fred Hutchinson Cancer Research Center. Като вътрешен стандарт за размер беше използван GS500 с етикет GeneScan ROX (Applied Biosystems).
МАСА 1
Ежедневен прием на енергия и макронутриенти от участниците, когато консумират основна диета, лишена от плодове и зеленчуци, и основната диета, допълнена с кръстоцветни зеленчуци (двойно-кръстоцветна диета) 1
| Обща енергия, kJ/d | 9577 ± 2318 | 9556 ± 1858 |
| Въглехидрати, g/d | 319 ± 75 | 330 ± 68 |
| Мазнини, g/d | 74 ± 19 | 72 ± 14 |
| Протеин, g/d | 87 ± 22 | 93 ± 17 |
| Фибри, g/d | 8,9 ± 2,3 | 28,6 ± 5,8 * |
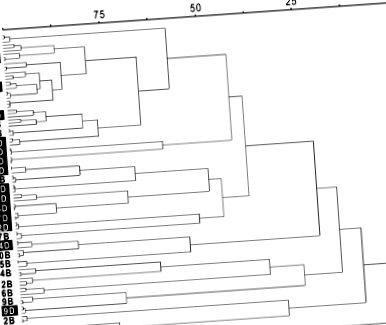
Клъстерен анализ на профилите на чревната бактериална общност на участниците в tRFLP след базалната диета (B) и диетата с двойно кръстоцветни зеленчуци (D). Числото преди B или D показва номера на участника (1–17). Три повторения във всяка проба са показани като 3 клона във всеки центроид. Целевата функция на Wishart е използвана за измерване на разликата в бактериалната общност в йерархичната дендрограма и е преоразмерена като процент сходство.
ISA предполага, че има 5 tRFLP фрагмента, значително свързани с диетичните периоди ( Таблица 2 ). Четири от тях са свързани значително с консумацията на кръстоцветни зеленчуци, а един е свързан с основната диета. Чрез in silico разграждането на секвенираните бактериални 16S rRNA гени идентифицирахме предполагаемата таксономична принадлежност и най-близките роднини на тези tRFLP фрагменти (Таблица 2).
ТАБЛИЦА 2
tRFLP фрагменти, които са значително свързани с 2-те контролирани диети в ISA 1
| 159 | 40.1 | Двойна 4 | Фиксира | E06, F05, G01 | Eubacterium hallii | 98% 5 |
| 219 | 17.6 | Двойна | Фиксира | C04, C08 | Phascolarctobacterium faecium | 99% |
| 222 | 32.8 | Базална 4 | Протеобактерии | N 6 | Burkholderiales | н |
| 241 | 48.3 | Двойна | Бактероидети | B03 | Alistipes putredinis | 98% |
| 468 | 23.5 | Двойна | Актинобактерии | н | Eggerthella spp. | н |
Филогенетичен анализ на чревната бактериална 16S рРНК генна клонираща библиотека.
Данните за последователността, получени от фекалната бактериална 16S рРНК генна клонирана библиотека, са представени в базите данни на GenBank под номера за присъединяване> FJ227596 до> FJ227683. Членовете на Firmicutes, Bacteroidetes и Actinobacteria бяха представени в тази клонираща библиотека ( Фиг. 2 ). Голяма част (74%) бяха в класа Clostridia, с 54% в клъстер XIVa и 19% в клъстер IV. Други 6% от клонингите принадлежат към класа Bacilli of Firmicutes. Останалите 19% от клонингите са Bacteroidetes, докато клонингът Actinobacteria представлява само 1% от клонингите в библиотеката.
Филогенетичен анализ на 16S рРНК гена, усилен от фекалната бактериална общност на 1 участник след прием на кръстоцветни зеленчуци. Избрани бактериални видове бяха включени във филогенетичното дърво за справка. Стойностите на Bootstrap> 95 са посочени на дървото и броят на клонингите е показан в скоби, ако има повече от един. *, Група актинобактерии.
Дискусия
В това проучване ние изследвахме ефектите от висококръстоцветната зеленчукова диета и диета, лишена от плодове и зеленчуци, върху профила на чревната бактериална общност като част от рандомизирано проучване за кръстосано хранене. Ние показахме, че: 1) всеки участник е имал уникален чревен бактериален състав, дори когато всички индивиди са получавали една и съща контролирана диета; 2) бактериалният състав на червата се различава значително, когато участниците консумират базална диета, лишена от плодове и зеленчуци, в сравнение с тази диета, допълнена с кръстоцветни зеленчуци; 3) специфични видове бактерии са свързани с приема на кръстоцветни зеленчуци; и 4) отговорът на бактериалната общност на червата към консумацията на кръстоцветни зеленчуци е уникален за всеки индивид, но не е пряко свързан с количеството консумирани кръстоцветни зеленчуци.
Използвайки ISA и секвениране на 16S рРНК гени, успяхме да идентифицираме предполагаеми видове, които значително се различават между двата периода на прием. Фрагментите на tRFLP, идентифицирани вероятно като Eubacterium hallii, Phascolarctobacterium faecium, Alistipes putredinis и Eggerthella spp. са свързани с прием на кръстоцветни зеленчуци, а фрагмент, идентифициран вероятно като Burkholderiales, е свързан с основната диета (Таблица 2). Някои от тези видове са филогенетично свързани с бактерии, описани по-рано като способни да метаболизират кръстоцветни растителни компоненти като фибри, лигнан и глюкозинолати. Например е установено, че Eggerthella метаболизира лигнани; няколко вида от порядъка на Bacteroidales, към които принадлежи Alistipes putredinis, могат да разграждат фибрите и глюкозинолатите (11,12,14,16,44,45). Това допълнително засилва ефективността на прилаганите молекулярни подходи при изследване на реакциите на бактериалната общност към диетата.
В обобщение показахме, че има значителна разлика в бактериалната общност на червата след 14 дни консумация на богата на кръстоцветни зеленчуци диета в сравнение с базална диета без плодове и зеленчуци. Тази разлика в бактериалната общност е уникална за индивидите. Също така идентифицирахме няколко предполагаеми вида чревни бактерии, които бяха свързани със специфичните диети, предлагайки допълнителни доказателства, че чревните бактерии могат да бъдат бързо модифицирани от хранителни компоненти. Това проучване също така показа, че анализът на tRFLP е полезен подход за оценка на състава на чревната бактериална общност и за проследяване на промените в структурата на общността поради диетична намеса. Необходими са по-нататъшни проучвания, за да се идентифицира in vivo чревният бактериален отговор на специфични кръстоцветни растителни компоненти, като глюкозинолати.
- Плодове и зеленчуци с ниско съдържание на въглехидрати Идеални за диети с ниско съдържание на захар
- Колко пиявици биха били необходими, за да убие човек • океански сироп
- Колко от човешкия ръст е генетичен и колко се дължи на храненето Scientific American
- Макромолекулен дизайн чрез обратими ксантати на веригата за добавяне-фрагментация (RAFT) (MADIX)
- Как да използвам двоен котел за пара зеленчуци Alices Кухня