Отдел по гастроентерология и хепатология, Катедра по медицина и терапия, болница Принц Уелски, Китайският университет в Хонг Конг, Хонконг, Китай
Отдел по гастроентерология и хепатология, Катедра по медицина и терапия, Болница Принц Уелски, Китайският университет в Хонг Конг, Хонконг, Китай
Отдел по гастроентерология и хепатология, Катедра по медицина и терапия, болница Принц Уелски, Китайският университет в Хонконг, Хонконг, Китай
Отдел по гастроентерология и хепатология, Катедра по медицина и терапия, болница Принц Уелски, Китайският университет в Хонконг, Хонконг, Китай
Обобщение
Въведение
Обикновено се смята, че ракът на стомаха се развива от многостепенна прогресия от хроничен гастрит, атрофичен гастрит, чревна метаплазия, дисплазия и впоследствие до рак. Тази поредица от промени в стомашната канцерогенеза, често наричана каскада на Корея, 1 често се инициира от Helicobacter pylori инфекция. В тази връзка атрофичният гастрит и чревната метаплазия се считат за предшественици на рак на стомаха, особено за чревния тип стомашно злокачествено заболяване. Не всички индивиди с чревна метаплазия обаче ще прогресират до рак на стомаха и факторите, управляващи тази прогресия, остават неизвестни. Този преглед обсъжда етиологията, генетичните промени и потенциалните възможности за лечение на стомашно-чревна метаплазия.
Хистология на чревната метаплазия
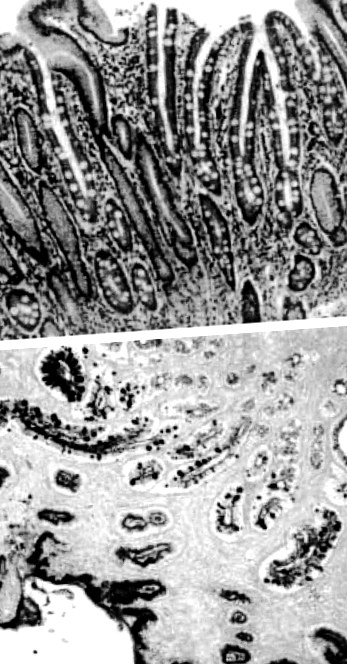
Чревната метаплазия се определя като заместване на стомашната лигавица с епител, който прилича на лигавицата на тънките черва (Фигура 1). Разпознаването на тънкочревната лигавица в стомаха датира от 19 век. 2 Чревната метаплазия е резултат от стомашни стволови клетки, които се отклоняват от пролиферация в клетки, специфични за стомаха, към тези на тънките черва, като абсорбиращи клетки, бокални клетки и клетки на Панет. Това обикновено се предизвиква от продължително дразнене на стомашната лигавица, с H. pylori инфекцията е най-важният отключващ фактор.
Стомашно-чревна метаплазия с видни чашевидни клетки, заместващи нормалния стомашен епител. (а) Хематоксилин и еозин оцветяване на стомашно-чревна метаплазия. (б) Периодична киселина – Шиф – Алкиево синьо петно с подчертани чашевидни клетки.
Чрез използване на различни хистологични и хистохимични техники чревната метаплазия може да бъде класифицирана в различни подтипове. Използвани са няколко системи за класификация, но най-широко използваната е тази, предложена от Jass & Filipe. 3 В тази класификация чревната метаплазия се класифицира на пълен и непълен тип. Пълният тип или тип I се характеризира с наличието на абсорбиращи клетки, клетки на Панет и бокалови клетки, секретиращи сиаломуцини, което съответства на фенотипа на тънките черва. Непълният тип, който обхваща типове II и III, се характеризира с наличието на колоновидни и чашевидни клетки, секретиращи сиаломуцини и/или сулфомуцини. Тип II секретира неутрални и киселинни сиаломуцини, а тип III произвежда сулфомуцини. Сулфомуцините могат да бъдат разграничени от сиаломуцините, като се използва оцветяване с високо съдържание на железен диамин/алкианско синьо. Други характеристики, свързани с чревната метаплазия тип III, включват забележимо изкривяване на жлезата и отсъствие на клетки на Панет.
Наскоро беше установено, че експресията на ядрени протеини на муцин (MUC) се променя при различни видове чревна метаплазия. Докато всички видове чревна метаплазия показват de novo експресията на MUC2, 4 експресията на MUC1, MUC5AC и MUC6 е намалена при пълния тип чревна метаплазия, но запазена при непълния тип. 5
Епидемиология на чревна метаплазия и рак на стомаха
Класификацията на чревната метаплазия на различни подвидове носи прогностично значение. Въз основа на ретроспективни данни, 6, 7 пълна или тип I чревна метаплазия е свързана с нисък риск от рак на стомаха, докато чревната метаплазия тип III (дебелото черво) има най-силна връзка с рака. В голямо кохортно проучване от Словения с 10-годишно проследяване пациентите с чревна метаплазия са имали общо 10-кратно повишен риск от рак на стомаха в сравнение с тези без чревна метаплазия. 7 Пациенти с чревна метаплазия тип III са имали четирикратно повишен риск от развитие на рак в сравнение с тези с тип I. В кохортно проучване от Китай, в което са участвали повече от 3000 пациенти с проследяване от 4 до 5 години, коефициентът на шансовете на прогресия от чревна метаплазия до рак на стомаха варира от 17 до 29. Рискът е особено висок за тези с по-напреднали хистологични лезии на изходно ниво, като наличието на дисплазия. 8 В скорошно японско проучване относителният риск от прогресия от чревна метаплазия до рак е 6,4 (95% доверителен интервал, 2,6–16,1). 9
Въпреки това, връзката между риска от развитие на рак на стомаха и подтипове чревна метаплазия не е общоприета. 10 Подтипирането на чревната метаплазия понякога е трудно при повърхностна ендоскопска биопсия. Като алтернатива се предлага, че разпределението на чревната метаплазия, а не подтипа на чревната метаплазия, може да има по-висока прогнозна стойност на риска от рак. В тази връзка Касаро и др. показа, че чревната метаплазия, включваща по-малката кривина от кардията до пилора или целия стомах, е свързана с по-висок риск от рак на стомаха, отколкото фокална или антрална преобладаваща чревна метаплазия. 11 Освен това те забелязват, че наличието на непълна метаплазия корелира с степента на чревна метаплазия в стомаха.
Етиология на чревната метаплазия
Смята се, че появата на чревна метаплазия в стомашната лигавица е резултат от адаптивна реакция и натиск за подбор като реакция на неблагоприятна среда. 12 H. pylori инфекция, тютюнопушенето и високият прием на сол често са замесени като етиологични фактори. Независимо от това, механизмите, водещи до тези фенотипни промени, остават спорни.
Няма малко съмнение, че хронична H. pylori инфекцията е най-важният етиологичен агент за развитието на чревна метаплазия. От друга страна, H.pylori инфекцията е причинно свързана с развитието на пептични язви. Всеизвестно е, че пациентите с язва на дванадесетопръстника имат по-малък риск от развитие на рак на стомаха. 9, 13 По същата линия беше установено в проучване на напречното сечение, че тези с язвена болест на дванадесетопръстника са по-малко склонни да имат чревна метаплазия и атрофия на жлезата. 14 Така, H. pylori изглежда, че инфекцията води до два различни клинични резултата, а именно язва на дванадесетопръстника или стомашна язва/рак. Тези различни клинични резултати в отговор на същата инфекция могат да бъдат съгласувани чрез разбирането на топографското разпределение на H. pylori‐ Асоцииран гастрит. Пациентите с язва на дванадесетопръстника се характеризират с преобладаващ антрален, неатрофичен тип гастрит, докато пациентите с рак на стомаха са склонни да развиват мултифокален или обширен атрофичен гастрит на корпуса. Независимо от това, точната причина, водеща до тези две фенотипни характеристики, остава неуловима.
Клетъчни кинетични промени в чревната метаплазия
Нарушаването на клетъчната кинетика играе важна роля в развитието на рака. Инхибирането на апоптозата и/или повишената пролиферация води до клетъчно натрупване и развитие на новообразувания. H. pylori инфекцията предизвиква клетъчна апоптоза и пролиферация в нормалния стомашен епител. 21-23 Тази промяна е обърната чрез изкореняването на H. pylori инфекция. Въпреки това, наскоро демонстрирахме, че апоптотичният индекс значително намалява H. pylori- асоциирана чревна метаплазия. 24 Докато пролиферацията беше увеличена както в чревната метаплазия, така и в не-чревната метаплазия, нивото на апоптоза беше значително по-ниско в първата. По този начин съотношението апоптотичен индекс/индекс на пролиферация е значително намалено при чревна метаплазия, благоприятстващо клетъчното натрупване и евентуално образуване на новообразувания.
Генетични промени в чревната метаплазия
Дисбалансът в клетъчната кинетика на стомашно-чревната метаплазия може да се отдаде на генетични и епигенетични промени. Мутация в стр53 е една от най-честите генетични промени, открити при рак на човека, включително рак на стомаха. Шиао и др. изследва 12 случая на рак на стомаха и докладва стр53 мутации в 50% от съседната чревна метаплазия. 25 Освен последователността на стр53 ген, мутант p53 може също да бъде открит чрез имунохистохимия поради дългия му полуживот. Използвайки техники на имунохистохимия, натрупването на р53 протеини е демонстрирано при чревна метаплазия, особено при тип III. 26
Стомашните ракови клетки експресират широк спектър от растежни фактори и цитокини. От тях се съобщава за трансформиране на растежен фактор-α и рецептор на епидермален растежен фактор-I при пред-неопластични стомашни лезии. Филипе и др. установи повишена експресия на тези два растежни фактора в чревната метаплазия на пациенти с рак на стомаха чрез имунохистохимия и вестерн-блотинг. 36 Циклини, зависими от циклин кинази и техните инхибитори регулират клетъчния растеж, диференциация, оцеляване и клетъчна смърт. Наскоро демонстрирахме, че свръхекспресията на циклин D2 и намалената експресия на p27 се откриват в H. pylori- асоциирана чревна метаплазия 37 (Фигура 2). По-специално, тези отклонени изрази могат да бъдат възстановени от H. pylori ликвидиране.
Многостепенната пътека на канцерогенезата на стомаха. Helicobacter pylori смята се, че инфекцията задейства тази каскада. Показани са генетичните и епигенетични промени, демонстрирани в различни етапи на пътя на стомашната канцерогенеза. COX ‐ 2, циклооксигеназа ‐ 2; EGFR, рецептор за епидермален растежен фактор; MSI, микросателитна нестабилност; TGF, трансформиращ растежен фактор.
Има ли нужда от наблюдение?
За разлика от хранопровода на Барет и аденом на дебелото черво, няма насоки за наблюдение на стомашно-чревна метаплазия. Потенциалната полза от всяка програма за наблюдение тепърва трябва да бъде доказана. Това се усложнява допълнително от променливите честоти на рак на стомаха в различни географски региони, което затруднява формулирането на препоръки. Освен това, стомашно-чревната метаплазия може да бъде трудно да се разпознае ендоскопски в сравнение с пре-злокачествените лезии на хранопровода и дебелото черво (Фигура 3). Дори и с хромоендоскопската техника, напр. чрез използване на метиленово синьо (метилтиониниев хлорид) или индигокармин, идентифицирането на чревна метаплазия в стомаха може да бъде трудно. 38
Ендоскопска поява на обширна чревна метаплазия в ъгловата инцизура.
Въпреки че диагностиката и наблюдението на чревната метаплазия в нераковия стомах могат да бъдат трудни, диагностиката на ранен рак при пациенти, за които е известно, че имат чревна метаплазия изглежда е различен въпрос. В скорошен доклад от Обединеното кралство, 39 беше установено, че ежегодното ендоскопско наблюдение може потенциално да открие повечето нови стомашни ракови заболявания на ранен етап. 5-годишната преживяемост на рак на стомаха, открит чрез наблюдение, е значително по-висока от тази, открита при ендоскопия с отворен достъп (50% срещу 10%). Тези обещаващи резултати подкрепят прилагането на структуриран скрининг при лица с чревна метаплазия, които са изложени на риск от развитие на рак. Независимо от това, в повечето развити страни, които потенциално биха могли да осигурят инфраструктура за ендоскопско наблюдение на рак на стомаха, честотата на заболяването вероятно е намаляла толкова много, че всяка скринингова програма е трудно да бъде обоснована.
Обратима ли е чревната метаплазия?
| Ван дер Хулст и др. 41 | Холандия | 155 (122 cagA+ срещу 33 cagA-) | Неконтролирано | 12 | Без промяна (независимо от cagA статус) |
| Окуса и др. 44 | Япония | 163 (115 З. pyloriИзкоренено срещу 46 неуспешно изкореняване) | Неконтролирано | 12 | IM се подобри в 28/46 |
| Uemura и др. 40 | Япония | 132 ранен рак на стомаха | Нерандомизирани (65 унищожени срещу 67 без ликвидиране) | 6 | Значително подобрение в антрума (от 1,3 до 0,9) и корпуса (от 0,7 до 0,46) |
| Изпята и др. 43 | Китай | 587 | Рандомизиран контрол (ерадикация срещу плацебо) | 12 | Няма промяна |
| Кореа и др. 42 | Колумбия | 976 (631 завършен опит) | Рандомизиран контрол (осем лечебни групи) | 72 | RR за IM регресия = 3.1 (1.0–9.3) |
В малко рандомизирано проучване беше установено, че пациентите получават 6 месеца аскорбинова киселина след това H. pylori ерадикацията показва значително подобрение на чревната метаплазия в сравнение с тези, получаващи плацебо. 47 Освен H. pylori ликвидиране и добавяне на витамини, друг атрактивен химиопрофилактичен агент са нестероидните противовъзпалителни лекарства (НСПВС). Епидемиологичните данни предполагат отрицателна връзка между употребата на НСПВС или аспирин и рак на стомаха. Неотдавнашно проучване на случая-контрол показа, че непрекъснатата употреба на НСПВС е свързана с намаляване на риска от рак на стомаха (коефициент на шансове 0,51; 95% доверителен интервал 0,33-0,79). 48 Поради стомашната токсичност, свързана с конвенционалните НСПВС, този подход може да не е клинично осъществим. С неотдавнашното наличие на инхибитори на циклооксигеназа-2 е изкушаващо да се тества дали този агент може да се използва при химиопрофилактика на рак на стомаха. Предварителните данни за употребата на инхибитори на циклооксигеназа-2 при пациенти с фамилна аденоматозна полипоза дават обнадеждаващи резултати. 49 Въпреки това дали това може да се превърне в химиопрофилактика на стомашно-чревна метаплазия, очаква по-нататъшно проучване.
Ако чревната метаплазия се възприема като променен стомашен фенотип, произтичащ от соматичната мутация на стволови клетки или епигенетични промени в клетките-предшественици, ще се очаква, че тези промени изобщо не могат да бъдат обратими въпреки изкореняването на H. pylori. Бъдещи проучвания с по-дълго проследяване и по-голям обем на пробата може да са в състояние да дадат окончателната присъда дали чревната метаплазия всъщност е преминала „точката на невъзвращаемост“. Независимо от това, промените в стомашната среда, свързани с ликвидирането на H. pylori, като разрешаване на възпалението, елиминиране на увреждане на ДНК 50 и намаляване на пролиферацията, 24 може да е по-важно за предотвратяване на рак на стомаха, отколкото действителното обръщане на чревната метаплазия.
Заключения
Въз основа на убедителни епидемиологични данни и молекулярни промени, открити при стомашно-чревна метаплазия, няма малко съмнение, че чревната метаплазия е пред-злокачествена стомашна лезия. Не всички пациенти с чревна метаплазия обаче ще прогресират до рак на стомаха. Бъдещите изследвания трябва да бъдат насочени към идентифициране на тези, които са изложени на риск от по-нататъшно развитие, така че да могат да се прилагат интензивни програми за наблюдение. Въпреки че използването на анти-Хеликобактер терапията при лечение на чревна метаплазия изглежда обещаваща, липсват дългосрочни резултати. Трябва да се определи ролята на други химиопрофилактични средства.
Благодарности
Работата, описана в този документ, е подкрепена с безвъзмездна финансова помощ от Съвета за безвъзмездни средства за изследвания в Специалния административен район на Хонконг, Китай (проект № CUHK 4061/01M).
- Влияние на стареенето, атрофия на стомашната лигавица и хранителни навици върху стомашната секреция - PubMed
- Поставяне на дренаж след гастректомия за рак на стомаха Cochrane
- Черва - Суха храна за котки - PRO-VET Prof Pet Corporation
- Интермитентна обструкция в резултат на множество чревни мрежи
- Взаимодействие между чревната микробиота на пилето и храносмилането - ScienceDirect