Джорджия Задра
1 Катедра по медицинска онкология, Институт за рак на Дана-Фарбър, Медицинско училище в Харвард, Бостън, Масачузетс, САЩ
Корнелия Фотопулос
1 Катедра по медицинска онкология, Институт за рак на Дана-Фарбър, Медицинско училище в Харвард, Бостън, Масачузетс, САЩ
Масимо Лода
1 Катедра по медицинска онкология, Институт за рак на Дана-Фарбър, Медицинско училище в Харвард, Бостън, Масачузетс, САЩ
2 Център за молекулярна онкологична патология, Институт за рак на Дана-Фарбър, Медицинско училище в Харвард, Бостън, Масачузетс, САЩ
3 Отделение по патология, Brigham and Women’s Hospital, Harvard Medical School, Бостън, Масачузетс, САЩ
4 The Broad Institute, Кеймбридж, Масачузетс, САЩ
5 Отдел за изследване на рака, King’s College London, Лондон, Великобритания
Резюме
Въведение
Роля на липидите при рак
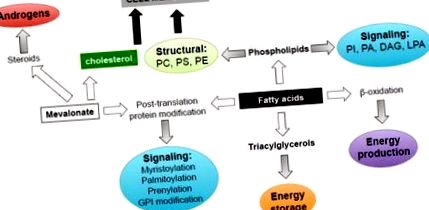
Липидите допринасят за няколко аспекта на туморната биология поради разнообразието на техните биологични роли (Фигура 1). Първо, те функционират като градивни елементи за биологичните мембрани, за да поддържат високата степен на пролиферация на раковите клетки. Няколко ендогенно синтезирани мастни киселини (FA) се естерифицират до фосфолипиди, които осигуряват основни структурни липиди, улесняват образуването на устойчиви на детергент мембранни микродомени за предаване на сигнали, вътреклетъчен трафик, поляризация и миграция, необходими за раковите клетки [9, 14]. Значението на мембранния синтез в раковите клетки е подчертано от наблюдението, че експресията и активността на холин киназата, ензим, необходим за синтеза на фосфатидилхолин и фосфатидилетаноламин (основните фосфолипиди, открити в клетъчните мембрани), се увеличава в тумори от няколко тъкани, включително PCa и корелира с лоша прогноза [15, 16]. Холин киназата има онкогенна активност, когато е свръхекспресирана, което предполага, че синтезът на фосфолипиди е ограничаващ скоростта за трансформация [17, 18].
Липидите изпълняват няколко биологични функции в раковите клетки, включително енергийно снабдяване и съхранение, мембранни градивни блокове, сигнални молекули, протеинови модификации след транслация, субстрати за стероиди в подкрепа на оцеляването на PCa клетки, пролиферация, миграция и инвазия. PI, фосфатидилинозитол, PA, фосфатидна киселина; DAG, диацилглицерол; LPA, лизофосфатидна киселина; Компютър, фосфохолин; PS, фосфатидилсерин; PE, фосфатидилетаноламин; GPI, гликозилфосфатидилинозитол.
Промяна на липидния метаболизъм при рак на простатата
Дисрегулация на биосинтеза на FA и неговата плейотропна роля в раковите клетки
а. Енергийна хомеостаза
Както бе споменато по-горе, раковите клетки използват големи количества глюкоза за енергийни и биосинтетични цели [8], което води до висока степен на производство и секреция на лактат, които водят до подкисляване на микросредата на тумора [65]. По този начин е възможно синтезът на липиди да функционира като мивка за въглерод, за да отдели излишния пируват и да избегне образуването на лактат, за да уравновеси вътреклетъчното рН. Освен това може да допринесе за редокс баланса. Всъщност е показано, че в PCa клетките окислителната сила на пътя на синтеза на FA е толкова голяма, че редоксът се стабилизира по-благоприятно (по-окислено), отколкото в нормалните клетки на простатата. Това улеснено редукционно подобрение с FASN се случва въпреки факта, че злокачествените клетки са по-ограничени с O2 и следователно експресират повече HIF-1α и регулирани от хипоксия гени [66]. Освен това, в хипоксичните клетки, NADP +, получен от синтез на липиди, също може да увеличи наличността на цитоплазмен NAD +, необходим за поддържане на гликолиза, благодарение на наскоро предложената митохондрия-цитозолна совалка NADPH [67]. По този начин липидният синтез би използвал своята окислителна сила, за да подобри редокс баланса между цитоплазмата и митохондриите и допринася за максимална гликолиза.
б. Устойчивост на оксидативен стрес
Неотдавнашен анализ на фосфолипидите, базиран на масова спектрометрия, разкри, че туморите на простатата, показващи липогенен фенотип (поради повишена експресия на FASN), показват постоянно нарастване на наситените и мононенаситени FAs (SFAs и MUFAs) и намаляване на полиненаситените видове в сравнение с нормалните тъкани [68] . Обръщането на липогенния фенотип от инхибитора на малки молекули сорафен А или siRNAs значително намалява наситените и мононенаситени фосфолипидни видове и увеличава относителната степен на полиненаситеност. Този липогенен превключвател, който благоприятства SFA, изглежда предпазва раковите клетки от оксидативен стрес и от индуцирана от доксорубицин клетъчна смърт [68]. Освен това, тенденцията на фосфолипидите, съдържащи предимно SFA, да се отделят в липидни салове/мембрани, устойчиви на детергент, значително би променила каскадите на сигналната трансдукция, трафикуларния трафик и миграцията на клетките [69].
° С. Клетъчна полярност
Последните доказателства показват, че de novo липогенезата и по-специално активирането на SREBP-1c изкривява поляризацията на клетките и потиска образуването на първичен реснички [70]. Тази микротубуларна сензорна органела се експресира на повърхността на почти всеки тип клетки и се губи при много видове рак, включително РПЖ [71]. Тъй като първичната ресничка се концентрира и регулира няколко сигнални пътища, индуцираната от SREBP репресия на първичната ресничка може да направи раковите клетки по-малко зависими от външни сигнали и анти-растежни сигнали. Това може също да допринесе за конститутивното активиране на свързаните с рака сигнални пътища, като например Wnt сигнализиране, за което освен това се съобщава, че се активира от FASN-индуцирана палмитоилация в PCa клетки [27]. Потискането на първичната ресничка чрез SREBP-1 и чрез de novo липогенеза може също да освободи директно физическо ограничаване на клетъчния цикъл, тъй като първичната ресничка е съставена от същите структурни елементи, които се използват за образуване на митотично вретено [72]. Тези открития не само дават нова представа за ролята на de novo липогенезата в PCa клетки, но също така дават основание за използването на инхибитори на липогенезата като антинеопластични средства и като химиотерапевтични сенсибилизатори.
Дисрегулация на ремоделиране на FA
Промени в катаболизма на FA
а) Повишена разбивка на FA
б) Повишено β-окисление
Повишен холестерол и ендогенен синтез на стероиди в PCa
Повишено натрупване на холестерол в PCa клетки
Лекарствата със статини са предназначени да инхибират чернодробния HMGCR, ограничаващ скоростта ензим на синтеза на холестерол и първоначално са били показани за лечение на сърдечно-съдови заболявания; дългосрочната употреба на статини обаче показва благоприятни ефекти при намаляване на риска от напреднала PCa [прегледана в 96]. Поради това са положени значителни усилия за разбирането на механизмите на действие на статините [прегледани в 106–108].
Повишена интратуморна стероидогенеза
Наскоро бяха разработени нови лекарства, насочени към блокиране на de novo стероидогенеза при напреднала PCa с обещаващи резултати [3]. През 2011 г. Abiraterone acetate, инхибитор на CYP17A, беше одобрен от FDA за лечение на мъже с CRPC, получили преди това доцетаксел. На 10 декември 2012 г. FDA разшири употребата си в комбинация с преднизон за лечение на мъже с CRPC преди химиотерапия [http://www.fda.gov].
Онкогените и туморните супресори регулират плътно de novo липогенезата
AMPK е главен енергиен сензор, който реагира на повишено съотношение AMP/ATP, като включва пътища, генериращи ATP, като същевременно изключва консумиращите ATP, включително mTORC1 и липогенезата. Тумор-супресорът LKB1 регулира отрицателно липогенните ензими чрез активиране на целевия AMPK надолу по веригата. AMPK инхибира ензима FASN, ACLY, ACC, SCD1 и HMGCR както на транскрипционно, така и на посттранслационно ниво [135, 136]. Последното се получава чрез директно инхибиторно фосфорилиране на ACC и HMGCR. AMPK-медиирано намаляване на транскрипцията на липогенни ензими се получава чрез директно фосфорилиране на SREBP-1, като по този начин се предотвратява неговото протеолитично активиране или чрез намаляване на неговата експресия [137, 138] (Фигура 3).
Пациентите с метаболитен синдром (МС), метаболитно заболяване, свързано с повишен риск от високостепенна РПЖ [139, 140], показват дерегулация на LKB1/AMPK пътя [141], като по този начин позволяват настъпването на засилена липогенеза. Други туморни супресори като Rb и p53 също участват в регулирането на липогенезата. Всъщност инактивирането на туморния супресор Rb (отчетено при 5% от първичната PCa и 37% от напредналите тумори) засилва изопренилирането и активирането на онкогенен N-Ras, чрез индукция на SREBP-1 и 2 [142]. Нещо повече, анализ на експресията в целия геном идентифицира пътя на мевалоната като значително регулиран нагоре в р53 мутантни клетки (което се среща при приблизително 3–20% от PCas) [143] (Фигура 3).
Намеса в липидния метаболизъм като терапевтичен подход
Активирането на пътищата на синтез на FA и мевалонат изглежда е от съществено значение както при туморогенезата на простатата, така и при прогресията. Освен това, липидният синтез е особено активен при метастатично, устойчиво на кастрация заболяване. По този начин са положени значителни усилия за насочване към липогенните ензими и техните ключови регулатори нагоре по веригата. Две привлекателни цели включват ключовия ензим за синтеза на FA FASN и главния метаболитен сензор AMPK (Фигура 4).
Много усилия бяха изразходвани за идентифициране на инхибитори на de novo FA и синтеза на холестерол, както и на инхибитори на интратуморната de novo стероидогенеза, които да се използват при терапия на рак. В тази диаграма инхибиторите на синтеза на FA и холестерола са изобразени съответно в червени и сини квадрати. Ензимите, принадлежащи към двата пътя, са подчертани в съответните червени и сини цветове. Наскоро бяха разработени нови малки молекули, насочени към синтаза на мастни киселини (FASN), AMP-активирана протеинкиназа (AMPK) и вътретуморен синтез на андрогени, както се обсъжда в текста. ACLY, ATP цитратна лиаза; ACC, ацетил-КоА карбоксилаза; ACAT, ацетил-КоА ацетилтрансферази; HMGCS, HMG-CoA синтаза; HMGCR, HMG-CoA редуктаза; SCD1, стеароил-КоА десатураза 1; CYP11A1, р450, семейство 11, подсемейство А, полипептид 1; CYP17A1; р450, семейство 11, подсемейство А, полипептид 1; 3β-HSD1, 2,3-р-хидроксистероид дехидрогеназа/А-5-4 изомераза 1, 2; 17β-HSD, 17β-Хидроксистероид дехидрогеназа; SRD5A 1, 2, стероид-5α-редуктаза 1, 2.
Инхибитори на FASN
Понастоящем са установени по-нови по-мощни FASN инхибитори чрез програми за медицинска химия и скрининг с висока производителност: Astra Zeneca разработи серия от производни на бизамид, Merck серия от производни на 3-арил-4-хидроксихинолин-2 (1Н) и GlaxoSmithKline произвежда GSK837149, FASN инхибитор с наномоларна сила [прегледан в 146]. Учени от GlaxoSmithKline също наскоро са патентовали молекулярната структура на новите производни на триазолон като инхибитори на FASN (US20120316151 A1, www.google.com/patents). Доколкото ни е известно, понастоящем нито един от наличните инхибитори на FASN не е в клинични проучвания за рак. Една от основните причини за клиничния провал на FASN инхибиторите досега е анорексията и трайната загуба на телесно тегло, свързани с инхибирането на FASN. Освен това някои налични FASN инхибитори, като Orlista, се абсорбират слабо от стомашно-чревния тракт. Другият въпрос е въпросът без отговор дали екзогенните липиди могат да спасят ефектите от инхибирането на липидния синтез.
Други инхибитори на липогенезата
Активатори AMPK
Тъй като AMPK представлява център за клетъчен метаболизъм и контрол на растежа, той представлява идеална терапевтична цел за метаболитни заболявания, както и рак. Доказано е, че няколко лекарства, които се използват в голяма степен при лечението на диабет и други метаболитни заболявания, включително метформин, намаляват риска от рак [152] и намаляват пролиферацията на туморни клетки и туморния растеж при животински модели главно чрез активиране на AMPK [прегледано в 146] . AMPK активаторите се разделят на два класа: а) индиректни активатори, включително бигуаниди и тиазолидиндиони; б) директни активатори, включително AICAR и последното поколение малки молекули.
Индиректни активатори AMPK
Метформин
Тиазолидиндиони
Подобно на метформин, тиазолидиндионите (TZD) се използват клинично за лечение на диабет тип 2. Те активират AMPK вероятно чрез инхибиране на комплекс I на дихателната верига [160]. В момента тяхната активност като противоракови агенти е в процес на оценка. Всъщност е доказано, че TZD производното CGP 52608 има силна цитостатична активност в клетките на LNCaP чрез намаляване на клетъчната пролиферация и чрез въздействие върху разпределението на клетъчния цикъл чрез модулация на експресията на гени, свързани с клетъчния цикъл [161].
Директни активатори AMPK
AICAR
Нуклеозидът 5-аминоимидазол-4карбоксамид-1-β-рибофуранозид (AICAR) е първото съединение, за което се съобщава, че активира AMPK в непокътнати клетки и in vivo и е широко използвано за изследване на последствията от активирането на AMPK при животни. AICAR се поема в клетките от аденозинови транспортери и след това се превръща от аденозин киназа в монофосфорилираното производно ZMP, което е аналог на 5′-MP и по този начин имитира няколко от неговите клетъчни ефекти. AICAR инхибира растежа на туморни клетки in vitro и in vivo. По-конкретно е показано, че инхибира клетъчната пролиферация на PCa и растежа на тумори в моделите на PCa ксенографт [157, 162]. AICAR обаче не е напълно специфичен за AMPK, като оказва AMPK-независими ефекти главно върху AMP-регулираните ензими и митохондриалното окислително фосфорилиране. Освен това, той има ограничена бионаличност през устата, което го прави лош кандидат за дългосрочна употреба при хора [163]. Следователно, активно се търси дизайн на нови малки молекулни AMPK активатори с намалени целеви ефекти и беше значително подобрен чрез публикуването на кристалната структура на AMPK субединиците [164].
Малки молекули AMPK активатори
Използване на липидна дерегулация за разработване на нови образни техники за диагностика и терапия на PCa
Липиден метаболизъм в цялото тяло и рак на простатата
Затлъстяване, метаболитен синдром и PCa
Диетични мазнини и рак на простатата
Заключителни бележки
Благодарение на появата на липидомични технологии и подкладен интерес към тази област, се натрупват значителни прозрения за ролята на липидния метаболизъм при рака. Става ясно, че както ново, така и диетичните липиди са важни играчи в развитието и прогресията на PCa. По-специално, de novo липогенезата, чрез модулиране на мембранния липиден състав на раковите клетки влияе върху биологията на раковите клетки далеч отвъд простото увеличаване на мембранната биогенеза, играейки значителна роля в процеси като включително предаване на сигнали, транспорт на хранителни вещества, активност на йонните канали, сигнализиране на клетъчната смърт и енергиен метаболизъм. Освен това, няколко доказателства подчертават, че дисрегулацията на липидния метаболизъм при РПЖ не се ограничава до повишена липидна биосинтеза, а включва аберантно липидно ремоделиране, FA катаболизъм и синтез на междинни съединения на мевалонат, които са силно ангажирани в развитието и прогресирането на рака и особено при хормонално зависими видове рак като този на простатата. По-подробното разбиране на последиците от тези промени е предназначено да постави липидния метаболизъм в центъра на бъдещите изследвания на рака, включително PCa, и може да отвори нови терапевтични и диагностични пътища.
Акценти
Включете метаболизма на липидите по време на развитието и прогресията на PCa
Насочване към de novo липогенеза като терапевтична стратегия за PCa
- Тежестта на рака на простатата в Канада Канадско списание за урологична асоциация
- Светлата страна на асцита при рак на яйчниците
- „Диетата на Éclair“ и рак на простатата; Новини и преглед на натуропатичния лекар
- Разгръщане на студения вирус за убиване на рака MD Anderson Cancer Center
- Защо Евангелието се чете от лявата страна на олтара; човек от литургията