Фернандо Лизкано
1 Център за биомедицински изследвания, Университет де Ла Сабана (CIBUS), км 7, Автописта Норте де Богота, Чиа, Колумбия
2 Fundacion Cardio-Infantil Instituto de Cardiologia, Богота, Колумбия
Гилермо Гусман
1 Център за биомедицински изследвания, Университет де Ла Сабана (CIBUS), км 7, Автописта Норте де Богота, Чиа, Колумбия
Резюме
1. Въведение
Затлъстяването и свързаните със затлъстяването разстройства като захарен диабет тип 2 (DM тип 2), сърдечно-съдови заболявания и хипертония са световни епидемии с по-голям процент на нарастване в развиващите се страни [1–3]. Много генетични и епигенетични фактори определят патофизиологията на натрупването на мазнини в тялото [4, 5]. По-голямата част от тези фактори могат да бъдат класифицирани в различни категории [6–9] като (1) фактори, отговорни за хормоналната регулация на апетита и ситостта; (2) фактори, които регулират нивата на глюкозата в тялото [10–12]; (3) регулатори на базалния метаболизъм [13, 14]; (4) фактори, които контролират количеството, разположението и разпределението на мастните клетки [15, 16]; (5) модулатори за диференциация на прогениторни клетки [17, 18]; и (6) онези фактори, които определят адипоцитната клетъчна линия [19, 20]. Адипоцитите могат също така да регулират производството на цитокини, които контролират центровете за ситост и глад в централната нервна система и модулират енергийните разходи в други тъкани [21–23].
Нарастването на наднорменото тегло и затлъстяването при жените в менопауза са важни проблеми, свързани с общественото здраве [24, 25]. Разпространението на затлъстяването, което е тясно свързано със сърдечно-съдовия риск, се увеличава значително при американките след навършване на 40-годишна възраст; разпространението достига 65% между 40 и 59 години и 73,8% при жени над 60-годишна възраст [26]. За съжаление, има ограничен брой лекарства за лечение на затлъстяване, тъй като по-голямата част от новите продукти са изтеглени поради странични ефекти [27–29].
2. Методи
Дизайнът на изследването представлява преглед на съществуващи публикувани оригинални статии и рецензии. Проведохме този преглед на SSBs и здравни резултати в съответствие с Предпочитаните елементи за докладване за систематични прегледи и декларация за мета-анализ (PRISMA) [35]. Публикациите PubMed до 30 ноември 2013 г. бяха взети под внимание.
3. Естрогени и естрогенни рецептори при метаболизма на мазнините
Хормоните помагат да се интегрират метаболитните взаимодействия между основните органи, които са от съществено значение за метаболитно интензивни дейности като репродукция и метаболитна функция. Половите стероиди са необходими за регулиране на метаболизма на адипоцитите и също така влияят върху специфичното за пола ремоделиране на определени мастни депа [36, 37]. При хората факторите, които контролират разпределението на мазнините, се определят частично от концентрацията на половите хормони [38]. Мъжете средно имат по-малко обща телесна мазнина, но повече централна/интраабдоминална мастна тъкан, докато жените са склонни да имат повече обща мазнина, която благоприятства глутеалните/бедрените и подкожните депа [39]. Разпределението на теглото и мазнините в корема се различава сред жените в репродуктивна възраст и жените в менопауза [40, 41]. Намаляването на нивата на естроген при жените в менопауза е свързано със загубата на подкожна мастна тъкан и увеличаването на коремните мазнини [42]. Важността на естрогените за подкожно натрупване на мазнини е очевидна; всъщност естрогенната хормонална терапия при мъжете също увеличава количеството на подкожните мазнини [43, 44].
При хората 17-β-естрадиол (Е2) е най-мощният естроген, последван от естрон (Е1) и естриол (Е3) [45]. Експресията на гени, които кодират ензимите в естрогенния синтетичен път като ароматаза и редуктивни 17β-хидроксистероидни дехидрогенази (17β-HSD) е критична за образуването на Е2 [46]. Протеиновите продукти от няколко гена с припокриващи се функции могат да предоставят редуктивни 17β-HSD дейности в периферните тъкани [47].
Функцията на естрогените се медиира от ядрени рецептори, които са транскрипционни фактори, които принадлежат към суперсемейството на ядрените рецептори. Идентифицирани са два вида естрогенни рецептори (ER), алфа (ERα) и бета (ERβ) рецептори [48, 49]. Класическият геномен механизъм на действие на ER обикновено се появява в рамките на часове, което води до активиране или репресия на целевите гени. В този класически сигнален път лигандът активира ER се дисоциира от протеина на топлинен шоков шаперон и се свързва като димер директно с естроген-отговорен елемент (ERE) в промотора на целевите гени [50-52], въпреки че се счита, че действието на Е2 е бил обект на действие в регулацията на генната експресия. Напоследък има все повече доказателства за ненуклеарни цитозолни или плазмени мембранни рецептори, които медиират негеномни и бързи ефекти на няколко стероидни хормона [53–55]. По този начин е установено, че традиционните естрогенни ядрени рецептори функционират извън ядрото, за да насочват негеномни ефекти [56].
Няколко механизма на активиране на мембранно сигнализиране могат да обяснят бързите реакции на Е2. Тези бързи действия включват активиране на киназа, фосфатаза и фосфолипаза, които могат да медиират калциево-зависима сигнализация и могат да медиират негеномни физиологични отговори надолу по веригата, като ефекти върху клетъчния цикъл, клетъчното оцеляване и енергийния метаболизъм [57, 58].
Човешката подкожна и висцерална мастна тъкан експресират както ERα, така и ERβ [59, 60], докато само ERα иРНК е идентифицирана в кафявата мастна тъкан [61, 62]. ERα играе основна роля в активността на адипоцитите и сексуалния диморфизъм на разпределението на мазнините. Женските и мъжките мишки, които нямат ERα, имат централно затлъстяване, имат тежка инсулинова резистентност и са диабетици [63–65]. Въпреки че не всички проучвания са съгласни, полиморфизмът на ERα при хората е свързан с рискови фактори за сърдечно-съдови заболявания [66].
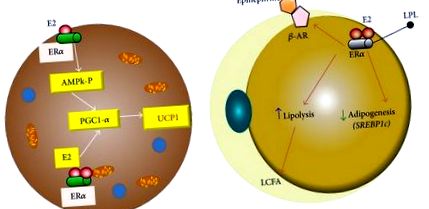
Естроген в мастната клетка. (а) В кафявите адипоцитни клетки ER алфа рецепторът може да увеличи експресията на UCP1 чрез увеличаване на PGC1alpha коактиватор чрез AMPk и чрез директен ефект върху рецепторния коактиватор. (b) При бяло адипоцитно ER активиране на алфа рецептора от естроген намалява липопротеиновата липаза и повишава активността на бета-адренергичния рецептор. UCP1: отделяне на протеин 1; PGC1alpha: пероксизомен пролиферативен активиран рецептор гама коактиватор 1 алфа; ER: естрогенен рецептор; AMPk: АМР-активирана протеин киназа. LPL: липопротеин липаза; β-AR: адренергичен рецептор бета.
4. Контрол на естрогените на централното ядро на апетита и наситеността
Естроген хипоталамусен контрол на затлъстяването. ER alpha в мозъка регулира телесното тегло както при мъжете, така и при жените ▸ ER alpha в женските неврони SF1 регулира разхода на енергия и разпределението на мазнините ▸ ER alpha в женските POMC неврони регулира приема на храна. POMC: проопиомеланокортин; SF1: стероидогенен фактор-1.
5. Регулиране на естрогена и енергията
Наличността на естрадиол влияе върху регулирането на ензимите, участващи в цикличната активност на трикарбоксилната киселина. Е2 подобрява гликолитичния/пируват/ацетил-КоА пътя за генериране на електрони, необходими за окислително фосфорилиране и генериране на АТФ, за да поддържа използването на глюкозата като основен източник на гориво.
Липопротеин липазата (LPL) е ключов регулиращ ензим за енергиен метаболизъм, който разгражда плазмените триглицериди до свободни мастни киселини и глицерол. Естрадиолът модулира активността на LPL, при което промоторната област съдържа елементи на естрогенен отговор, които взаимодействат с естрогенния рецептор и инхибират експресията на иРНК в 3T3 клетки и пациенти, които са подложени на терапия с естрадиолови пластири [118, 119]. Трябва да се признае и ролята на естрогените в митохондриите, които генерират над 90% от клетъчния АТФ. Митохондриите играят важна роля в регулирането на клетъчното оцеляване и апоптозата, а дихателната верига е основният структурен и функционален компонент, който се влияе от естрогенната активност [61]. Защитният ефект на естрогена върху оксидативния стрес се медиира от транслокация за специфични ензими от цитозол, които предотвратяват митохондриалния ADN на окислителна атака от свободните радикали [120].
6. Секреция на естроген и адипокин
Естрогените могат да окажат въздействие върху няколко адипокини, които се произвеждат от адипоцитите. Нивата на естроген при жените в пременопауза са тясно свързани с нивата на лептин [129, 130]. Лептинът може да модулира енергийния баланс в хипоталамуса, като упражнява аноректичен ефект, а също така проявява липолитичен ефект. Естрогенът повишава чувствителността към лептин, като контролира експресията на рецептори, специфични за лептин [130–132].
Адипонектинът е обратно свързан с нивата на естроген. Този адипокин участва в различни възпалителни процеси, модулация на ендотелната функция и защита срещу синдром на инсулинова резистентност. Плазмените нива на адипонектин индиректно и отрицателно корелират с плазмените нива на Е2. Оофоректомията на възрастни мишки увеличава адипонектина, който се обръща чрез заместване на Е2 [133–135].
Резистинът е хормон, който се произвежда от адипоцитите и допринася за затлъстяването. Подкожното инжектиране на естрадиол бензоат намалява нивата на резистин в адипоцитите [136].
Доказателствата от модели с дефицит на ароматаза ArKo допринасят за тези наблюдения. Тези мишки развиват фенотип на затлъстяване при затлъстяване с повишено затлъстяване на гонадите и висцералите и три пъти по-високи нива на циркулиращ лептин без значително увеличение на телесното тегло [137]. Мастните клетки могат да произвеждат възпалителни адипоцитокини, които индуцират много от усложненията на затлъстяването като CD68, TNFα или IL6. Прилагането на естрогени на овариектомирани женски мишки намалява значително иРНК на IL6, TNFα и CD68. Освен това, естрогенът е попречил на женските мишки да развият чернодробна стеатоза и да станат резистентни към инсулин [72, 138].
7. Естроген-подобни съединения и ендокринни разрушители
Някои химикали и съединения, получени от растения, които могат да регулират активността на естрогенните рецептори, са потенциални обезогени [139]. Ефектът на тиболона, синтетично вещество с естрогенна активност, върху телесното тегло при жени в постменопауза е оценен [140, 141]. Едногодишното лечение с тиболона намалява мастната маса. Въпреки това, тиболона, комбиниран със 17-β-естрадиол и норетиндрон ацетат в продължение на 2 години, не намалява значително мастната маса [142]. Комбинацията от хормонозаместителна терапия и тиболона при жени в менопауза увеличава индекса на телесна маса (BMI), маса без мазнини (FFM), индекс на свободен естроген (FEI) и индекс на свободен тестостерон (FTI), но съотношението между талията и ханша (WHR) намалява след лечение с тиболона [142]. Генистеинът е фитоестроген, който има сходство в структурата с човешкия женски хормон 17-β-естрадиол, който може да се свърже както с алфа, така и с бета естрогенните рецептори и имитира действието на естрогените върху целевите органи. Генистеинът присъства в соята и се използва широко при жени в постменопауза. Генистеинът има тенденция да предизвиква затлъстяване при ниски дози, но по-високите дози увеличават окисляването на мастните киселини и намаляват натрупването на мазнини в черния дроб [117, 143]. Генистеин обаче обръща натрупването на мастна тъкан при жените в постменопауза и моделите на гризачи с яйчници [144, 145].
Затлъстяването се причинява от комбинация от генетични и екологични фактори [146]. Някои ксенобиотици в околната среда нарушават нормалния контрол на различни ядрени рецептори или предизвикват адипогенен ефект. Ролята на тези ендокринни разрушители в сексуалното поведение, менопаузата и някои заболявания на половите жлези е изследвана поради тяхната модулация на естрогенната рецепторна активност. Многобройни химикали и съединения, получени от растения, като бисфенол А (BPA), фталати и тежки метали, проявяват естрогенна активност [147–150]. Много ендокринни разрушители могат да повлияят на транскрипционната активност на ядрените рецептори, като променят действието на конкурентно свързване с лигандния наддаващ домейн, което може да модифицира активността на коактиватора и да раздели корепресорите, които намаляват действието на деацетилазите. Някои ендокринни разрушители могат също да модифицират ДНК метилирането в регулаторната област на специфични гени. Освен това някои от тях могат да активират фосфорилирането на протеини [151, 152].
Ендокринните разрушители могат също да участват в различни естрогенни интервенционни процеси, като гликолитичния път и по време на регулирането на глюкозните транспортери със съединения като BPA, 4-нонилфенол (NP), 4-октилфенол (OP) и 4-пропилфенол [116, 153, 154]. Ендокринното разстройство, използващо тези вещества, също пречи на метаболизма на трикарбоксилната киселина, като намалява ключовите ензими в митохондриалната активност, което може да бъде частично свързано със затлъстяването (Фигура 4).
Компоненти с естрогенни ефекти. Естроген и някои ендокринни разрушители, които имат естрогенен ефект. DDT е химически тор. Бисфенол А е органично съединение, използвано за получаване на поликарбонатни полимери и епоксидни смоли; Генистеинът е изофлавон, открит в редица растения, включително соя. ДДТ: дихлордифенилтрихлороетан.
В допълнение към тези открития, много други естроген-медиирани пътища могат да бъдат модулирани от ендокринни разрушители. Необходими са допълнителни проучвания, за да се изясни участието на тези химикали.
8. Естрогенна терапия и затлъстяване
Все повече доказателства сега показват, че естрогенната сигнализация може да има важна роля за развитието на затлъстяване при жените в менопауза. Жените в менопауза са три пъти по-склонни да развият аномалии на затлъстяването и метаболитния синдром, отколкото жените в менопауза [155]. Освен това е доказано, че хормонозаместителната терапия, базирана на естроген/прогестин, при жени в менопауза намалява висцералната мастна тъкан, серумната глюкоза на гладно и нивата на инсулин [70, 156]. Естрогените също намаляват сърдечно-съдовите рискови фактори, които се увеличават по време на менопаузата. Следователно, естрогенната терапия може да окаже положително въздействие чрез намаляване на общия холестерол и относителните нива на LDL [157].
Мета-анализ на над 100 рандомизирани проучвания при жени в менопауза анализира ефекта на ХЗТ върху компонентите на метаболитния синдром. Авторите заключават, че при жени без диабет, както орален, така и трансдермален естроген, със или без прогестин, увеличават чистата телесна маса, намаляват коремните мазнини, подобряват инсулиновата резистентност, намаляват съотношението LDL/липопротеин с висока плътност и намаляват кръвното налягане [ 163].
9. Заключение
Конфликт на интереси
Авторите декларират, че няма конфликт на интереси по отношение на публикуването на тази статия.
- Естроген, Доминиране на естрогена, Наддаване на тегло и Дефицит на йод; Мис Лизи Йод и щитовидна жлеза
- Електронен имплант, предназначен да намали затлъстяването, за да се подложи на изпитания - BBC News
- Условия; Затлъстяване и загуба на тегло; Център за подмладяване на мозъка NeuroSpa
- Първото изследване на хора за фекални трансплантации за затлъстяване дава смесени резултати
- Първи удари за отслабване; изстрелване на главната улица след Борис; s Covid затлъстяване блиц