Най-бърз двигател за инспекция на корема
- У дома
- Влизам
- Регистрирам
- Категории
- АБДОМИНАЛНА МЕДИЦИНА
- HEPATOPANCREATOBILIARY
- ГАСТРОЕНТЕРОЛОГИЯ
- ГАСТОИНЕСТИНАЛНА ХИРУРГИЯ
- ОБЩ
- НЕФРОЛОГИЯ
- УРОЛОГИЯ
- относно
- Златно членство
- Още референции
- Коремен ключ
- Ключ за анестезия
- Основенмедицински ключ
- Отоларингология и офталмология
- Мускулно-скелетен ключ
- Neupsy Key
- Ключ за медицинска сестра
- Акушерство, гинекология и педиатрия
- Онкология и хематология
- Пластична хирургия и дерматология
- Клинична стоматология
- Радиологичен ключ
- Торакален ключ
- Ветеринарна медицина
- Контакт
- Стоматологичен ключ
Глава 4.6
Декомпенсирано чернодробно заболяване и хранене
Simran Arora 1, Gillian Gatiss 2, Laura M. McGeeney 2 и Nina C. Powell 2
1 Royal Free London NHS Foundation Trust, Лондон, Великобритания
2 Университетски болници в Кеймбридж NHS Foundation Trust, Кеймбридж, Великобритания
4.6.1 Диетични причини и ефекти от декомпенсирано чернодробно заболяване
Чернодробните заболявания могат да бъдат причинени от различни фактори, както е показано в таблица 4.6.1. До голяма степен симптомите и тежестта на заболяването определят хранителното лечение, а не етиологията.
Таблица 4.6.1 Видове чернодробни заболявания
| Защото | Вид чернодробно заболяване |
| Инфекции | Хепатит А, хепатит В, хепатит С, хепатит D, хепатит Е |
| Токсичен | Свързано с алкохола чернодробно заболяване, предозиране с наркотици, други отрови |
| Холестатичен | Първичен склерозиращ холангит, първична билиарна цироза |
| Метаболитни | Безалкохолно мастно чернодробно заболяване, неалкохолен стеатохепатит, наследствена хемохроматоза, дефицит на алфа-1 антитрипсин, болест на Уилсън |
| Съдови | Синдром на Budd-Chiari |
| Други | Чернодробно заболяване, свързано с муковисцидоза, автоимунен хепатит, криптогенно чернодробно заболяване |
Поради жизненоважната метаболитна роля на черния дроб, загубата на функция има значителни хранителни последици. Съобщаваната честота на недохранване в тази популация варира в зависимост от техниката на оценка и стадия на заболяването; може да достигне до 100% [1–3]. Недохранването засяга важни клинични резултати, включително честотата на варикозно кървене, енцефалопатия, инфекции, асцит, лоша мускулна функция, продължителност на престоя в болница и смъртност [4–7]. Нивото на протеиново-енергийно недохранване (PEM) зависи по-скоро от тежестта на чернодробното заболяване и нивото на хранителен принос в грижите за пациента, отколкото от етиологията.
Факторите, допринасящи за PEM, включват намален прием през устата поради гадене, повръщане, болка, енцефалопатия, ранно засищане (което може да се дължи на натиска на асцит), отнемане на алкохол, периоди на липса през устата за тестове, анорексия, хранителни вещества и течности ограничения, неприятни диети (като диети с много ниско съдържание на сол), променено усещане за вкус и умора. Пациентите с PEM могат също да имат малабсорбция под формата на диария или стеаторея поради холестаза, употребата на редовна лактулоза или промени в GI микробиота след антибиотици и може да имат повишени изисквания за енергия и протеини поради промени в енергийния метаболизъм.
Метаболитни промени при цироза
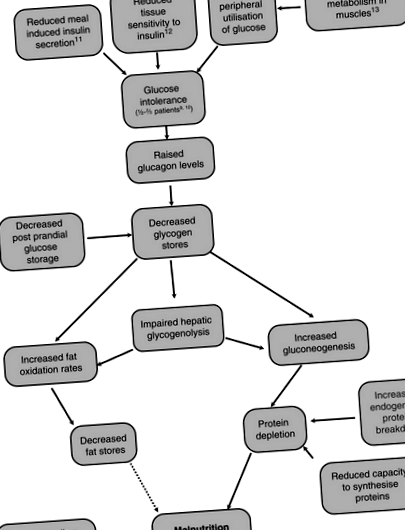
Фигура 4.6.1 показва основните метаболитни промени, които настъпват при човек с цироза и връзките между тях.
Фигура 4.6.1 Основните метаболитни промени, които настъпват при човек с цироза [7–13].
Недохранването при чернодробни заболявания е наречено „заболяване за съхранение на гликоген“, тъй като дори в хранено състояние запасите от гликоген остават ниски [14]. Чернодробната гликогенолиза също е нарушена, което прави гликогена по-малко подходящо гориво за пациенти с цироза. За да се поддържат концентрациите на глюкоза в кръвта в краткосрочен план, когато не е имало скорошен прием на въглехидрати, се увеличава глюконеогенезата от аминокиселини, което води до изчерпване на протеините [15]. Petersen et al. сравнява нивата на глюконеогенеза и гликогенолиза при пациенти с цироза и съпоставя здравите контроли с помощта на ядрено-магнитно-резонансна спектроскопия и 2 H 2 O и установява, че те имат сходни темпове на производство на глюкоза, но пациентите с цироза имат повишена скорост на глюконеогенеза и намалена скорост на гликогенолиза в сравнение с контролни субекти [16]. Мазнините също се използват като алтернативен източник на гориво [17]. Въпреки това, скоростта на окисление на мазнините се връща към нормалното след подхранване [18].
Използвайки индиректна калориметрия, процентът на общата енергия от мазнини, въглехидрати и протеини при контролни субекти след 36–72-часов пост бяха сравними с тези, открити при пациенти с цироза след нощно гладуване (10–12 часа) [19]. Тези пропорции се различават значително от контролните субекти на гладно през нощта. Това показва, че пациентите с цироза достигат на гладно много по-бързо от здравите контроли; цирозата е наречена болест на ускорения глад. Повишеното ендогенно разграждане на протеини води до увеличен белтъчен оборот. Скоростта на ресинтез на протеини обаче не се увеличава и способността на циротичния черен дроб да синтезира и съхранява протеини е намалена, което води до загуба на мускули. Механизмът на този хиперметаболизъм е неясен, но се смята, че е извънхепатален, тъй като продължава повече от година след трансплантация на черен дроб [20].
Не всички пациенти с цироза са хиперметаболитни; тези, които имат подобен процент мускулна маса като нормаметоболните пациенти с цироза, но намалена телесна клетъчна маса [8]. Те също така са повишили серумните цитокини, което показва потенциална роля за възпалителния отговор в хиперметаболитно състояние. Greco и сътр. показа хиперметаболизъм, повишени нива на окисление на липидите и инсулинова резистентност след еднодневно гладуване при пациенти с цироза на Childs B в сравнение със съответстващите здрави контроли [20a]. Индексът на телесна маса (ИТМ), масата без мазнини и мастната маса на пациентите не се различават статистически значително от здравите контроли, което предполага, че метаболитните промени предшестват загубата на тегло, а не са последица от това.
Изхабяването на мускулите може да бъде основна характеристика на цирозата, но с квалифицирана хранителна оценка и терапия това може да се предотврати.
Хранителна оценка
Недохранването може да присъства в ранните стадии на чернодробно заболяване, но не винаги е лесно очевидно, особено при хора с наднормено тегло. Необходима е подробна хранителна оценка, за да се идентифицират хората, които са недохранени или има риск да станат такива. Точната оценка на хранителния статус може да бъде особено трудна при пациенти с цироза поради променена течна хомеостаза. Традиционните методи за хранителна оценка и инструментите за скрининг на храненето често се основават на промени в теглото и ИТМ, но за тази група пациенти се изискват по-специфични мерки за хранителен статус.
Хранителната оценка ще включва преглед на симптомите, медицинска история, социална история, оценка на телесния състав, биохимия, подробен хранителен прием и ограничения на течностите. Симптоми като гадене, анорексия, болка, умора и енцефалопатия могат да намалят хранителния прием, както и всякакви ограничения на течностите. Докато запекът може да доведе до по-голяма вероятност хората да изпитват енцефалопатия, диарията намалява абсорбцията на хранителни вещества и може също така да накара хората да бъдат по-малко склонни да ядат. Медицинската история, включително съпътстващи заболявания като бъбречна недостатъчност, хепатопулмонален синдром или диабет, потенциално ще окаже влияние върху хранителния статус на пациента, както и върху диетичните консултации. Социалното положение на човека, включително финансовото състояние, условията на живот, употребата на алкохол и незаконни наркотици, ще окаже влияние върху неговия хранителен статус. Промените в чернодробните функционални тестове на пациента могат да дадат индикация за подобрение или спад в състоянието им; важно е да се наблюдават електролити при потенциални пациенти със синдром на повторно хранене, а биохимията може да се използва и за наблюдение на състояния като бъбречна недостатъчност.
Когато правите диета, особено важно е да се отбележи моделът на хранителен прием, както и хранителното съдържание и размерите на порциите, като се внимава за честотата и количеството въглехидрати и протеини, консумирани по-специално. Както при всяка друга група пациенти, и тук е важно да се вземат предвид предпочитанията и толерантността на пациентите, ежедневният модел на дейности и всякакви притеснения.
Антропометрия на горната част на ръката
Антропометрията на горната част на ръката, обиколката на средната ръка (MAC), дебелината на кожните гънки на трицепса (TST) и обиколката на мускулите на средната ръка (MAMC) се използват в клиниката или отделението, за да се прави разлика между мастните и мускулните запаси. Тези измервания показват хранителния статус на пациента в сравнение с очакваната популация. Серийните измервания при един пациент на всеки 3–8 седмици са най-полезни, тъй като телесните мазнини трябва да се променят с няколко кг, преди да бъдат открити чрез измерване на кожните гънки [21]. Важно е да сте наясно с грешките между и вътрешно наблюдението. Надеждността и точността могат да бъдат подобрени чрез стандартизиране на техниката на наблюдателя или чрез провеждане на специализирано обучение по антропометрия.
Сила на ръкохватката
Силата на ръкохватката се измерва с помощта на динамометър и е мярка за мускулната функция. Доказано е, че ниската сила на ръкохватката е предиктор за усложнения и лош клиничен резултат при пациенти с цироза [22]. Силата на ръкохватката на пациентите се променя по-бързо от измерената промяна в мускулната маса и може да се оценява ежеседмично, ако е необходимо.
Скрининг на храненето
Инструментите, които структурирано включват информация от няколко източника на пациента, могат да бъдат особено полезни. Глобалната оценка на Royal Free Hospital (RFH-GA), която използва ИТМ (изчислен с помощта на изчисленото сухо телесно тегло), MAMC, хранителен прием и симптоми в алгоритъм [23], има много добра възпроизводимост при интра- и интеробсервър и е валидирана при тази група пациенти [24]. Точното използване на тази оценка изисква специално обучение и може да отнеме час, за да завърши. Инструментът за приоритетно хранене на Royal Free Hospital (RFH-NPT) е разработен и валидиран наскоро. Това има много добра възпроизводимост при интра- и интеробсервър, с диагностична чувствителност 100% и специфичност 73% [25]. Отнема 2-3 минути и малко обучение за завършване, но дава по-малко подробна оценка от RFH-GA. Този инструмент включва наличие/отсъствие на асцит и/или оток с различни последващи въпроси в зависимост от този отговор.
Сухо тегло
Таблица 4.6.2 може да се използва за оценка на теглото на течността и следователно за изчисляване на сухото тегло. Очакваното тегло на асцит и периферен оток се изважда от „мокрото тегло“ на пациента. Пациентите могат да имат асцитен обем, по-голям от 14 kg. Дори при пациенти без асцит или оток, само теглото е груба мярка за хранителен статус, тъй като не прави разлика между мастните и мускулните запаси. За пациенти с асцит, които имат редовна парацентеза, е полезно да се следи колко течност се отстранява по време на всяка сесия на парацентеза, колко течност остава след парацентезата, типично тегло след парацентезата и продължителността от последната парацентеза, за да индивидуализирате оценките на сухото тяло тегло.
Таблица 4.6.2 Оценка на теглото на асцит и периферен оток [26]
| Асцит | Периферен оток | |
| Минимално | 2,2 кг | 1,0 кг |
| Умерен | 6,0 кг | 5,0 кг |
| Тежка | 14,0 кг | 10,0 кг |
Възпроизведено с разрешение от Тейлър и Франсис.
Хранителни изисквания
Когато за поддържане на освобождаването на чернодробна глюкоза се използва по-скоро глюконеогенеза, отколкото гликогенолиза, се увеличават както енергийните разходи в покой (REE), така и нуждите от протеини [19,27]. Глюконеогенезата използва повече енергия от гликогенолизата и изисква аминокиселини като субстрати, поради което се увеличават както енергийните, така и протеиновите нужди за циротика. Хората с чернодробни заболявания могат да напълнят запасите си с увеличен прием [28,29]. Насоките на Европейското общество за парентерално и ентерално хранене (ESPEN) имат за цел 25-40 kcal/kg телесно тегло, но дали се използва сухо, действително или идеално телесно тегло не е договорено (Таблица 4.6.3) [30]. Ако пациентът е недохранван, освен ако не е явно критично болен или септичен, добавянето на допълнителни 400–1000 kcal на ден се насърчава за насърчаване на препълването на магазините.
Таблица 4.6.3 Изисквания към енергия и протеини за хора с чернодробни заболявания
| Стресов фактор a | Енергия kcal/kg dBW/ден | Протеин g/kg dBW/ден | |
| Компенсирани | 0–20% | 25–35 | 1,2–1,3 |
| Декомпенсиран | 30–40% | 35–40 | 1,2–1,5 |
| Остър (фулимант) | 20–30% | | 1,2–1,5 |
| След трансплантация (приблизително 1 месец) | 30% | | 1,2–1,5 |
Във Великобритания енергията (за поддържане на теглото) и нуждите от протеини използват dBW (сухо телесно тегло) [30,31].
фактор на стреса се използва за коригиране на допълнителен метаболитен стрес и умножен по базална скорост на метаболизма или по специфичните kcal/kg за всяко състояние по телесно тегло [30].
Възпроизведено с разрешение от Elsevier.
Запасите от протеини с чиста телесна маса (LBM) се изчерпват чрез използването на аминокиселини за генериране на глюкоза, поради което са необходими допълнителни диетични протеини за поддържане и запълване на LBM. Swart et al. използва радиомаркиран [15 N] глицин за изследване на скоростта на азотен поток, синтез на протеини и разграждане на протеини при хора с цироза и здрави контроли и предложи на пациентите с цироза да се изисква увеличаване на приема на азот, за да се постигне положителен азотен баланс поради тяхното увеличаване на глюконеогенезата 29]. Нуждите от протеин се изчисляват въз основа на изчисленото сухо тегло на пациента и са показани в таблица 4.6.3.
Пациентите, особено ако са вкъщи и са подвижни, може да се наложи да увеличат приема си над тези изчислени изисквания, за да попълнят или поддържат мускулните си запаси. Важно е да се следи редовно хранителният им статус и да се коригират съответно хранителните им препоръки.
При пациенти със затлъстяване нуждите от протеини и енергия се коригират, за да се отчете увеличената телесна маса с вероятно намален процент метаболитно активна тъкан. Във Великобритания нуждите от протеини и енергия намаляват съответно с 25% и 400–1000 kcal на ден. Когато правите такива корекции, е важно пациентите да бъдат редовно наблюдавани, за да може всеки спад в хранителния статус да бъде идентифициран и смекчен. Запазването на мускулната функция и фитнеса на пациента имат приоритет пред всяка цел за намаляване на мастната маса. Насоките на ESPEN не дават насоки специално за пациенти със затлъстяване на черния дроб.
Нуждите от течности рядко се изчисляват от предварително определени изчисления, но се оценяват индивидуално и зависят от състоянието на течността на пациента.
4.6.2 Диетични причини за чернодробна енцефалопатия
Причината за чернодробната енцефалопатия (HE) вероятно е многофакторна и все още не е напълно изяснена. Следователно манипулациите с диетата при ХО се развиха, тъй като по-голямото ниво на доказателства подкрепя или опровергава теориите. Една от първите теории за причината беше, че диетичният протеин причинява НЕ при чернодробна недостатъчност. Следователно, исторически диетично ограничаване на протеини се препоръчва да намали риска и да улесни управлението на НЕ [32]. Това вече не се препоръчва, тъй като изследванията на белтъчния оборот показват, че нуждата от протеин и общата енергийна нужда се увеличават с развитието на краен стадий на чернодробна недостатъчност [3,33]. Ограничаването на приема може да доведе до мускулен катаболизъм и свързаните с това лоши резултати при тези пациенти [34].
Смята се, че нуждата от допълнителен хранителен протеин се обуславя от използването на аминокиселини с разклонена верига (BCAA) за възстановяване на увреждане на черния дроб или използването им за изхвърляне на амоняк [35], намалявайки съотношението на BCAA спрямо ароматните аминокиселини. Освен това, ако допълнителните калорични изисквания не са изпълнени, разграждането на мускулния протеин увеличава циркулиращата концентрация на ароматни аминокиселини (фенилаланин, тирозин) спрямо циркулиращите концентрации на BCAA (левцин, изолевцин, валин). В крайна сметка по-високото съотношение на ароматните аминокиселини към BCAA улеснява движението на ароматните аминокиселини през кръвно-мозъчната бариера, променяйки психичното състояние, свързано с HE. Тази теория се подкрепя допълнително от развитието на HE след стомашно-чревно кървене. Предполага се, че храносмилането на кръв, която има недостиг на изолевцин, аминокиселина с разклонена верига, променя съотношението на ароматните аминокиселини към BCAA, причинявайки остър НЕ [36].
Високата концентрация на стомашно-чревен амоняк е друга теория за причината за ХЕ. По време на периоди на гладно, използването на аминокиселини от мускулите за глюконеогенеза произвежда амоняк. Циркулиращият амоняк се отстранява от мускулната тъкан, поради което загубата на мускулна маса сама по себе си може да изостри развитието на НЕ [37]. Счита се, че диетичните фактори, които могат да променят стомашно-чревната микробиота и да намалят високите концентрации на производство на амоняк, намаляват риска и улесняват управлението на ВО. Диетичните фактори, които са изследвани в този процес, включват лактулоза, пробиотици, растителен протеин и цинк.
4.6.3 Хранителни последици от асцита
Асцитният обем обикновено се определя като лек, умерен или тежък (вж. Таблица 4.6.2), но при някои пациенти може да надвишава 25 литра. Умереният до тежък асцит може да има неблагоприятен ефект върху хранителния статус поради множество фактори (каре 4.6.1).
- Диета и хранене при коремни сраствания - коремно здраве
- Диета и хранене за здравето на черния дроб - днешното диетично списание
- Диета за цироза (NASH) Портална хипертония, Портална венозна тромбоза - Чернодробна болест - Inspire
- Котешка чернодробна болест Какво трябва да знаете Хил; s Домашен любимец
- Диетата с ниско съдържание на добавени захари значително подобрява мастните чернодробни заболявания при деца - ScienceDaily