Резюме
Заден план
При метаболитни нарушения миокардната мастна инфилтрация е критично свързана с липотоксичната кардиомиопатия.
Методи
Двадесет Psammomys obesus gerbils са разпределени на случаен принцип към нормална растителна или високомаслена диета. Шестнадесет седмици по-късно от миокарда се взема проба за патобиологична оценка.
Резултати
Шестнайсетседмична диета с високо съдържание на мазнини доведе до дезорганизация на структурата на миокарда, с отлагания на колаген, натрупване на липиди, апоптоза на кардиомиоцитите и възпалителна клетъчна инфилтрация. Миокардната експресия на глюкозен транспортер GLUT1 и инхибитор на пируват дехидрогеназа (PDH), PDH киназа (PDK) 4 се увеличава, докато експресията на GLUT4, регулирана от инсулин, остава непроменена. Миокардната експресия на молекули, регулиращи транспорта на мастни киселини, CD36 и протеин, свързващ мастни киселини (FABP) 3, се увеличава, докато експресията на β-окислението на мастни киселини, контролираща скоростта, карнитин палмитоил трансфераза (CPT) 1B намалява. Миокардната експресия на AMP-активирана протеин киназа (AMPK) намалява, докато експресията на активираните от пероксизома пролифератор рецептори (PPAR) -α и -γ не се променя.
Заключение
При хранене с високо съдържание на мазнини Psammomys obesus, оригинален експериментален модел на хранително-индуциран метаболитен синдром, смесващ генетична предразположеност и взаимодействия с околната среда, кратък период на хранене с високо съдържание на мазнини е достатъчен, за да предизвика структурни изменения на миокарда, свързани с променена експресия на метаболитен ген на миокарда в полза на липидно натрупване.
Заден план
В нормалното сърце на възрастни мастните киселини са основни субстрати за генериране на АТФ, докато окисляването на глюкозата осигурява по-малък принос за производството на енергия [1]. Освен променен метаболитен профил, хроничната диета с високо съдържание на мазнини допринася за дисрегулиран метаболизъм на глюкоза и мастни киселини, което води до цялостна дисрегулирана енергийна хомеостаза [2]. В сърцето това е свързано с различни адаптации и промени в структурата и функцията на миокарда, възникващи при лица, тъй като мастната тъкан и липидите се натрупват необичайно, дори при липса на съпътстващи заболявания като диабет тип 2 или хипертония [3]. Затлъстяването е свързано с повишено натрупване на липиди в миокарда [4, 5], което е свързано с диастолна дисфункция [6]. Повишените вътреклетъчни нива на триглицеридите в миокарда също са често описани в различни експериментални модели на затлъстяване [7, 8]. Хроничното излагане на високи плазмени нива на свободни мастни киселини може да причини натрупване на токсични липидни междинни продукти в кардиомиоцитите, което е свързано със сърдечната липотоксичност [9]. Механизмите, водещи до индуцирана от затлъстяването кардиомиопатия, остават до голяма степен неизвестни [10].
Поради своята патологична адаптация към излишъка на хранителни вещества, Psammomys obesus е оригинален хранително контролиран и генетично предопределен експериментален модел на затлъстяване и метаболитен синдром [11]. Всъщност върху естествената си диета, съставена от халофилни растения, Psammomys obesus е здрав, с метаболитно-ендокринна система, адаптирана към живота в пустинята. В плен те спонтанно и естествено развиват диабет, дислипидемия и затлъстяване, когато се хранят със стандартна лабораторна диета с гризачи за гризачи [11]. Тази патологична адаптация към излишък на хранителни вещества може да представлява надежден експериментален модел за изследване на механизмите, залегнали в основата на предразположението за развитие на инсулинова резистентност и метаболитен синдром при хора, които се развиват от недостиг до обилен прием на храна [12]. При тези животни кратък период от време с диета с високо съдържание на мазнини е довел до важно наддаване на тегло и повишени нива на циркулиране на мастни киселини, както и променена експресия на миокарда на протеините за свиване, обработващи калция [13].
В този контекст целта на настоящото проучване е да изследва дали диетата с високо съдържание на мазнини може да предизвика сърдечни промени в структурата, енергийния метаболизъм и жизнеспособността на кардиомиоцитите при тези диви гризачи с генетична предразположеност за развитие на затлъстяване.
Методи
Животински модел
Възрастен Psammomys obesus gerbils бяха уловени в алжирския регион Beni-Abbes (30 ° 7 географска ширина на север и 2 ° 10 дължина на запад) и настанени в отделни клетки в 12-часов цикъл светлина/тъмнина в продължение на 2 седмици. През този период на аклимация животните са били хранени с естествената си храна, съставена от халофилни растения [14, 15]. След това осемседмичните гербили с тегло 93 ± 9 g, разделени по пол, бяха разделени на 2 групи, както следва: 1) контролните животни бяха хранени с нормална диета от естествени халофилни растения (Salicornia; състав на халофилните растения: вода 80,8 g; минерални соли 6,9 g; липиди 0,4 g; протеини 3 g; въглехидрати 8,4 g и 45–50 kcal/100 g); 2) другата група животни е получила диета с високо съдържание на мазнини, включваща халофилни растения плюс ежедневно добавяне на една четвърт (5 g) варен яйчен жълтък (състав на сварен яйчен жълтък: вода 40–46 g; протеини 13,5–17,5 g; въглехидрати 0,2 g; липиди 30–31 g; холестерол 1,2–1,3 g и 370–400 kcal/100 g) в продължение на 16 седмици.
На изходно ниво и след шестнадесетседмична диета с високо съдържание на мазнини, животните бяха обезкървени от ретроорбиталния венозен плексус. Кръвните проби веднага се центрофугират при 3000 rpm върху изсушени епруветки. В края на протокола животните бяха умъртвени чрез обезглавяване. Сърцата бяха незабавно дисектирани, бързо замразени в течен азот и държани при - 80 ° C за патобиологичен анализ (н = 10 във всяка група) или след тридневно фиксиране във водния разтвор на Bouin, вграден в тото в парафин за хистопатологична оценка (н = 10 във всяка група).
Биохимичен анализ
Концентрациите на глюкоза, триглицериди и общ холестерол се определят с комплекти BIOSYSTEM (Барселона, Испания) в плазмени проби, съгласно инструкциите на производителя. Плазма се използва за анализ на липопротеини върху агарозен гел по метода на Kalwakami [16]. Плазмените нива на креатин фосфокиназата (CPK) бяха измерени с помощта на анализатор COBAS INTEGRA (Roche; CA, USA).
Сърдечна морфометрия
Петмикронни миокардни разрези бяха взети по надлъжната ос на сърцето и оцветени с хематоксилин-еозин за цялостен морфологичен анализ, както беше описано по-рано [17]. Оцветяването на Masson’s Trichrome се използва за оценка на натрупването на колаген и фиброзата в миокардните секции.
Имунохистохимия: Откриване на миокардни клетки, подложени на апоптоза
Сърдечните апоптотични клетки бяха открити чрез терминална деоксинуклеотидил трансфераза dUTP Nick-End маркиране (TUNEL) с помощта на ApopTagPlus пероксидаза На място Комплект за откриване на апоптоза (Chemicon, Temecula, CA), съгласно инструкциите на производителя. Тестван е отрицателен контрол без TdT ензим и положителен контрол, предварително обработен с DNase-I. За всяка сърдечна проба бяха изследвани десет различни произволно избрани полета. Сърдечната апоптотична скорост се изчислява като съотношението на апоптотичните ядра (TUNEL-положителни или кафяви ядра) към общите ядра (кафяви + сини ядра) (× 100 да се изрази в проценти). Всички преброявания бяха извършени от двама независими следователи по заслепен начин. За анализ беше използвана средна стойност.
Количествена полимеразна верижна реакция в реално време (RTQ-PCR)
Обща РНК беше извлечена от замразена на бързо миокардна тъкан с помощта на комплект QIAGEN RNeasy®Mini (QIAGEN, Hilden, Германия), съгласно инструкциите на производителя. Концентрацията на РНК се определя чрез стандартна спектрофотометрична техника и целостта на РНК се оценява чрез визуална проверка на оцветени с GelRed (Biotium, Hayward, California) агарозни гелове. Обратната транскрипция беше извършена с използване на произволни хексамерни праймери и Superscript II Reverse Transcriptase (Invitrogen, Merelbeke, Белгия), съгласно инструкциите на производителя.
За RTQ-PCR са създадени смислени и антисмислени праймери (Таблица 1) с помощта на програма Primer3 за Rattus norvegicus семейство разтворени носители 2 членове 1 (Slc2a1 или GLUT1) и 4 (Slc2a4 или GLUT4), карнитин палмитоилтрансфераза1В (CPT1B), транслоказа на мастни киселини CD36, свързващ протеин 3 на мастни киселини (FABP3), активирани рецептори на пероксизомен пролифератор (PPAR) -алфа и - гама, AMP-активирана протеин киназа (AMPK), пируват дехидрогеназа киназа (PDK) 4, разединяващ протеин (UCP) 3, инсулинови рецепторни субстрати (IRS) 1 и 2, натриуретичен пептид B (NPPB) и хипоксантин фосфорибозил трансфераза (HPRT) 1 тРНК последователности. За да се избегне неподходящо усилване на остатъчна геномна ДНК, бяха избрани праймери, обхващащи интрон, когато бяха известни екзонови последователности. За всяка проба се извършва реакция на амплификация в три екземпляра, използвайки SYBR Green PCR Master Mix (Quanta Biosciences, Gaithersburg, MD, USA), специфични праймери и разредена матрична кДНК. Анализът на резултатите беше извършен с помощта на iCycler система (BioRad Laboratories). Относително количествено определяне беше постигнато със сравнителния метод 2 -ΔΔCt чрез нормализиране с домакинския ген (HPRT1). Резултатите бяха изразени като относително кратно увеличение спрямо средната стойност на относителна експресия на иРНК на 16-седмична нормална диета, хранена контролна група, произволно фиксирана на 1.
Статистически анализ
Всички данни са изразени като средна стойност ± стандартна грешка на средната стойност (SEM). Статистическите анализи бяха извършени с помощта на софтуера StatView 5.0. Междугруповите различия бяха оценени чрез еднопосочен дисперсионен анализ (еднопосочен ANOVA), последван от t-тест на Student. стр
Резултати
Хроничната диета с високо съдържание на мазнини причинява наддаване на телесно тегло и системна хиперлипидемия
Както е илюстрирано в Таблица 2, изходното телесно тегло и биохимичните параметри са сходни между двете проучвани групи на Psammomys obesus гербили. След шестнайсетседмична диета с високо съдържание на мазнини телесното тегло се е увеличило повече, отколкото при нормално хранените животни (Таблица 2).
По отношение на биохимичните параметри, шестнайсетседмичната диета с високо съдържание на мазнини е свързана с повишени плазмени нива на липиди, включително триглицериди, общ холестерол, ниска плътност (LDL-c) и липопротеинов холестерол с висока плътност (HDL-c) (Таблица 2) . Изчислени са плазмените атерогенни индекси на риска Castelli’s -I (оценени като съотношение между общия холестерол и HDL-холестерол) и -II (оценени като съотношението между LDL-холестерола и HDL-холестерола). Установено е, че те са значително увеличени след шестнайсетседмична диета с високо съдържание на мазнини (Таблица 2). Имаше само тенденция (но не значима) към по-високи плазмени нива на глюкоза (повишени с 32% в сравнение с нормалната диета) (Таблица 2). Повишени са плазмените нива на CPK (Таблица 2).
Миокардната архитектура е променена след шестнайсетседмична диета с високо съдържание на мазнини
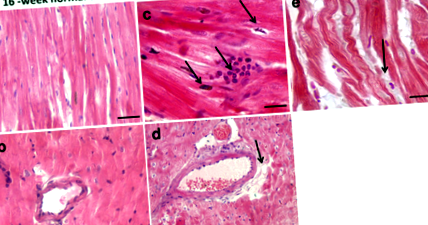
Както е илюстрирано на фиг. 1а и b, оцветяването с хематоксилин и еозин показва нормална хистологична сърдечна архитектура с миофибрили и мускулни снопчета в миокардни участъци от нормално хранени животни. След шестнайсетседмична диета с високо съдържание на мазнини се наблюдава натрупване на инфилтриращи възпалителни клетки в миокарда и апоптоза на сърдечните миоцити (фиг. 1в). Това е свързано с натрупване на липиден депозит в миокарда (фиг. 1г и д), което категорично предполага, че липотоксичността на миокарда вероятно допринася за депресирана сърдечна функция и кардиомиопатия [18].
Представителни хематоксилинови и еозиново оцветени миокардни секции от Psammomys obesus гербили, хранени с нормална диета (а, б) или диета с високо съдържание на мазнини (c-e) в продължение на 16 седмици. Миокардните разрези са получени 1000 пъти (а-д; Мащабни пръти: 20 μm) и 400 пъти (д; Скала: 50 μm) увеличение. При нормални животни, хранени с диета, миокардните разрези показват нормална хистологична сърдечна архитектура с миофибрили и мускулни снопчета (а, б). При 16-седмична диета с високо съдържание на мазнини, хранени с хематоксилин и еозин оцветени миокардни секции показват инфилтриращи възпалителни клетки (° С) и натрупване на липиди (д, д)
За да се оцени фиброзата и отлагането на колаген, беше извършено оцветяване на Masson’s Trichrome. При животни, хранени с нормална диета, сърдечните клетки са подредени подредено, със структурирана организация на сърдечните мускулни влакна и малко отлагане на колагенови влакна дори в периваскуларната област (фиг. 2а и б). Шестнадесетседмична диета с високо съдържание на мазнини предизвиква структурна дезорганизация на миокарда със загуба на кардиомиоцити (фиг. 2в и д), дифузна миокардна интерстициална (фиг. 2д) и периваскуларна фиброза (фиг. 2в и г), свързана с натрупване на миокардни инфилтриращи клетки (фиг. 2д) и липидни отлагания (фиг. 2е).
Представител на оцветените трихромни миокардни участъци на Masson от Psammomys obesus гербили, хранени с нормална диета (а, б) или с диета с високо съдържание на мазнини (c-f) в продължение на 16 седмици. Оцветяването с трихром Масон беше извършено за откриване на фиброзни области (колагенови влакна, оцветени в зелено; обозначени със стрелки в а-д). Миокардните срезове бяха получени 400 пъти (a-e; скала: 50 μm) и 1000 пъти (е; скала: 20 μm) увеличение. При животни, хранени с нормална диета, сърдечните клетки са подредени подредено, със структурирана организация на сърдечните мускулни влакна и малко отлагане на колагенови влакна (а, б). При 16-седмични животни, хранени с високо съдържание на мазнини, миокардните разрези, оцветени с трихром Масън, показват дифузна фиброза (най-вече в периваскуларните зони; ° С и д) и отлагане на липиди (е)
Апоптозата на кардиомиоцитите е предизвикана от шестнайсетседмична диета с високо съдържание на мазнини
За да се оцени дали това натрупване на липиди в миокарда може да бъде свързано с апоптоза на сърдечните клетки, беше извършено оцветяване с TUNEL в миокардни секции. Както е илюстрирано на фиг. 3а, шестнайсетседмичната диета с високо съдържание на мазнини предизвиква дифузна апоптоза в кардиомиоцитите. Скоростта на апоптоза е увеличена в миокарда на Psammomys obesus хранени с диета с високо съдържание на мазнини (фиг. 3б).
Диетата с високо съдържание на мазнини променя миокардната експресия на молекули, замесени в метаболизма на глюкозата и липидите
За да се определят ефектите от относително кратък период на диета с високо съдържание на мазнини върху профила на експресия на гени, модулиращи производството на сърдечна енергия, включително сърдечния метаболизъм на глюкоза и мастни киселини, както и инсулиновата сигнализация, бяха проведени експерименти RT-QPCR. Шестнайсетседмичната диета с високо съдържание на мазнини увеличава експресията на миокарден ген на основния глюкозен транспортер GLUT1, докато експресията на GLUT4, регулиран от инсулина улесняващ транспортер на глюкоза, остава непроменена (Фиг. 4а). Миокардната експресия на CD36, основен клетъчен регулатор на транспорта на мастни киселини, и FABP3, вътреклетъчен протеин, свързващ мастни киселини, участващ в усвояването на мастните киселини и вътреклетъчния транспорт, бяха увеличени, докато експресията на контролиращия скоростта ензим на β-окислението на мастната киселина път, CPT1B, намалява (Фиг. 4b). Всички тези резултати предполагат променен профил на експресия на миокарда на медиаторите за производство на енергия в полза на усвояването и натрупването на мастна киселина в миокарда (намалено β-окисление на мастните киселини) след шестнайсетседмична диета с високо съдържание на мазнини в Psammomys obesus гербили.
За да се разберат по-добри механизми, контролиращи експресията на тези метаболитни медиатори, бяха оценени експресията на ядрени транскрипционни фактори и ензими, замесени в регулирането на метаболизма на липидите и глюкозата и диференциацията на адипоцитите. Както е илюстрирано на фиг. 4в, миокардната експресия на PPAR-α и -γ не се променя след хронична диета с високо съдържание на мазнини. Експресията на AMPK, клетъчен енергиен сензор и на UCP3, митохондриален транспортер, замесен в контрола на енергийния баланс, намалява в сърцето на животни, хранени с диета с високо съдържание на мазнини, докато експресията на PDK4, който фосфорилира (и по този начин деактивира) пируват дехидрогеназа (PDH) и инхибира окисляването на глюкозата, беше увеличен (Фиг. 4г). Миокардната експресия на IRS1 и 2 не се променя (фиг. 4д).
Миокардна експресия на ген, реагиращ на разтягане на стената, натриуретичният пептид В (BNP)
Когато сърцето е разтегнато, концентрацията на BNP се увеличава значително, което показва, че сърцето работи по-усилено и има по-големи проблеми с удовлетворяването на нуждите на тялото, например при сърдечна недостатъчност [19]. В настоящото проучване генната експресия на NPPB, предшественикът на BNP, беше увеличена в миокарда на диети, хранени с високо съдържание на мазнини (Фиг. 5).
Дискусия
Настоящите резултати показват, че 16-седмичната диета с високо съдържание на мазнини води до тежки промени в сърдечната структура, с натрупване на колаген и липиди и дифузно активиране на апоптотични процеси в Psammomys obesus гербили, диви гризачи с генетично предразположение към развитие на затлъстяване, диабет и метаболитен синдром. Това е свързано с променена сърдечна експресия на молекули, регулиращи енергийния метаболизъм в полза на сърдечното натрупване на липиди, с повишени експресии на CD36 и FABP3, както замесени в клетъчния транспорт на мастни киселини, така и на PDK4, ключов регулатор на окисляването на глюкозата, докато експресиите на CPT1B, контролиращият скоростта ензим на β-окислението на мастните киселини и на ключовия клетъчен енергиен сензор AMPK намалява.
Проучете силата и ограниченията
Psammomys obesus е оригинален хранително контролиран и генетично предопределен експериментален модел на метаболитен синдром, който е свързан с трайни биологични промени в миокарда [13]. Въпреки това, сърдечната функция и плазмените нива на кардиоспецифичните биомаркери не са оценени сами по себе си. Това трябва да бъде оценено в по-нататъшни проучвания.
Заключения
В заключение, след шестнадесетседмична диета с високо съдържание на мазнини, сърцето на Psammomys obesus показа признаци на липотоксична кардиомиопатия, характеризираща се с метаболитно ремоделиране и вредно метаболитно превключване, водещо до натрупване на липиди. Този уникален експериментален модел на хранително-индуциран метаболитен синдром ни позволи да повлияем миокарда на диетата с високо съдържание на мазнини при животни с генетично предразположение, за да развием бързо затлъстяване, диабет тип 2 и метаболитен синдром. Може да се окаже полезно за изследване на механизмите, лежащи в основата на предразположението за развитие на инсулинова резистентност и метаболитен синдром при хора, които еволюират от недостиг до обилен прием на храна.
Наличност на данни и материали
Всички релевантни данни, генерирани и анализирани по време на настоящото проучване, включват настоящата статия.
- Диетата с високо съдържание на киселини може да има отрицателни ефекти върху здравето на бъбреците - ScienceDaily
- Диетата с високо съдържание на мазнини променя механизма на енергийна хомеостаза, индуцирана от никотин и отнемане в
- Висококалорични закуски като част от диета срещу рак Станфордски здравни грижи
- Високо кръвно налягане и диета UF Health, University of Florida Health
- Храни с високо съдържание на протеини във вашата диета срещу рак Станфордски здравни грижи