Субекти
Тази статия е актуализирана
Резюме
Тъй като съвременните храни са неестествено обогатени с единични метаболити, важно е да се разбере кои метаболити се усещат от човешкото тяло и кои не. По-рано показахме, че стеариновата киселина на мастната киселина (C18: 0) сигнализира по специален път за регулиране на активността на митофузина и по този начин на митохондриалната морфология и функция в клетъчната култура. Дали този път е готов да усети промени в хранителния прием на С18: 0 при хора, не е известно. Тук показваме, че поглъщането на C18: 0 бързо и стабилно причинява митохондриално сливане при хора в рамките на 3 часа след поглъщането. Приемът на C18: 0 също води до спад в циркулиращите дълговерижни ацилкарнитини, което предполага повишено бета-окисление на мастните киселини in vivo. По този начин работата идентифицира С18: 0 като хранителен метаболит, който се усеща от нашите тела, за да контролира нашите митохондрии. Това може да обясни част от епидемиологичните разлики между C16: 0 и C18: 0, при което C16: 0 увеличава сърдечно-съдовия и раковия риск, докато C18: 0 намалява и двете.
Въведение
В рамките на метаболитния клас мастни киселини епидемиологичните проучвания установяват, че различните мастни киселини имат различни биологични последици при поглъщане. Наситените мастни киселини като цяло и по-специално палмитиновата киселина (С16: 0) са вредни отчасти, защото повишават риска от LDL холестерол и атеросклероза 7. Диетичната стеаринова киселина (C18: 0) обаче не увеличава риска от атеросклероза и, ако изобщо, реално намалява LDL холестерола 7,8,9,10. Всъщност повишените нива на циркулиращите липиди С18: 0 са свързани с намалено кръвно налягане, подобрена сърдечна функция и намален риск от рак 11,12,13,14,15. Следователно за разлика от другите наситени мастни киселини и противно на общоприетото схващане, че наситените мастни киселини са вредни, C18: 0 изглежда има някои благоприятни ефекти върху човешкото здраве. Молекулните механизми на това обаче не са ясни.
Резултати
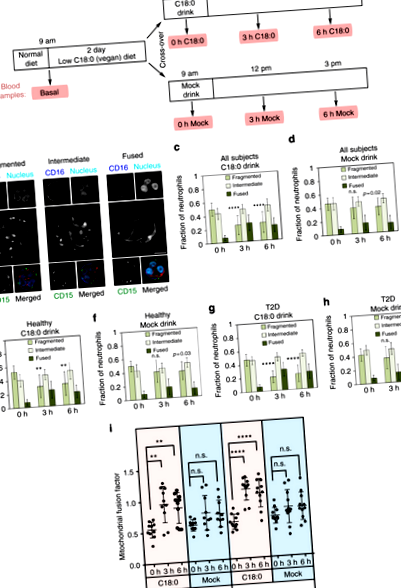
C18: 0 поглъщането причинява сливане на митохондриите
Нивата на C18: 0 в кръвта корелират с митохондриалната морфология
Тъй като неутрофилните митохондрии се сливат след поглъщане на C18: 0, това предполага, че серумните нива на C18: 0 са се увеличили след хранене с C18: 0. За тази цел определихме количествено мастните киселини, присъстващи в серумните триацилглицериди (TAG, фиг. 2a – d и допълнителна фиг. 3). Както се очаква, нивото на C18: 0 в серумните триглицериди (C18: 0-TAG) спадна значително след 2 дни веганска диета с ниско съдържание на мазнини (фиг. 2а) и се увеличи при поглъщане на напитката C18: 0, но не и фиктивна напитка (фиг. 2б, в). Интересното е, че нивата на C16: 0-TAG не спадат след 2 дни от диетата, въпреки че диетата е с ниско съдържание на мазнини (фиг. 2г), което предполага, че нивата на циркулиращи C16: 0 са по-буферирани в телата ни. Циркулиращият C16: 0-TAG също не се е увеличил в отговор на подаването на C18: 0 („3 h“ срещу „0 h“, фиг. 2г). Заедно тези данни показват, че циркулиращите нива на C18: 0 реагират на остри промени в диетата и че те са по-отзивчиви от C16: 0.
Серумните нива C18: 0-TAG отговарят на диетичния прием на C18: 0 и корелират с сливане на митохондриите. а Нивата на серумен C18: 0, присъстващ в триглицеридите (“C18: 0-TAG”) значително спада след 2 дни диета с нисък C18: 0. (Данните се нормализират до C16: 0-TAG нива, н = 21 субекта, *стр ≤ 0,05 от т-тест.) б, ° С Нивата на серума C18: 0-TAG се увеличават след консумация на напитка C18: 0, но не и на фалшивата напитка. б C18: 0-TAG, нормализиран до C16: 0-TAG, тъй като C16: 0 е изобилен и нивата на циркулация са стабилни. ° С Моларен процент C18: 0-TAG. (н = 21 теми, грешки = std. разработчик *стр ≤ 0,05, ***стр ≤ 0,001, ****стр ≤ 0,0001 от т-тест) д Приемът на C18: 0 не влияе на нивата на C16: 0-TAG. (н = 21 теми, грешки = std. разработчик) д-i Сливането на митохондрии в неутрофили корелира със серумните нива C18: 0-TAG (д-з), но не и C16: 0-TAG нива (i) за всички субекти, времеви точки и диетични условия. (н = 21 субекта × 7 времеви точки = 147 серумни проби)
C18: 0 поглъщането намалява циркулиращите ацилкарнитини
C18: 0 ефекти в средносрочен план
Дискусия
Методи
Дизайн на кръстосаното клинично проучване
Изследването е проведено в Катедрата по ендокринология на Университетската болница в Хайделберг и е одобрено от местната комисия по етика (Комитет по етика на Медицинския факултет в Хайделберг: Номер на пробен код S-675/2015). Изследването е регистрирано в ClinicalTrials.gov с идентификатор NCT02957838. Участниците в проучването са предоставили писмено информирано съгласие.
Размерът на изследването е проектиран в консултация с биометрик Йоханес Крисам (в „Благодарности“), въз основа на данни от пилотно проучване и с използване на формули за кръстосани изследвания от реф. 24. Тези изчисления показаха, че за достигане на значимост от 0,01 и мощност от 95% са необходими 10 участника на група. Поради това проверихме 284 амбулаторни пациенти от Отделението по ендокринология (вж. Допълнителна фигура 1), 108 от които отговаряха на условията и по този начин бяха установени контакти. Ако приемем, че ще има приблизително 50% отпадане, ние наехме 20 субекта на група, които дадоха устно съгласие. В крайна сметка 12 здрави контроли и 11 диабетици тип 2 са дали писмено съгласие. Набраните пациенти с диабет тип 2 не се нуждаят от лечение с инсулин и все още не са имали тежки усложнения. Нито диабетиците тип 2, нито участниците в контролата са страдали от други тежки заболявания като рак или анемия. Базовите характеристики на групите са предоставени в допълнителни данни 1–2. Две здрави контроли предпочетоха да не повтарят втората група на кръстосаното проучване, но не оттеглиха съгласието си относно данните, генерирани в първия кръг. Следователно бяха анализирани данните от останалите 10 здрави контроли, които завършиха и двата рамена от изследването.
Приготвяне на банановите шейкове
За напитката C18: 0 24 g C18: 0, предназначени за консумация от човека (стеаринова киселина, Sigma-Aldrich W303518) се смесват със 100 ml нискомаслено мляко. Това количество C18: 0 е избрано чрез изчисляване на съдържанието на C18: 0 в храна с високо съдържание на мазнини 19. Сместа се микровълнова за емулгиране на мастната киселина. Добавя се един малък банан и цялата смес се хомогенизира с ръчен пасатор. Обемът беше допълнен до 250 ml с повече нискомаслено мляко. Присмехулната напитка се приготвя по същия начин без мастни киселини. За напитката С16: 0 вместо това се добавят 21,56 g (равно на моларно количество до 24 g С18: 0) С16: 0, предназначени за консумация от човека (палмитинова киселина, Sigma-Aldrich W283207). Приготвят се млечни шейкове приблизително 90 минути преди консумация.
Вземане на проби
Кръвта се взема с помощта на комплекти игла за пеперуди във всеки момент от различно място. Няколко епруветки бяха напълнени с различни количества кръв за следните цели: (1) една беше напълнена с 4,5 ml, за да се извлече левкоцитна пелета след лизис на еритроцити, която се съхранява при -80 ° C, (2) по-малка тръба EDTA (Sarstedt S -Monovette® 2,7 ml K3E) беше напълнен с 1 ml кръв за митохондриална морфология с точкуване чрез флуоресцентна микроскопия, (3) за запазване на серумни проби, 4 ml кръв бяха изтеглени в Sarstedt S-Monovette® 7,5 ml Z епруветка, след което се центрофугираха на 2500ж за 10 минути, аликвотни и съхранявани при -80 ° C, (4) за анализ на инсулин, 2 ml кръв се изтеглят в епруветка на Sarstedt S-Monovette® 7,5 ml Z-Gel и (5) за други серумни параметри 2 ml кръв се поставят в Sarstedt S-Monovette® 7,5 ml LH-гел. И двете епруветки №4 и №5 бяха подадени в съоръженията за анализ с висока производителност на Централната лаборатория на университета в Хайделберг, която е акредитирана в съответствие с DIN EN ISO 15189. На „базалния“ ден, допълнително Sarstedt S-Monovette® 2.7 ml K3E епруветката е пълна с 2 ml за преброяване на клетки с висока производителност чрез система за хематология на Siemens ADVIA 120 и измерване на HbA1c чрез Biorad Variant II Turbo.
Оцветяване и изображения на неутрофилна митохондриална морфология
Изчисляване на митохондриалния фактор на сливане
Изчислява се фракцията на неутрофилите с фрагментирани, междинни и слети митохондрии и след това се използва следната формула: фактор на сливане на митохондриите = 1 × част от неутрофилите с междинни митохондрии + 2 × част от неутрофилите със слети митохондрии.
статистически анализи
Вземане на данни: Данни от двамата здрави субекти, които не са попълнили и двата рамена от проучването, не са използвани. В противен случай за всички статистически анализи бяха използвани всички налични данни и нито една не беше изключена.
Значимостта на промените, наблюдавани на фиг. 1в, д, g, е потвърдена чрез използване на симплексни графики (допълнителна фиг. 2). Симплексните графики позволяват изобразяването на данни с множество променливи, които се сумират до константа. В този случай фракциите на неутрофилите с фрагментирани, междинни или слети митохондрии от една кръвна проба се събират до 1. В графиките всеки индивид е цветно кодиран с определен цвят, който се запазва един и същ във времевите точки (допълнителна фигура 2) . С R пакет, който е описан в референции. 25,26, центрирани равнинни трансформации бяха приложени за картографиране на данните изометрично в едномерно евклидово векторно пространство и след това беше монтиран линеен модел на смесен ефект за всеки композит, за да се тества ефектът от напитките (C18: 0 срещу макет). Този метод директно оценява статистическата значимост на разликата между C18: 0 и фалшивите напитки по отношение на промените в митохондриалната морфология във времеви точки. (н = 21 субекта, от които 10 здрави и 11 диабетици тип-2.)
Тестът на Ман-Уитни беше използван за тестване на значимостта в допълнителни фигури 6а, b, g, h и допълнителна фигура 7, тъй като всеки от тези фигурални панели представлява данни от един субект. За всяка кръвна проба се оценяват 60 неутрофила, както следва: 1 (фрагментирани), 2 (междинни) и 3 (слети). След това в Microsoft Excel беше приложен непараметричният тест на Mann-Whitney, за да се оцени значимостта в промяната в разпределението на резултатите от неутрофилните проби между пробите. Следователно само в тези панели се прилага статистически тест за разпределението на десетките отделни неутрофили.
За Фиг. 2e – i и 3c, d, корелации и тяхното значение (двустранно стр) бяха изчислени с теста на Пиърсън в GraphPad Prism.
Значимостта на липсата на митохондриално сливане, причинена от С16: 0, беше тествана, както следва. Нулевата хипотеза, която трябва да бъде отхвърлена, е, че ефектът от поглъщането на C16: 0 не е по-нисък от този при поглъщането на C18: 0. C18: 0 причинява митохондриално сливане при 19 от 21 субекта. (Сливането на митохондриите се определя като увеличаване на фактора на сливане на митохондриите (mff) с най-малко 0,19, което е 1,64 стандартни отклонения на факторите на сливане на митохондриите, наблюдавани след 0 часа, съответстващи на степен на фалшиво откриване от 5%.) От 90 г. % от всички субекти (19 от 21) са отговорили на поглъщането с C18: 0, има 10% вероятност субектът да не слее митохондриите си при поглъщане на C18: 0. Ако C16: 0 се държи като C18: 0, бихме очаквали 10% от субектите да не сливат своите митохондрии случайно при поглъщане на C16: 0. Вместо това 5 от 5 субекта не са слели своите митохондрии след поглъщане на C16: 0, което има вероятност да се случи от (10%) 5 = 10 −5. Следователно ние отхвърляме нулевата хипотеза, че C16: 0 причинява митохондриално сливане като C18: 0.
Многовариантният линеен регресионен анализ беше извършен със софтуер за статистически анализ на SPSS с фактор на митохондриален синтез като зависима променлива и всички параметри, показани в Допълнителни данни 3 като независими променливи, използвайки параметри по подразбиране и доверителен интервал = 95%.
Количествено определяне на липидите с GC/MS
Липидите се екстрахират от 400 μL серум чрез добавяне на 600 μL KH2PO4, последвано от 1 ml метанол (Sigma 646377) и накрая 3 ml хлороформ (Sigma 650471) в 7 ml винтова тръба (SLS TUB1202). Вътрешните стандарти бяха добавени към хлороформа и бяха, както следва: FFA, деутерирана тридеканова киселина (C13D25O2H, Cambridge Isotopes DLM1392), 20 μg; Триглицериди 1,2,3-трихептадеканоилглицерол (Sigma), 40 μg; Фосфолипиди, 1,2-диундеканоил-sn-глицеро-3-фосфохолин (Avanti полярни липиди), 40 μg. Пробите бяха завихрени за 2 минути, след това центрофугирани за 10 минути при 720 g. Долният слой се събира и се прехвърля в нова 7 ml стъклена епруветка и се суши под азот.
Липидните класове се разделят чрез екстракция с твърда фаза. За да се извърши екстракцията в твърда фаза, липидите бяха ресуспендирани в 1 ml хлороформ и прехвърлени в аминопропил (NH2) BondElut твърдофазни екстракционни колони (Agilent, 12113014). Потокът се събира заедно с две промивки с 1 ml хлороформ и се суши под азотен поток. Потокът съдържа неутралната липидна фракция. Фосфолипидите се елуират от колоната чрез добавяне на 2 ml 60:40 хлороформ метанол. Накрая FFAs се елуират, използвайки 100: 2: 2 Хлороформ: Метанол: Ледена оцетна киселина. Всички фракции бяха изсушени под азот.
За да се дериватизират пробите в метилови естери на мастни киселини, 875 μL смес от хлороформ (Sigma 650471): метанол (Sigma 646377): разтвор на бор трифлуорид-метанол (Sigma 134821) (15: 19: 1 v/v/v) добавя се към изсушените липиди в 7 ml стъклени епруветки. След това епруветките бяха запечатани и инкубирани във фурна при 80 ° С в продължение на 90 минути. След охлаждане на пробите бяха добавени 1 ml хексан (Sigma 34859) и 500 μL вода (Sigma 34877) и пробите бяха завихрени и центрофугирани при 720ж при стайна температура за 5 минути. Горният органичен слой се прехвърля в стъклени флакони с автопроби и се суши под азотен поток. Пробите се разтварят в 1 ml хексан преди анализа на газова хроматография.
Газова хроматография се извършва на Agilent 7890B GC, като се използва колона Thermo Scientific TR-FAME (дължина: 30 m, вътрешен диаметър: 0,25 mm, размер на филма: 0,25 µm) с хелий като газ-носител (1,9 ml/min). FAME бяха открити с помощта на 5977A MSD. Температурата на входа и MSD бяха настроени на 230 ° C. Използваните температурни стъпки на програмата на фурната бяха както следва.
Колоната се държи при 100 ° С в продължение на 2 минути, след това температурата се повишава до 150 ° С със скорост 25 ° С/минута. Температурата беше допълнително повишена до 162 ° С със скорост 2,5 ° С/мин, с време на задържане от 3,8 минути. Впоследствие температурата се повишава до 173 ° С при скорост 4,5 ° С/мин, последвано от време на задържане от 5 минути. Температурата на колоната беше допълнително повишена до 210 ° С със скорост 5 ° С/мин. И накрая, температурата се повишава до 230 ° С със скорост 40 ° С/мин, последвано от време на задържане от 0,5 минути. Температурата на трансферната линия беше зададена на 240 ° C, а източникът на йони беше на 250 ° C, работещ при 70 eV за електронна йонизация (EI). Детекторът беше иницииран след 240 s и пълните сканиращи спектри бяха събрани в диапазон от 50-650 м/z.
За да се идентифицират пиковете на FAME, времената на задържане на пиковете в пробите се сравняват с тези във външните стандарти (Restek 35077 FAME смес от хранителната промишленост и Supelco 46904 Vaccenic Methyl ester), като се използва количествен анализ на MS (Agilent). Площите на специфичните йони за всяка мастна киселина бяха използвани за количествено определяне, като фонът беше изваден към стойностите на празни проби. Количеството на даден метилов естер на мастна киселина беше определено с помощта на стандартна крива, генерирана с помощта на външния стандарт и нормализирана до съответния вътрешен стандарт за дадената фракция. Данните се изразяват като моларни%, което се изчислява чрез разделяне на всеки отделен метилов естер на мастна киселина на всички открити мастни киселини в дадена проба.
Количествено определяне на ацилкарнитини
Ацилкарнитини се определят в серум чрез електроспрей йонизационна тандемна масспектрометрия (ESI-MS/MS) съгласно модифициран метод, както е описано по-горе 27, като се използва тройният квадруполен масспектрометър Quattro Ultima (Micromass, Манчестър, Великобритания), оборудван с електроспрей йонен източник система за данни на Micromass MassLynx. По-специално, 5 µl плазма се поставят върху 4,7 mm филтърна хартия, изсушават се при стайна температура в продължение на една нощ и се екстрахират със 100 µl маркиран с деутерий стандартен разтвор в метанол 27 .
Други измервания на кръв и серум
Метилглиоксалът беше измерен съгласно реф. 28. Човешкият серумен хепцидин беше измерен, като се използва „Bioactive hepcidin 25 ELISA kit“ (DRG International), следвайки инструкциите на производителя. Концентрацията на хепцидин се екстраполира спрямо стандартна крива, като се използва логистичният модел с четири параметъра на софтуера Graphpad Prism v7. Всички останали кръвни параметри са измерени от центъра за клиничен анализ на Централната лаборатория на университетската болница в Хайделберг, който е акредитиран съгласно DIN EN ISO 15189.
Наличност на данни
Авторите заявяват, че данните, подкрепящи констатациите от това проучване, са налични в статията и в нейните допълнителни информационни файлове.
- Диетична линолова киселина и риск от коронарна болест на сърцето The Nutrition Source Harvard T
- Диетични фибри и метаболизъм на жлъчните киселини - актуализация SpringerLink
- Ефект на рН на урината, променен чрез диетична намеса върху механизма на изчистване на пикочната киселина, зависим от рН
- Фолиевата диетична недостатъчност и добавките с фолиева киселина по същия начин влошават метаболизма и
- Диетичната сол насърчава когнитивното увреждане чрез природата на тау фосфорилиране