Резюме
Мишки с хомозиготно нарушение на Abcb4 генът не е в състояние да секретира PLs в жлъчката и развива лезии, характеризиращи се с възпаление на порталния тракт, пролиферация на жлъчните пътища и портална фиброза (7-9). Тези животни могат да се считат за модел за човека Abcb4 дефицит, заболяване, вариращо от PFIC3 при кърмачета до чернодробна цироза при възрастни (10). Лезиите обаче напредват бавно Abcb4-дефицитни мишки вероятно поради това, че жлъчката в мишките съдържа 50% -70% мурихолат и е хидрофилна, докато хидрофобният холат и дезоксихолатът са видни при хората. Хранене на холат до Abcb4 -/- доказано е, че мишките увеличават хидрофобността на басейна на жлъчната сол и влошават чернодробната патология, включително билиарна фиброза (11), потвърждавайки, че хроничното увреждане на билиарния епител е отчасти свързано с действието на хидрофобните жлъчни киселини, които не се инактивират от мицеларизацията с PL.
Въпреки наличието на някои лечения като урсодезоксихолева киселина, чернодробното увреждане често прогресира до чернодробна цироза при деца с Abcb4 обикновено се изисква дефицит (12) и трансплантация на черен дроб, като се подчертава, че търсенето на нови терапевтични средства остава важен приоритет. Проучвания от тази лаборатория показват, че храненето на животни, обогатено с L, стимулира секрецията на жлъчка при основното състояние и след натоварване на чернодробна жлъчна сол (13,14). L също ограничава развитието на чернодробна фиброза, индуцирана при животни от въглероден тетрахлорид или алкохол (15,16).
Тези открития ни накараха да предположим, че диетата с L-добавка може да бъде полезна при холестатично чернодробно заболяване. Настоящото проучване изследва ефекта на L-добавена диета върху жлъчната секреция, серумните чернодробни ензими и чернодробната патология при Abcb4 -/- мишки.
МАТЕРИАЛИ И МЕТОДИ
Животни и експериментален дизайн.
Abcb4 -/- и Abcb4 + /+ мъжки мишки (генетичен произход на FVB/NJ) са получени от лабораторията Jackson (Bar Harbor, ME). След отбиването животните бяха разделени на четири диетични групи, всяка от които съдържаше пет до осем животни, получаващи следните режими: С диета; L-допълнена диета; С диета с 0,025% от CA (Calbiochem Corp, San Diego, CA); L-допълнена диета с 0,025% от CA (L + CA). Пилотни експерименти установиха, че това ниско ниво на СА е достатъчно за засилване на фенотипа на чернодробното заболяване. Съдържанието на липиди в режимите е представено от 16% триацилглицероли (масло от слънчогледово семе) в диетата С и от 20% L гранули (Sigma Chemical Co., Сейнт Луис, МО) в диетата с L-добавки. L гранулите съдържаха 78% триацилглицероли и 22% PLs. Процентът на триглицеридите и при двете диети е сравним и съставът на мастните киселини не се различава значително между диетите. Съставът на диетите с добавки С и L е описан другаде (13,14). Мишките бяха настанени под 12: 12-часов цикъл светлина-тъмнина и със свободен достъп до храна и питейна вода. Всички протоколи бяха в пълно съответствие с насоките на Университета на Монреал за грижа за животните.
След 2 седмици диетична интервенция животните се претеглят и получават i.p. бромодезоксиуридин (BrdU) (4 mg/kg телесно тегло (BW). Един час по-късно те бяха упоени с ip кетамин (4 mg/kg BW) и ip ксилазин (11,3 mg/kg BW), коремът беше отворен и общ жлъчен канал, канюлиран с полиетиленов катетър PE-10 след лигиране на жлъчния мехур. Телесната температура се поддържа на 37 ° C с помощта на термостатично контролирана инфрачервена лампа. Жлъчката се събира (след 3 часа гладуване) върху лед в предварително претеглени епруветки в продължение на 1 h в 15 -мин аликвотни части и незабавно замразени. Потокът на жлъчката се определя количествено чрез претегляне на епруветките след събиране, като се приема плътност от 1 g/ml. Кръвта се взема чрез аортна пункция и серумът се получава след центрофугиране и се съхранява при -80 ° C до анализ. След изрязване парче прясна чернодробна тъкан се фиксира в 10% неутрален формалин и се вгражда в парафин за светлинна микроскопия; друго парче незабавно се замразява в охладен с течен азот изопентан и се съхранява при -80 ° C.
Серумен билирубин и чернодробни ензими.
Аланин аминотрансфераза (ALAT), алкална фосфатаза (ALP), GGT и билирубин са изследвани чрез рутинна клинична биохимия.
Хистология, оцветяване в червено по Сириус, имунохистохимия и оцветяване с имунофлуоресценция.
Чернодробни тъканни участъци с дебелина 5 μm бяха оцветени с хематоксилин-еозин за рутинна хистология и със Sirius червено [наситена пикринова киселина в дестилирана вода, съдържаща 0,1% (тегл./Об.) Sirius red (BDH Chemicals Ltd., Poole, UK)] за визуализация чернодробна фиброза (17). Всички диапозитиви са монтирани с EUKITT (O. Kindler GmbH, Фрайбург, Германия). Всички проби от поредица от експерименти бяха оцветени едновременно.
За откриване на α-гладкомускулен актин (SMA), експресиран от миофибробласти, парафиновите секции бяха депарафинизирани, хидратирани, промити с буфериран с Tris физиологичен разтвор и инкубирани с 3% H2O2 в метанол, за да инхибират ендогенната пероксидаза. След това срезовете бяха инкубирани с мише моноклонално антитяло (IgG2a) срещу SMA (DakoCytomation, Glostrup, Дания), разредено 1/250 с Tris-буфериран физиологичен разтвор за 30 минути. След измиване епитопите се откриват с комплект за откриване на HRP на системата Envision + (DakoCytomation) в продължение на 30 минути и срезовете се третират с 1 mg/ml диаминобензидин и 0,1% H2O2 в 0,05 mol/L Tris-HCl (pH 7,6) за около 20 мин. След измиване с вода, секциите бяха оцветени с хематоксилин и монтирани с EUKITT.
За откриване на BrdU срезовете бяха депарафинизирани, хидратирани и третирани с 3% H2O2 в метанол и след това с 20% човешки серум, съдържащ 1% говежди серумен албумин (BSA), с 2 mol/L HCl за 1 h. Срезите бяха инкубирани една нощ при 4 ° С с антитяло на плъх срещу BrdU [разреден 1/500 във фосфатно буфериран физиологичен разтвор (PBS)/1% BSA; Oxford Technology, Oxford, UK], последвано от заешко анти-плъхово антитяло (разредено 1/100 в PBS/1% BSA; DakoCytomation) за 45 минути. След измиване епитопите бяха открити с комплект за откриване на HRP на системата Envision + и разкрити с течен диаминобензидин (DakoCytomation).
За да се открие експресията на цитокератин в епителните клетки на жлъчните пътища, замразените секции бяха изсушени на въздух, фиксирани за 10 минути в ацетон при -20 ° C, третирани с 20% човешки серум в PBS/1% BSA и изплакнати в PBS. След това те бяха инкубирани в продължение на 45 минути със заешко поликлонално антитяло, насочено срещу специфичен за билиарния епител панцитокератин (Широкоспектърен скрининг; DakoCytomation), разреден 1/800 в PBS, съдържащ 1% BSA. След измиване срезите се инкубират с козе анти-заешко антитяло, конюгирано с Alexa Red (разредено 1/200; Molecular Probes, Eugene, OR) в продължение на 45 минути. След обработка в антифейд монтажна среда, срезовете бяха изследвани с микроскоп Zeiss Axioplan 2, оборудван с епиосветление и специфични филтри (Carl Zeiss Microscopy, Йена, Германия). Изображенията са получени чрез системата за обработка и анализ на изображения AxioVision (Carl Zeiss Vision). Количествените данни са получени с компютърна система за анализ на изображения (KS 300, Carl Zeiss Vision).
Отлагането на фиброза, оценено чрез червено оцветяване на Sirius, пролиферация на епителни клетки на жлъчните пътища (оцветяване с цитокератин) и миофибробластична диференциация (оцветяване с SMA) се изразява като процент от оцветените зони върху общата измерена площ. Клетъчната пролиферация се оценява чрез броя на оцветените с BrdU фибробластични клетки, присъстващи в порталните области. Не бяха включени хепатоцити или жлъчни епителни клетки, оцветени с BrdU.
Всички хистопатологични изследвания бяха извършени от един и същ изпитващ (T.L.), който беше заслепен за генетичния и диетичен статус на мишките.
Определяне на жлъчните киселини в жлъчката.
Общите жлъчни киселини бяха оценени с 3α-хидроксистероид дехидрогеназа (Sigma Chemical Co.) (18). Жлъчните киселини бяха идентифицирани и количествено определени чрез газова хроматография-масспектрометрия в газов хроматограф на Hewlett-Packard 5896, оборудван с масов селективен детектор на Hewlett-Packard 5971A в избран режим на мониториране на йони. Получава се корекционен фактор за количествено определяне чрез използване на 5β-холанова киселина като вътрешен стандарт (19).
Липиди в жлъчката.
Концентрациите на холестерол (CHOL) и PL са измервани след липидна екстракция съгласно Bligh и Dyer (20). И двата параметъра се определят количествено ензимно с търговски комплекти.
Статистически анализ.
Средните стойности бяха сравнени с използване на трипосочен ANOVA. Когато е положителен, значимостта на разликите между две групи се оценява от т тест; стр
РЕЗУЛТАТИ
BW и тегло на черния дроб.
Диетите бяха добре приети от всички животни, а количеството погълната диета беше сходно в различните групи. BW печалбите бяха подобни след 2 седмици експерименти във всички WT групи. В Abcb4 -/- мишки, BW не се е променил само при диета с добавка C или L. Въпреки това, диетичната група, допълнена с CA, показа 9,4% загуба на телесно тегло, което беше противодействано чрез L добавка (L + CA) (данните не са показани).
Чернодробното тегло/100 g BW от всички WT групи е непроменено. При нокаутиращи (KO) мишки теглото на черния дроб е значително увеличено в диетичната група, допълнена с CA, в сравнение с диетичната група C (9.01 ± 0.48 g/100 g BW срещу 5,37 ± 2,15 g/100 g BW, съответно; стр ≤ 0,05). Когато тези животни също са получили L + CA-диета, теглото на черния дроб е значително намалено (5,38 ± 0,45 g/100 g BW) и остава подобно на това при групата на С диетата.
Серумни чернодробни ензими и билирубин.
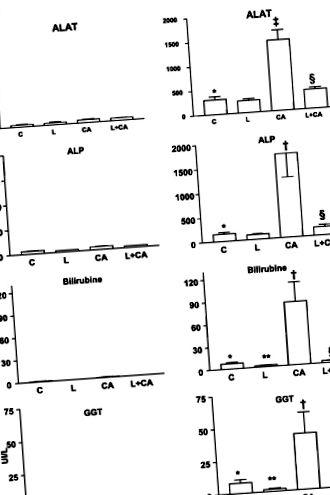
Чернодробните ензими и билирубин в серума бяха в нормалните граници в четирите диетични групи на WT мишки (фиг. 1).
В Abcb4 -/- мишки, хранени със С диета, серумните чернодробни ензими и билирубин са значително по-високи, отколкото при WT мишки, хранени със С диета (Фиг. 1). L-допълваната диетична група има намалени нива на билирубин и GGT в сравнение с диетичната група С, докато ALAT и ALP са приблизително непроменени. Групата, допълнена с СА, показва значително повишени чернодробни ензими и билирубин в сравнение с диетичната група С. L предотвратява тези повишения със стойности на L + CA-диетична група, сравнима с тези на съответните контроли без CA (L-допълнена диетична група).
Жлъчен поток и жлъчни компоненти.
При WT мишки, жлъчният поток и жлъчната секреция на общите жлъчни киселини, CHOL и PL се увеличават значително след добавянето на CA или L в сравнение с диетата С (Фиг. 2). Мишките, хранени с диета L + CA, имат стойности, които са дори по-видни, отколкото когато тези агенти се дават индивидуално.
PL и CHOL останаха значително нарушени при всички Abcb4 -/- мишки, с изключение на L-допълваната диетична група, която показва значително повишаване на изхода на CHOL. За разлика от WT мишките, не се наблюдава увеличаване на потока на жлъчката и секрецията на общите жлъчни киселини при KO мишки след CA хранене. Добавянето на L (L + CA-допълнена диета) не е оказало значителен ефект върху потока на жлъчката и секрецията на жлъчна киселина (Фиг. 2).
Резултатите от състава на жлъчната сол (данните не са показани) показват, както се очаква, че в Abcb4 -/- мишки, хранени със С диета, основните жлъчни киселини са мурихоловите киселини (55 ± 3,6%), последвани от СА (43 ± 3,6%). Дихидроксилираните жлъчни киселини (дезоксихолевата киселина, хенодеоксихолевата киселина и урсодезоксихолевата киселина) допринасят с 2,25 ± 0,06%. При мишки, получаващи CA, процентът на принос на CA се увеличава до 77 ± 7,7% и приносът на мурихолови киселини намалява до 18 ± 10%. Няма промяна в процента на принос на дихидроксилирани жлъчни киселини. При мишки, хранени както с CA, така и с L, CA е основната жлъчна киселина (90 ± 2,6%), а приносът на мурихолатите е 8,0 ± 2,6%, докато при дихидроксилираните жлъчни киселини е 1,31 ± 0,23% от общите жлъчни киселини. По този начин СА е основната жлъчна жлъчна киселина при мишки, хранени със С диета или с L + CA диета.
Дуктуларна хиперплазия, активиране на миофибробластите, клетъчна пролиферация в портални области и чернодробна фиброза при WT и KO мишки.
Стандартната хистология разкрива нормални портални области в четирите Abcb4 + /+ групи, включително животни, получаващи CA (данните не са показани). Цитокератиновото имунооцветяване разкрива нормални жлъчни структури, няма пролифериращи фибробластни клетки и не активира миофибробласт в порталните области. Липсата на фиброза отсъства.
Данните за Abcb4 -/- мишки са представени на фигури 3 и 4. В диетичната група С е имало само леко увреждане на билиарния епител, който е бил псевдо стратифициран на някои места. Цитокератиновото имунооцветяване разкри нормален брой жлъчни структури. Оцветяването с BrdU разкрива няколко пролифериращи фибробластни клетки в зоните на портала (данните не са показани). SMA имунооцветяването показва, че в зоните на портала не е настъпило активиране на миофибробласти. Отлагането на фиброза, оценено чрез червено оцветяване на Sirius, почти липсва. Хистологичните находки са сходни в групата с L-допълнена диета.
Стандартна хистология, имунооцветяване за цитокератин (CK) и α-гладък мускул актин (SMA) и Sirius red (SR) оцветяване в Abcb4 -/- мишки. При мишки, хранени с CA (CA), порталните пътища бяха разширени (HES) с разширяване на жлъчните дуктуларни структури в периферията им (CK), множество активирани миофибробласти (SMA) и отлагане на фиброза (SR). L драстично подобрява това чернодробно увреждане при L + CA-диетични мишки, при които хистологичните находки остават сходни с тези на C-диета и L-допълнени диетични групи (C и L). Увеличение × 100.
При мишки, хранени с диета с добавка на СА, порталните пътища бяха разширени със значителен прираст на броя на жлъчните дуктуларни структури в периферията им. Оцветяването с BrdU разкрива увеличаване на пролифериращите фибробластни клетки в зоните на портала (данните не са показани) и са налице множество SMA-положителни миофибробласти, особено в периферията на порталните пътища около дуктуларните структури. Отлагането на фиброза беше значително увеличено в зоните на портала и в преградите.
L драстично подобри чернодробното увреждане в групата с диета L + CA. Пролиферацията на фибробластните клетки и активирането на миофибробластите дори остават подобни на тази в съответната С диетична група. Не е отбелязано значително отлагане на фиброза.
Количественото определяне чрез анализ на изображения потвърждава увеличаването на дуктуларните структури, пролиферацията на фибробластните клетки, активирането на миофибробластите и фиброзата в CA групата. Стойностите останаха подобни на тези на контролите, когато тези мишки също получиха L (група L + CA) (Фиг. 4).
ДИСКУСИЯ
В заключение, L може да противодейства на прогресията на чернодробното заболяване през Abcb4 -/- мишки, отваряйки нови възможности за лечение на деца с ABCB4 дефицит.
- Холестатично увреждане на черния дроб, причинено от хранителни добавки, хранителни добавки и парентерално хранене -
- Диетично лечение на неалкохолен стеатохепатит (NASH) или безалкохолна мастна чернодробна болест
- Диетични промени за лечение на мастна чернодробна болест и неалкохолен стеатохепатит dLife
- Диета при кучешки чернодробни заболявания
- Съединението, намерено в тези зеленчуци, може да помогне в борбата с мастните чернодробни заболявания. Проучване Lifestyle News, The