Субекти
Резюме
Диетичното лечение е важно при лечението на диабет тип 2 или преддиабет, но съществува несигурност относно оптималната диета. Ние рандомизирахме възрастни (н = 34) с гликиран хемоглобин (HbA1c)> 6,0% и повишено телесно тегло (ИТМ> 25) до много нисковъглехидратна кетогенна (LCK) диета (н = 16) или диета с умерено съдържание на въглехидрати, калории с ниско съдържание на мазнини (MCCR) (н = 18). Всички участватнТе бяха насърчавани да бъдат физически активни, да спят достатъчно и да практикуват стратегии за поведенческо придържане, базирани на положителен ефект и внимателно хранене. На 12 месеца участниците в групата LCK са имали по-голямо намаление на нивата на HbA1c (изчислена пределна средна стойност (EMM) на изходно ниво = 6,6%, при 12 mos = 6,1%) от участниците в групата на MCCR (EMM на изходно ниво = 6,9%, на 12 mos = 6,7%), стр = .007. Участниците в групата LCK са загубили повече тегло (EMM на изходно ниво = 99,9 kg, при 12 mos = 92,0 kg), отколкото участниците в MCCR групата (EMM на изходно ниво = 97,5 kg, при 12 mos = 95,8 kg), стр
Въведение
Хранителното управление е важен компонент при лечението на диабет тип 2. Съществува обаче значителна несигурност относно оптималното ниво на прием на въглехидрати. Предишни изследвания показват, че ad libitum много нисковъглехидратна кетогенна диета (LCK) може да подобри метаболитните мерки при възрастни с диабет тип 2 1,2,3,4,5,6 и да намали нуждата от лекарства, свързани с диабета 7,8, 9,10 .
Рандомизирахме възрастни с диабет тип 2 или преддиабет и повишено телесно тегло, за да получим диета LCK или диета с ниско съдържание на мазнини с ограничена калория и калории. Преди това докладвахме първоначалните 3-месечни резултати, които показаха, че участниците в групата LCK имат значително по-добър гликемичен контрол и тенденция към по-голяма загуба на тегло в сравнение с участниците в групата MCCR 11. Тук докладваме резултатите от проучването на 6 и 12 месеца след изходното ниво.
Методи
Уча дизайн
Проведохме рандомизирано (1: 1) проучване с паралелна група. Институционалният съвет за преглед на Калифорнийския университет в Сан Франциско (USCF) одобри това изпитание, което е регистрирано в ClinicalTrials.gov (NCT01713764). Критериите за допустимост включват възраст на 18 или повече години, наднормено тегло (индекс на телесна маса (ИТМ) 25 или повече), с текущо ниво на гликиран хемоглобин (HbA1c) над 6,0%. Изключихме участниците, които в момента използват инсулин или приемат повече от три понижаващи глюкозата средства. Получихме информирано съгласие от всички допустими участници.
Интервенция
Участниците са посещавали 19 класа в продължение на 12 месеца: дванадесет 2-часови седмични занятия, след това три 2-часови класа на всеки 2 седмици, последвани от четири 1,5-часови урока на всеки 2 месеца. Един ръководител на групата инструктира участниците в LCK да ядат ad libitum много нисковъглехидратна, вероятно кетогенна диета, като намаляват приема на въглехидрати до между 20-50 g въглехидрати (без фибри) на ден. Дадохме им цел да постигнат ниво на кетон в кръвта (бета-хидроксибутират) между 0,5 и 3 милимола (mmol), както се измерва два пъти седмично през първите няколко месеца у дома. Различен ръководител на групата инструктира участниците в MCCR да спазват MCCR диета, при която 45-50% от калориите им трябва да бъдат получени от въглехидрати. Също така ги инструктирахме да намалят консумацията на мазнини и да ядат 500 килокалории по-малко (kcal) на ден, отколкото е необходимо за изчислената им поддръжка за намаляване на теглото.
Започвайки от седмица 6, ръководителите на групи научиха участниците в двете групи за значението на съня и упражненията за диабет тип 2 и ги насърчиха да увеличат и двете, ако е необходимо. Трета група ръководител също научи всички участници на подкрепящи поведенчески стратегии за придържане, насочени към увеличаване на положителния ефект 12 и внимателно хранене 13, за да се увеличи придържането към интервенцията. Вижте нашата публикация за 3-месечните резултати от това проучване за пълни спецификации на метода 11 .
Оценки
Получихме кръвна проба на гладно и измерихме HbA1c на участниците, липиди, глюкоза и инсулин на гладно и С-реактивен протеин. Тестовете бяха извършени от търговска лаборатория, сертифицирана от CLIA (Quest Diagnostics, Madison, NJ), която не знаеше за плана на изследването или зададените условия. Изследователският персонал измерва теглото и кръвното налягане по време на лични посещения. Оценихме инсулиновата резистентност, използвайки оценка на хомеостатичен модел (HOMA2-IR) 14. Участниците записаха храната си с помощта на автоматизирано самоуправляемо 24-часово диетично изземване (ASA24) 15. На изходно ниво и 3, 6 и 12 месеца след изходното ниво помолихме участниците да докладват какво са яли през един ден.
Статистически анализ
Статистическите анализи бяха извършени с помощта на Stata, IC версия на софтуера 14.1 (StataCorp LP, College Station, Тексас, САЩ). Резултатите бяха непрекъснато мащабирани и анализирани с параметрични статистически техники. Няколко резултата изискваха трансформация на дневника преди анализ и изключване на няколко влиятелни отклонения. Резултатите от многократните измервания на участниците бяха представени на отделни анализи на линейна регресия със смесени ефекти с термини с фиксиран ефект, сравняващи базовата линия с всяка от трите следващи времеви точки след базовата линия, основния ефект за групата и простите ефекти на взаимодействието, сравняващи относителната промяна по групи в всяка оценка след изходното ниво, спрямо изходната линия. Включени бяха произволни условия за пресичане на y, за да се приспособят експерименталните проекти на повтарящите се мерки. За всички резултати, включващи дихотомични резултати, използвахме двустранен точен тест на Фишер, за да оценим значимостта. Тествахме разликата между групите за процент загубено тегло с независими проби т-тест за промяната във всяка група. Тъй като това беше изследователско пилотно изпитание, изпитанието не беше задвижвано.
Резултати
Набиране и участие
Записахме и рандомизирахме 34 участници в LCK (н = 16) или MCCR (н = 18) група (допълнителна фигура 1). Задържането не се различава по интервенционна група: 12-месечно задържане за групата LCK е 14/16 (87,5%) и 15/18 (83,3%) за групата MCCR (стр = 1.000), със задържани средно 85.3% участници (допълнителна таблица 1).
Диетична оценка
В сравнение с групата MCCR, групата LCK съобщава, че консумира по-малко невлакнести грамове въглехидрати (6 и 12 месеца), повече грама мазнини (6 и 12 месеца) и повече грама протеини (12 месеца), но не и различно брой калории на ден (Таблица 1).
HbA1c
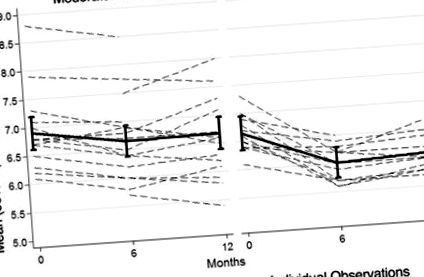
На 12 месеца участниците в групата LCK намаляват нивата на HbA1c повече от участниците в групата MCCR (Таблица 1, Фиг. 1). В групата LCK спрямо MCCR, както на 6, така и на 12 месеца, повече от два пъти процента на участниците, които са започнали с HbA1c при или над 6,5%, границата за диабет тип 2, завършва под това ниво. Този резултат обаче е значителен само на 6 месеца (допълнителна таблица 2).
Баровете представляват стандартни 95% доверителни интервали на средната стойност. Прекъснатите линии отразяват индивидуалните наблюдения на участниците; по-тъмните линии представляват всяка средна група
Телесно тегло и други здравни резултати
На 12 месеца участниците в групата LCK отслабнаха и понижиха своя ИТМ повече от участниците в групата MCCR (Таблица 1, допълнителна фигура 2). Средно на 12 месеца участниците в групата LCK са загубили 8,3% от телесното тегло, докато групата MCCR са загубили 3,8% (допълнителна таблица 2).
На 6 месеца LDL холестеролът се увеличава повече в групата LCK в сравнение с групата MCCR, въпреки че на 12 месеца групите вече не се различават значително (Таблица 1). На 6 месеца промяната в съотношението на триглицеридите към HDL холестерола не се различава значително между групите, въпреки че на 12 месеца това съотношение е намаляло повече в групата LCK в сравнение с групата MCCR (Таблица 1). Други биологични резултати не се различават значително между групите (Таблица 1).
Лекарства за диабет
Участниците в групата LCK намалиха употребата на някои лекарства, свързани с диабета, повече от участниците в групата MCCR. От десет участници, които съобщават, че са приемали сулфонилурейни продукти или инхибитори на дипептидил пептидаза-4 преди интервенцията, и шестте участници, назначени в групата LCK, са прекратили приема на тези лекарства до 12 месеца след изходното ниво (по искане на лекарите от изследването, въз основа на протокола от изследването), в сравнение с никой от четирите участници в групата MCCR (стр = .005, точен тест на Фишер). Двама участници в групата MCCR започнаха да приемат тези лекарства, докато никой от участниците в групата LCK не го направи. От 22 участници, които съобщават, че са приемали метформин преди интервенцията, 3/10 в групата LCK са прекратили приема на лекарството, в сравнение с 0/12 в групата MCCR (стр = .08, точен тест на Фишър). В допълнение, в групата LCK 1 човек увеличи дозата си на метформин, а в групата MCCR 2 хората намали метформин, като нито една от тези промени не се различава значително между групите (стр > .3).
Дискусия
Дванадесет месеца след изходното ниво участниците в групата LCK доказват по-голямо намаление на всеки HbA1c и тегло, отколкото участниците в групата MCCR. В допълнение, по-голямото намаляване на HbA1c в групата LCK се случи въпреки по-голямото намаляване на лекарствата за понижаване на глюкозата. Силна страна на нашето изпитание беше, че малко участници отпаднаха след 12 месеца. Възможността за обобщение от това проучване обаче е ограничена от относително малкия му размер, който не ни позволява да извършваме анализи на подгрупи.
На 6 месеца забелязахме повишаване на LDL холестерола в групата LCK в сравнение с групата MCCR. Тази разлика вече не е била значителна на 12 месеца. Това може да породи известни притеснения относно дългосрочните ефекти на такава диета върху сърдечно-съдовите заболявания. Последните изследвания показват, че корелацията между LDL и сърдечно-съдовия риск варира в зависимост от размера на частиците 16, 17 и че нисковъглехидратните кетогенни диети са склонни да увеличават размера на LDL частиците 18, което предполага, че увеличаването на общия LDL може да не бъде придружено от повишено сърдечно-съдово риск. Установихме обаче, че съотношението на триглицеридите към HDL, което предсказва коронарна болест 19, намалява в групата LCK в сравнение с групата MCCR, което предполага, че много нисковъглехидратната кетогенна диета може да има определени ползи върху липидните профили. В допълнение, нито един участник не е имал диабетна кетоацидоза, състояние, което се случва, когато производството на кетони е нерегулирано, с нива на кетон в кръвта надвишаващи 25 mM, с едновременно високи нива на глюкоза в кръвта (над 250 mg/dL), което е малко вероятно сценарий в това изследване .
Нашето проучване имаше добро задържане и справедливо спазване на диетата, което може да се дължи на новите поддържащи психологически стратегии (положителен ефект и внимателно хранене). Бъдещите опити могат изрично да проверят хипотезата, че тези стратегии могат да подобрят степента на задържане и придържане. Освен това, тъй като и двете групи също са получили препоръки за начина на живот (физическа активност и сън), ние сме ограничени в разбирането как диетите може да са повлияли на резултатите, независимо от другите предложени промени. В бъдещи проучвания, ако изследователите рандомизират участниците на различни комбинации от начин на живот и психологически препоръки, това би могло да изясни и оптимизира най-полезните съвети и подкрепа за допълнителни дейности.
Резултатите предполагат, че възрастните с преддиабет или неинсулинозависим диабет тип 2 може да са в състояние да подобрят гликемичния контрол с по-малко лекарства, като спазват ad libitum много нисковъглехидратна кетогенна диета в сравнение с диета с ниско съдържание на мазнини с ограничена въглехидрати и калории. Допълнителни изследвания трябва да изследват както клиничните резултати, така и спазването след 12 месеца.
Препратки
Feinman, R. D. et al. Диетичното ограничаване на въглехидратите като първият подход при управлението на диабета: критичен преглед и база данни. Хранене 31, 1–13 (2015).
Volek, J. S. et al. Ограничаването на въглехидратите има по-благоприятно въздействие върху метаболитния синдром от диетата с ниско съдържание на мазнини. Липиди 44, 297–309 (2009).
Ръскин, Д. Н. и Масино, С. А. Нервната система и метаболитната дисрегулация: възникващи доказателства се сближават при кетогенна диетична терапия. Предни невроски. 6, 33 (2012).
Dashti, H. M. et al. Благоприятни ефекти от кетогенната диета при пациенти със затлъстял диабет. Мол. Клетка. Biochem. 302, 249–256 (2007).
Boden, G., Sargrad, K., Homko, C., Mozzoli, M. & Stein, T. P. Ефект на диета с ниско съдържание на въглехидрати върху апетита, нивата на кръвната глюкоза и инсулиновата резистентност при пациенти със затлъстяване с диабет тип 2. Ан. Стажант. Med. 142, 403–411 (2005).
Saslow, L. R. et al. Онлайн интервенция, сравняваща много нисковъглехидратна кетогенна диета и препоръки за начина на живот в сравнение с диета с плоча при лица с наднормено тегло с диабет тип 2: рандомизирано контролирано проучване. J. Med. Интернет Res. 19., e36, https://doi.org/10.2196/jmir.5806 (2017).
Hussain, T. A. et al. Ефект от нискокалоричната спрямо нисковъглехидратната кетогенна диета при диабет тип 2. Хранене 28, 1016–1021 (2012).
Davis, N. J. et al. Сравнително проучване на ефектите от едногодишна диетична интервенция на диета с ниско съдържание на въглехидрати спрямо диета с ниско съдържание на мазнини върху теглото и гликемичния контрол при диабет тип 2. Грижа за диабета 32, 1147–1152 (2009).
Tay, J. et al. Сравнение на диети с ниско и високо съдържание на въглехидрати за лечение на диабет тип 2: рандомизирано проучване. Am. J. Clin. Nutr. 102, 780–790 (2015).
Westman, E. C. et al. Ефектът на нисковъглехидратната, кетогенна диета спрямо диетата с нисък гликемичен индекс върху гликемичния контрол при захарен диабет тип 2. Nutr. Metab. 5, 36 (2008).
Saslow, L. R. et al. Рандомизирано пилотно проучване на умерена въглехидратна диета в сравнение с диета с много ниско съдържание на въглехидрати при лица с наднормено тегло или затлъстяване със захарен диабет тип 2 или преддиабет. PloS One 9, e91027 (2014).
Moskowitz, J. T. et al. Интервенция с положителен ефект за хора, които изпитват стрес, свързан със здравето: разработка и нерандомизиран пилотен тест. J. Health Psychol. 17, 676–692 (2011).
Daubenmier, J. et al. Интервенция за внимание при хранене при стрес за намаляване на кортизола и коремните мазнини при жени с наднормено тегло и затлъстяване: проучвателно рандомизирано контролирано проучване. J. Obes. 2011 г., 651936 (2011).
Wallace, T. M., Levy, J. C. & Matthews, D. R. Използване и злоупотреба с моделирането на HOMA. Грижа за диабета 27, 1487–1495 (2004).
Subar, A. F. et al. Автоматизираното самоуправление 24-часово изземване на диети (ASA24): ресурс за изследователи, клиницисти и преподаватели от националния институт по рака. J. Акад. Nutr. Диета. 112, 1134–1137 (2012).
Austin, M. A. et al. Модели на подклас на липопротеините с ниска плътност и риск от инфаркт на миокарда. ДЖАМА 260, 1917–1921 (1988).
Дейвидсън, М. Х. и сътр. Клинична полезност на възпалителни маркери и усъвършенствано тестване на липопротеини: съвет от експертна група от липидни специалисти. J. Clin. Липидол. 5, 338–367 (2011).
Gerber, P. A. & Berneis, K. Регулиране на субфракции на липопротеините с ниска плътност чрез въглехидрати. Curr. Становище. Clin. Nutr. Metab. Грижа 15, 381–385 (2012).
da Luz, P. L., Favarato, D., Junior, J. R. F.-N., Lemos, P. & Chagas, A. C. P. Високо съотношение на триглицеридите към hdl-холестерола предсказва обширна коронарна болест. Clin. (Сао Пауло, Бразилия.). 63, 427–432, https://doi.org/10.1590/S1807-59322008000400003 (2008).
Manninen, A. H. Метаболитни ефекти на диетите с много ниско съдържание на въглехидрати: неразбрани злодеи от човешкия метаболизъм. J. Int. Soc. Спорт Nutr. 1, 7–11 (2004).
Благодарности
Благодарим много на Майкъл Хол за помощта му при провеждането на личното проучване, Carley Hauck за преподаването на положителния ефект и умения за хранене, както и на нашите отдадени участници. Изследването е подкрепено с безвъзмездна финансова помощ от фондация „Уилям К. Боус, младши“ и здравен фонд „Маунт Сион“. Лора Саслоу и Ашли Е. Мейсън бяха подкрепени от безвъзмездните средства на Националните здравни институти T32AT003997 от Националния център за допълнително и интегративно здраве. Лора Саслоу беше подкрепена и от K01 от Националния институт по диабет и храносмилателни и бъбречни заболявания (DK107456). Ашли Е. Мейсън също беше подкрепена от K23 от Националния институт за сърце, белия дроб и кръв (HL133442). Джудит Московиц бе подкрепена от безвъзмездните средства на Националните здравни институти K24 MH093225 от Националния институт по психично здраве. Фредерик Хехт беше подкрепен от безвъзмездните средства на Националните здравни институти K24 AT007827 от Националния център за допълнително и интегративно здраве. Финансистите не са играли роля в дизайна на проучването, събирането и анализа на данни, решението за публикуване или подготовката на ръкописа.
Информация за автора
Принадлежности
Университет в Мичиган, Ан Арбър, Мичиган, САЩ
Лора Р. Саслоу и Робърт Плуц-Снайдер
Държавен университет в Сан Франциско, Сан Франциско, Калифорния, САЩ
Дженифър Дж. Даубенмиер
Северозападният университет, Еванстън, Илинойс, САЩ
Джудит Т. Московиц
Калифорнийски университет, Сан Франциско, Калифорния, САЩ
Сара Ким, Елизабет Дж. Мърфи, Вероника Голдман, Ашли Е. Мейсън, Патриша Моран и Фредерик М. Хехт
Virta Health, Сан Франциско, Калифорния, 94105, САЩ
Стивън Д. Фини
UCSF Benioff Детска болница Оукланд, Оукланд, Калифорния, САЩ
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Автора за кореспонденция
Етични декларации
Конкуриращи се интереси
Стивън Фини е платен член на Научния консултативен съвет на Аткинс, основател на Virta Health, и е автор на книги за диети с ниско съдържание на въглехидрати и високо съдържание на мазнини: New Atkins and You, Изкуството и науката за нисковъглехидратния живот и Изкуството и Наука за ниските въглехидратни показатели. Фредерик Хехт е в научно-консултативния съвет на Virta Health. Другите автори не декларират конкуриращи се финансови интереси.
- Добавка на витамин D3 по време на отслабване двойно-сляпо рандомизирано контролирано проучване - PubMed
- Ефективността на препоръките за закуска за отслабване рандомизирано контролирано проучване
- Пробата започва с хапчета за отслабване, за които се подозира до 2000 смъртни случая
- Какво е Централноазиатска храна Много гладни номади
- Какво определено е най-добрият метод за нормално и бързо изгаряне на нежеланите телесни мазнини