Lucy A Plumb
1 Катедра по детска нефрология, Британска кралска болница за деца, Upper Maudlin Street, Бристол BS2 8BJ, Великобритания
Матко Марле
1 Катедра по детска нефрология, Британска кралска болница за деца, Upper Maudlin Street, Бристол BS2 8BJ, Великобритания
Агнешка Бежинска
2 Академично бъбречно отделение, Университет в Бристол, сграда на Дороти Ходжкин, ниво 1, улица Уитсън, Бристол BS1 3NY, Великобритания
Хауърд Мартин
3 Катедра по молекулярна генетика, Регионални лаборатории за молекулярна генетика, болница Addenbrooke’s, Cambridge CB2 0QQ, Великобритания
Ким Брюгер
3 Катедра по молекулярна генетика, Регионални лаборатории за молекулярна генетика, болница Addenbrooke’s, Cambridge CB2 0QQ, Великобритания
Стивън Аббс
3 Катедра по молекулярна генетика, Регионални лаборатории за молекулярна генетика, болница Addenbrooke’s, Cambridge CB2 0QQ, Великобритания
Мойн A Saleem
4 Катедра по детска нефрология, Университет в Бристол, Британска кралска болница за деца, Бристол BS2 8BJ, Великобритания
Резюме
Заден план
Семейната младежка хиперурикемична нефропатия е рядка наследствена нефропатия с генетична хетерогенност. Категоризирани по генетичен дефект, мутации в уромодулин (UMOD), ренин (REN) и гени на хепатоцитен ядрен фактор-1β (HNF-1β), както и връзка с хромозома 2p22.1-21 са идентифицирани преди това. Познаването на генетиката на този фенотип даде важни улики за пътищата на развитие в бъбреците.
Представяне на дело
Ние съобщаваме за нов фенотип, с типичните черти на хиперурикемия и бъбречно влошаване, но с допълнителната неочаквана характеристика на едностранната бъбречна хипоплазия. Мутационните анализи на съществуващите известни гени и генетични локуси са отрицателни, което показва нова моногенна причина. Интересното е, че двама братовчеди от индекса не споделят последната характеристика, което предполага модифициращ генен ефект.
Заключение
Едностранната бъбречна хипо/аплазия обикновено е спорадична и относително често срещана, като до момента не е установена генетична причина. Това съобщено родословие разкрива възможността нов, неизвестен бъбречен ген за развитие да бъде замесен във фенотипа FJHN.
Заден план
Семейната младежка хиперурикемична нефропатия е рядка причина за бъбречно заболяване при деца. Унаследява се по автозомно доминиращ начин и се характеризира с хиперурикемия и подагра, неизбежно прогресираща до краен стадий на бъбречна недостатъчност. Патогенезата на FJHN изглежда е нарушение на уратния клирънс по отношение на креатинина (фракционна екскреция, FEur), което може да се прояви преди юношеството [1]. Последвалата хиперурикемия често се развива след пубертета и може да бъде клинично безшумна или да се прояви като подагра [2]. Хистологичните находки при биопсия предполагат хронична неспецифична тубулоинтерстициална нефропатия [3]. Въпреки че точният механизъм на бъбречната дисфункция е неясен, функцията постепенно намалява и в краен стадий на бъбречно заболяване може да се развие в рамките на 10-15 години [4]. Представяме семейство с FJHN, чийто нов бъбречен фенотип може да помогне за по-нататъшно разбиране на генетиката, свързана с бъбречната хипоплазия.
Представяне на дело
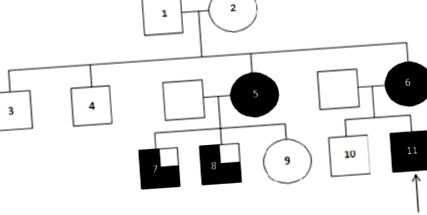
16-годишен мъж беше привлечен на вниманието ни след опасения от неговия лекар за силна фамилна анамнеза за бъбречно заболяване. Той е годен и здрав тийнейджър, който в миналото не е имал значителни здравословни проблеми. В семейството (Фигура 1, Таблица 1) майката на пациента е била диагностицирана три години преди това с бъбречна недостатъчност, изискваща перитонеална диализа и последваща трансплантация. При по-нататъшното разследване тя беше отбелязана, че има малък десен бъбрек на ултразвук. Лелята на майката на пациента също е била с установена бъбречна недостатъчност и в допълнение към един малък бъбрек на ултразвук е страдал от подагра. Тя има двама сина на 18 и 20 години с бъбречно увреждане, и двамата с повишени нива на пикочна киселина, но няма данни за бъбречна хипоплазия. Дъщеря й не е показала признаци на бъбречно заболяване. Двама чичовци по майчина линия не са имали проблеми с бъбреците, както и бабите и дядовците по майчина линия. Пациентът в нашия случай има по-голям незасегнат брат. Никой от членовете на семейството не е претърпял естествена бъбречна биопсия.
Семейното родословие изучава. Стрелката сочи към индекса.(Частично засенчено: бъбречно увреждане и хиперурикемия/подагра; напълно засенчено - бъбречно увреждане, хиперурикемия/подагра и едностранна бъбречна хипоплазия).
маса 1
Клинични характеристики на членовете на семейството
| 3 | Няма данни | Няма данни | Няма данни | Няма данни | Не |
| 4 | Няма данни | Няма данни | Няма данни | Няма данни | Не |
| 5 | 42 | 853 | 27.11.2012 | Да | Да |
| 6 | 42 | Бъбречна трансплантация 2006 | Да | Да | |
| 7 | 20. | 176 | 12.3.2012 г. | Да | Не |
| 8 | 18. | 122 | 25.07.2012 | Да | Не |
| 9 | 12 | 68 | 7.6.2009 г. | Не | Не |
| 10 | 21. | Няма данни | Няма данни | Не | Не |
| 11. | 16. | 102 | 14/02/2011 | Да | Да |
При първоначалния преглед беше отбелязано, че пациентът изглежда добре. Кръвното му налягане от 122/55 е в рамките на нормалния центил за неговия ръст и възраст. Ултразвук разкрива малък десен бъбрек с размери 8,2 cm, който иначе е незабележим, както и нормален размер, макар и леко ехогенен ляв бъбрек, с размери 13,0 cm. Пикочният мехур и уретерите са докладвани като нормални. Първоначалните кръвни тестове разкриват прогнозна скорост на гломерулна филтрация (GFR) от 64 ml/min/1,73 m 2, въпреки че оттогава тя намалява (таблица 1). Анализът на урината беше нормален. Първоначално пикочната киселина е била 430 μmol/L, но при повторно тестване е била повишена на 506 μmol/L (нормален референтен диапазон 200-430 μmol/L). Понастоящем пациентът се наблюдава на редовни интервали, за да следи за влошаване на бъбречната функция.
С оглед на очевидното автозомно доминиращо предаване на този фенотип, допълнителни кръвни проби от засегнатите членове на семейството бяха изпратени да тестват за мутации на уромодулин (UMOD) и мутации на хепатоцитен ядрен фактор-1β (HNF1β), които бяха отрицателни. Случаят с индекса също е скриниран за мутации в гена на ренин (REN) и 2p22.1-p21 региона, като се използва секвениране на екзома, но не са открити патологични варианти (моля, вижте допълнителни данни за методология и резултати).
Заключения
FJHN е автозомно доминиращо състояние, характеризиращо се с хипоекскреция на урат, водеща до хиперурикемия, подагра и бъбречно заболяване. Бъбречното увреждане е с относително късно начало, обикновено настъпващо между 15-30 годишна възраст [4]. Прогресията до бъбречно увреждане в краен стадий може да се развие в рамките на 10-15 години, въпреки че може да се забави от ранното въвеждане на алопуринол [5]. Забележка от ултразвуковото изследване включва намаляване на бъбречния размер с абнормна ехогенност, а в някои случаи са съобщени и кисти [6,7].
Диагностиката на FJHN е клинична, но с напредването на познанията ни за това рядко заболяване се увеличава и способността ни да категоризираме индивидите въз основа на техния генетичен дефект. В момента има три типа FJHN. Тип първи (FJHN1) е свързан с хетерозиготни мутации в гена на уромодулин (UMOD) на хромозома 16p12.3 (MIM 191845) [3,6-9]. Тип втори (FJHN2) е свързан с мутации в гена на ренин (REN) на хромозома 1q32 (MIM 179820) [10], а тип три (FJHN3) е картографиран на 2p22.1-21 (MIM 614227) [11]. Нетипичен вариант на FJHN, свързан с диабет и бъбречни кисти, е свързан с мутации в HNF-1β на хромозома 17q12 (MIM 189907) [12].
Ние описваме семейство с фамилна младежка хиперурикемична нефропатия (FJHN), което изисква нашето внимание по няколко причини. Първо, има пенетрантна характеристика на единичен хипопластичен бъбрек заедно с нормален размер на бъбрек при трима от петимата засегнати членове на семейството. По-рано е описан едностранен хипопластичен бъбрек в единичен случай на FJHN [6]. Доколкото ни е известно, това е първият доклад, който описва бъбречната хипоплазия като важна характеристика на фенотипа FJHN в едно родословие. Второ, нашите сродни не са показали данни за патологични мутации нито в гени, нито в генетични локуси, свързани с фенотипа FJHN. Два от основните гени, замесени в FJHN, уромодулин (UMOD) и хепатоцитен ядрен фактор 1β (HNF1β), преди това са били свързани с ролята в нефрогенезата [6,13-15]. Отрицателният скрининг в този случай предполага, че неизвестни ключови гени могат да играят решаваща роля за формирането на бъбреците, както и за развитието на FJHN.
Бъбречната хипоплазия се дефинира като необичайно малки бъбреци (по-големи от две стандартни отклонения под очакваната средна стойност, когато са свързани с възрастта или други параметри на растеж) с нормална морфология, но намален нефронов брой [16]. Докато истинската диагноза разчита на хистологично изследване, в действителност диагнозата често се поставя от неинвазивни диагностични инструменти като ултразвук [16,17]. Данните от Обединеното кралство показват, че бъбречната хипоплазия и/или дисплазия представляват почти една трета от всички случаи на краен стадий на бъбречно заболяване при педиатричната популация [18]. Изчисляването на истинската честота на бъбречна хипоплазия обаче може да бъде трудно поради факта, че термините бъбречна дисплазия (малки бъбреци с тъканна малдиференциация) и бъбречна хипоплазия често са взаимозаменяеми и неправилно използвани.
TCF2 е генът, кодиращ HNF1β, ембрионален транскрипционен фактор, изразен в черния дроб, бъбреците и панкреаса [14]. Мутации в HNF1β са идентифицирани в семейства с FJHN, особено тези с атипични характеристики като бъбречни кисти или други аномалии на бъбречното развитие. Въпреки че механизмът на фенотипа при тези пациенти е неясен, спекулира се, че HNF1β, който се експресира на ранен етап в проксималния канал, може да намали транскрипцията на транспортери на човешки урат, въпреки че това все още не е доказано [12].
Известно е, че HNF1β индуцира UMOD, ген, кодиращ протеина уромодулин. Открити са няколко мутации на уромодулин при пациенти с фенотип FJHN, сега категоризиран като FJHN тип 1 [3,6-9]. Известен също като гликопротеин Tamm-Horsfall, проучванията показват, че уромодулинът играе жизненоважна роля за поддържане на ниска водопропускливост и градиент на противотока на медуларната верига [8,21]. Следователно дефектите водят до увеличаване на отделянето на сол и вода в урината и следователно до увеличаване на реабсорбцията на пикочна киселина в проксималните тубули.
Мутации в гена на ренин са идентифицирани в три семейства с FJHN фенотип. Предполага се, че високата експресия на мутантния REN ген в юкстагломеруларните клетки с течение на времето води до дисрегулация на ренин-ангиотензин с намален синтез на ренин, апоптоза и загуба на нефрон, водещи до прогресираща бъбречна недостатъчност [10]. Докато при тези семейства се съобщава за нормален бъбречен размер, проучвания с мишки показват, че пълната аблация на ренин-експресиращите клетки е свързана с малки и морфологично анормални бъбреци, което предполага, че ренинът е необходим за поддържане на морфологичната цялост по време на бъбречното развитие [22].
Piret et al. идентифицира генетичен регион с до 28 кандидат-гена на 2p22.1-21, свързан с пет семейства с FJHN, който оттогава се нарича FJHN3. Предполага се, че мутациите в този регион могат да представляват по-голямата част от случаите на FJHN, които се окажат отрицателни за UMOD, REN или HNF-1β мутации [11]. Въпреки че не е ясно как основната мутация води до получения фенотип, двустранно намаляване на размера на бъбреците се наблюдава при 3/16 случая, които са свързани с локуса FJHN3.
Връщайки се към нашия индексен случай и неговото семейство, проникващата характеристика на аномалия на бъбречното развитие при трима от пети засегнати членове може да включи все още неидентифициран ген за развитие в патогенезата на FJHN. Генетичната хетерогенност на състоянието е добре описана и нашето родословие поддържа възможността за нов, неидентифициран ген, замесен както във фенотипа FJHN, така и в развитието на бъбречна хипоплазия [3,4,9]. Други възможности за идентифициране на кандидат-гени могат да бъдат предложени въз основа на клиничните и биохимични находки, известни на пациентите с FJHN. Тъй като един от биохимичните отличителни белези на заболяването е хипоекскрецията, има хипотеза, че дефект в транспорта на урат в проксималния бъбречен канал, където 90% от урата се реабсорбира, може да бъде основният механизъм на заболяването [12]. Досега обаче не е установена значителна корелация с гените на уратни транспортери, включително URAT1 и hUAT [3].
Съгласие
Писменото информирано съгласие е получено от пациента за публикуване на този доклад за случая. Копие от писменото съгласие е на разположение за преглед от редактора на това списание.
Съкращения
UMOD: Уромодулинов ген; HNF1β: Хепатоцитен ядрен фактор-1β ген; FJHN: Фамилна младежка хиперурикемична нефропатия; GFR: Скорост на гломерулна филтрация; ММ: метанефричен мезенхим; UB: Уретерична пъпка; RDGs: Гени за бъбречно развитие.
Конкуриращи се интереси
Никой не е деклариран. Генетичният анализ, извършен от HM, беше подкрепен от Центъра за биомедицински изследвания в Кеймбридж и Националния институт за здравни изследвания.
Принос на авторите
LAP (съответен автор) помогна за създаването на ръкописа. Тя проучи, изготви и преработи окончателния ръкопис за изпращане. ММ участва в проектирането на ръкописа, извършва събиране на данни за родословието и помага за преразглеждането на ръкописа за изпращане. AB интерпретира данните от анализа на последователността на екзома и помогна за преразглеждането на ръкописа. HM, KB и SA извършиха секвениране на екзоми върху ДНК от индекса и помогнаха за препроектирането и преразглеждането на ръкописа за повторно представяне. MAS създаде оригиналната концепция за ръкописа и критично преработи ръкописа за важно интелектуално съдържание. Всички автори са дали своето одобрение за публикуване на ръкописа. MAS даде цялостно одобрение тази версия да бъде публикувана.
История преди публикацията
Историята на предварителната публикация за тази статия можете да видите тук:
Благодарности
Бихме искали да благодарим на C Bingham за нейния анализ на HNF-1β мутации в индекса.
- Едностранна дуплексна система за събиране с непълно дублиране на уретери в десния бъбрек в
- Вегетарианската диета и хроничната бъбречна болест - DaVita
- Разбиране на Ектопични бъбреци Национална фондация за бъбреците
- Планът на Фед за 2020 г. донесе дългоочакваната иновация на бъбречните заболявания MobiHealthNews
- Какви храни трябва да избягвам, за да предотвратявам камъни в бъбреците The New York Times