Силвия Лай
1 Катедра по транслационна и прецизна медицина, Университет Сапиенца в Рим, 00185 Рим, Италия; [email protected] (А.М.); [email protected] (A.M.P.); moc.liamg@odarrucaraihcanna (A.C.); ti.liamtoh@innavoigsutnip (G.P.)
Алесио Молфино
1 Катедра по транслационна и прецизна медицина, Университет Сапиенца в Рим, 00185 Рим, Италия; [email protected] (А.М.); [email protected] (A.M.P.); moc.liamg@odarrucaraihcanna (A.C.); ti.liamtoh@innavoigsutnip (G.P.)
Масимо Тесторио
2 Отдел по акушерско-гинекологични науки и урологични науки, Нефрологичен отдел, Университет Сапиенца в Рим, 00185 Рим, Италия; [email protected]
Адолфо М. Перота
1 Катедра по транслационна и прецизна медицина, Университет Сапиенца в Рим, 00185 Рим, Италия; [email protected] (А.М.); [email protected] (A.M.P.); moc.liamg@odarrucaraihcanna (A.C.); ti.liamtoh@innavoigsutnip (G.P.)
Анакиара Курадо
1 Катедра по транслационна и прецизна медицина, Университет Сапиенца в Рим, 00185 Рим, Италия; [email protected] (А.М.); [email protected] (A.M.P.); moc.liamg@odarrucaraihcanna (A.C.); ti.liamtoh@innavoigsutnip (G.P.)
Джовани Пинтус
1 Катедра по транслационна и прецизна медицина, Университет Сапиенца в Рим, 00185 Рим, Италия; [email protected] (А.М.); [email protected] (A.M.P.); moc.liamg@odarrucaraihcanna (A.C.); ti.liamtoh@innavoigsutnip (G.P.)
Даниеле Пиетручи
3 Катедра по биология, Университет Tor Vergata в Рим, 00133 Рим, Италия; [email protected] (D.P.); ti.2amorinu@iredised (AD)
Валерия Унида
3 Катедра по биология, Университет Tor Vergata в Рим, 00133 Рим, Италия; [email protected] (D.P.); ti.2amorinu@iredised (AD)
Давиде Ла Рока
3 Катедра по биология, Университет Tor Vergata в Рим, 00133 Рим, Италия; [email protected] (D.P.); ti.2amorinu@iredised (AD)
Силвия Биока
4 Катедра по системна медицина, Университет Tor Vergata в Рим, 00133 Рим, Италия
Алесандро Десидери
3 Катедра по биология, Университет Tor Vergata в Рим, 00133 Рим, Италия; [email protected] (D.P.); ti.2amorinu@iredised (AD)
Свързани данни
Резюме
1. Въведение
В това проучване ние оценихме ефектите на LPD (0,6 g/kg/ден), със или без приема на пребиотичния инулин (19 g/ден), върху микробиотата и клиничните параметри при пациенти с ХБН.
2. Материали и методи
Протоколът за изследването беше одобрен от Местната комисия по етични клинични изследвания с номер на протокол 302/17, 4465 и получихме писменото съгласие на всеки записан пациент.
2.1. Учебен дизайн и предмети
2.2. Пациенти
Записахме пациенти с бъбречна болест 3G – 4G на стадия на ХБН, подобряваща глобалните резултати (KDIGO). Интервенционалните, контролните и здравите субективни групи се съчетават по пол и бъбречна функция. EGFR се изчислява със съкратената формула за епидемиология на хроничните бъбречни заболявания (CKD-EPI), както е определено от Levey et al. [11]. Девет пациенти са засегнати от автозомно доминиращо поликистозно бъбречно заболяване, петима пациенти с ХБН не са провеждали бъбречна биопсия, един пациент е имал гломерулонефрит на Бергер и един пациент има хроничен пиелонефрит. Статини, антихипертензивни и антитромбоцитни терапии и/или терапии с калциеви, калцитриолови и фосфатни свързващи вещества бяха продължени при всички пациенти, включени в проучването.
2.3. Критерии за включване
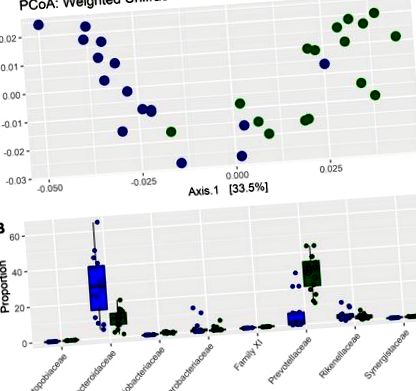
Пациенти на възраст> 18 и Фигура 1 А). Значителни разлики в бактериалния състав също бяха потвърдени с помощта на теста PERMANOVA (p = 1 × 10 −4; F = 1.74). Диференциалното изобилие показва, че осем бактериални семейства са били значително различни между пациентите с ХБН и HC (Фигура 1 B, допълнителна таблица S1). Чревната микробиота на пациенти с ХБН съдържа по-високи нива на Bacteroidaceae, Enterobacteriaceae и Rickenellaceae, докато HC групата се характеризира с по-високи нива на Atopobiaceae, Coriobacteriaceae, Clostridiales Family XI, Prevotellaceae и Synergistaceae.
Микробно разнообразие и таксономичен състав при пациенти с хронично бъбречно заболяване (ХБН) и здрави контролни субекти (HC): (A) основен координатен анализ (PCoA) състав на таксономичния състав на фекалната микробиота при пациенти с ХБН (сини точки) и контролите (зелени точки) и (Б.) честоти на бактериални семейства при пациенти с ХБН (сини участъци) и контроли (зелени плотове).
3.2. Ефект от диетичната интервенция и приема на инулин върху чревната микробиота при пациенти с ХБН
(A) PCoA графика на фекалния таксономичен състав на пациенти с ХБН преди и след 6-месечна диетична интервенция. (Б.) PCoA графика на фекалния таксономичен състав на пациенти с ХБН преди и след 6-месечна диетична интервенция, включваща нискобелтъчна диета (LPD) и прием на инулин. Пробите, събрани преди диетичната интервенция, са маркирани с квадрат, докато пробите, събрани след диетичната интервенция, са маркирани с кръг. Цветовете показват пациентите. Използвахме претеглени UniFrac показатели за сравнение на микробиотата.
Taxa променен при пациенти с ХБН след 6-месечна диетична интервенция (A) или след 6 месеца диетична интервенция и прием на инулин (Б.). Оста Y показва процента четения, свързани с семейства бактерии. Честотата на бактериите преди и след интервенцията се отчита съответно в зелено и червено.
Taxa се променя между пациенти с ХБН след 6 месеца диетична интервенция (зелено) или след 6 месеца диетична интервенция и прием на инулин (червено).
3.3. Ефект от диетичната интервенция и приема на инулин върху клиничните параметри при пациенти с ХБН
Установихме значително намаляване на SUA и CRP при пациенти, лекувани с LPD и инулин (p = 0,018 и p = 0,003, съответно), но не и при пациенти, лекувани само с LPD, и имаше значително увеличение на серумния бикарбонат както при пациенти, лекувани само с LPD (HCO3 - при T0: 20.32 ± 2.42; HCO3 - при T1: 23.88 ± 2.81; p = 0.026) или с LPD и инулин (HCO3 - при T0: 22.17 ± 2.39; HCO3 - при T1: 25.01 ± 2.22; p = 0,01). Също така наблюдаваме значително намаляване на TNF-α (T0: 171,2 ± 90,3; T1: 116,2 ± 62,5; p = 0,041) и NOX2 (T0: 0,67 ± 0,1; T1: 0,58 ± 0,13; p = 0,027) при пациенти, лекувани с LPD и инулин, докато не са наблюдавани промени по отношение на циркулирането на IL-1β (p = 0.529) и IL-6 (p = 0.828) сред двете групи. Също така не открихме значителна разлика в eGFR при T1 между двете групи (p = 0,636).
Успоредно с това, сред пациентите, лекувани с LPD и инулин, наблюдаваме подобрение на елементите „функциониране на физическата роля“ и „възприятия за общото здраве“ на SF-36 (p = 0,03 и p = 0,01, съответно).
4. Дискусия
Корекцията на метаболитната ацидоза е от съществено значение, тъй като тя е силен стимул за протеинов и мускулен катаболизъм, заболявания на минералния метаболизъм, инсулинова резистентност, хиперкалиемия, както и като известен сърдечно-съдов рисков фактор и фактор за прогресия към ESRD [37].
Нашето проучване има няколко ограничения, включително малкия брой разглеждани пациенти, което ограничава интерпретацията на резултатите и не позволява да се правят категорични заключения. Следователно са необходими допълнителни проспективни проследяващи проучвания с по-голям брой пациенти, за да се потвърдят нашите наблюдения. Значителна част от пациентите са били на няколко лекарства с потенциално въздействие върху различни метаболитни показатели, което може да е объркало резултатите. Освен това периодът на проследяване беше сравнително кратък.
5. Заключения
В заключение, в настоящото проучване открихме значително намаляване на нивата на CRP, TNF-α, NOX2 и SUA, когато пациентите следват LPD, свързан с инулин. Освен това открихме значително подобрение на метаболитната ацидоза и качеството на живот при пациентите. Тези резултати предполагат, че различни интервенции, опитващи се да модулират чревния микробиом, могат да представляват стратегии за подобряване на клиничните резултати при пациенти с ХБН и могат да осигурят полезни терапевтични ефекти чрез потискане на индукцията на iNOS и подобрения в качеството на живот на пациентите с ХБН.
Благодарности
Изработено с безусловния принос на Schär AG SPA и CaDiGROUP Nutraceutici.
- Ефект на отслабването при използване на формула диета върху бъбречната функция при пациенти със затлъстяване с диабет
- Ефект от аеробни упражнения, диета с ниско съдържание на мазнини и високо съдържание на мазнини върху параметрите на тестисите и сперматозоидите в
- Клинична оценка на противовъзпалителен и антиоксидантен диетичен ефект при 30 кучета, засегнати от
- Ефект на диета с ниско съдържание на протеини, допълнена с кетокиселини върху автофагията и възпалението при 56
- Диета за пациенти на диализа