Резюме
ОБЕКТИВЕН:
Да се оцени ефектът и безопасността на лечението с нискокалорична формула диета върху бъбречната функция и протеинурия при пациенти със затлъстяване с диабетна нефропатия.
ДИЗАЙН:
Проспективно проучване за безопасност и ефикасност на 4-седмична нискокалорична (11–19 kcal/kg/ден) нормално протеинова (0,9–1,2 g/kg/дневна) диета, частично допълнена с формула диета.
ТЕМИ:
Общо 22 пациенти със затлъстяване с диабетна нефропатия (ИТМ: 30,4 ± 5,3 kg/m 2, HbA1c: 7,1 ± 1,4%, серумен креатинин: 172,4 ± 57,5 μmol/l, протеин в урината: 3,3 ± 2,6 g/ден).
РЕЗУЛТАТИ:
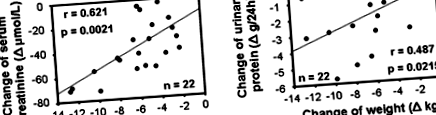
Средното телесно тегло намалява с 6,2 ± 3,0 kg. Средното систолично кръвно налягане, креатинин, азот в уреята в кръвта, протеин в урината и 8-хидроксидезоксигуанозин намаляват значително със 7,5 ± 12,7 mmHg, 41,6 ± 23,9 μmol/l, 1,50 ± 1,61 mmol/l, 1,8 ± 1,7 g/ден и 3,1 ± 3,6 ng/mg креатинин, съответно. Нито един пациент не е имал повишен серумен креатинин и протеин в урината. Средният креатининов клирънс (40,6 ± 17,9 до 46,1 ± 14,6 ml/s/1,73 m 2) и серумният албумин не показват значителни промени. Δсерумният креатинин и Δуринарният протеин корелират с Δ теглото на тялото (r= 0.62 и 0.49, съответно) и Δвисцерална мастна област (r= 0,58 и 0,58, съответно), но не корелира с Δсистолично кръвно налягане, Δ кръвна глюкоза на гладно и Δ площ на подкожната мазнина.
ЗАКЛЮЧЕНИЕ:
Тези резултати предполагат, че намаляването на теглото с формула може да подобри бъбречната функция и протеинурията безопасно за кратко време при пациенти със затлъстяване с диабетна нефропатия.
Въведение
Методи
Пациенти
Общо 22 пациенти със затлъстяване (16 мъже и шест жени) с диабетна нефропатия са проучени и наблюдавани при хоспитализация. Избрахме пациенти, които отговарят на следните критерии: затлъстяване (индекс на телесна маса (ИТМ)> 25 kg/m 2), наличие на диабетна ретинопатия, протеинурия (пикочен албумин> 300 mg/ден) и серумно ниво на креатинин под 265,2 μmol/l . Изключени бяха пациенти с нестабилна диабетна ретинопатия и наличие на плеврален излив и тежък оток на краката. Изходните характеристики на тези пациенти от проучването са показани в Таблица 1. Преди проучването на пациентите е предписан дневен калориен прием от 25–30 kcal/kg и 0,8 g/kg протеин поне за 3 месеца. Лекарства като статини, пробукол, инхибитори на ангиотензин-конвертиращия ензим, ангиотензин-рецепторни блокери, β-блокерите и диуретиците, които са приемани повече от 2 месеца преди проучването, са продължили по време на това проучване, при условие че дозите остават непроменени. Лекарствата за захарен диабет като инсулин и сулфонил уреи са намалени или прекратени по време на хипогликемия.
Диети
На пациентите беше предписан общ дневен калориен прием от 740 или 970 kcal (11–19 kcal/kg). Формула с диета, състояща се от течен протеин (ObeCure; US Cure Inc. Токио, Япония), осигуряваща 170 kcal/пакет, използвана като част от диетата. Всеки ден в продължение на 4 седмици пациентите консумирали едно хранене с адаптирано диетично хранене, съдържащо 170 kcal и две обикновени ястия по 400 kcal всяко (общо; 970 kcal), или две хранения с адаптирано хранене и едно обикновено хранене (общо; 740 kcal) . Приемът на сол е бил 2,79 g/ден за диетата от 740 kcal и 4,90 g/ден за диетата от 970 kcal/ден.
Клинични и лабораторни измервания
Измерването на телесното тегло и вземането на кръв за лабораторни изследвания бяха извършени след еднодневно гладуване. Кръвното налягане се измерва следобед след 5 минути почивка в седнало положение. Двадесет и четири часови проби от урина бяха събрани за измерване на уринарен протеин и креатининов клирънс. Креатининовият клирънс се изчислява чрез измерване на вътрешния креатинин в серума и урината. Площта на висцералната мазнина беше оценена с помощта на CT. CT сканирането се извършва на пъпно ниво, като субектът почива в легнало положение. Висцералната мастна област беше проследена ръчно по вътрешната страна на коремната стена и броят на пикселите, показващи CT стойности между -50 и -150 Hounsfield единици беше изчислен за този регион. Площта на подкожната мазнина се изчислява, както следва: обща площ на мазнините - висцерална мастна област. 8-хидроксидезоксигуанозин в урината (8-OHdG) се счита за биологичен маркер на in vivo окислително увреждане на ДНК. 10 В това проучване използвахме 8-OHdG като маркер за оксидативен стрес.
Телесно тегло, систолично кръвно налягане, диастолично кръвно налягане, азот в уреята в кръвта (BUN), серумен креатинин, серумен албумин, кръвна глюкоза на гладно, HbA1c, общ холестерол (TC), триглицериди (TG) и липопротеинов холестерол с висока плътност (HDL-C ), уринарният протеин и креатининовият клирънс се измерват веднъж седмично (седмица 0–4). Висцералните мазнини, подкожната мастна тъкан и 8-OHdG бяха измерени преди и след проучването.
Информирано съгласие
Обяснихме на пациентите, че проучването ще бъде прекратено при следните обстоятелства: влошаване на серумния креатинин и протеинурия, прогресия на диабетната ретинопатия и проблем, свързан със загуба на тегло, използвайки формула диета в проучването. С пълно информирано съгласие разследването беше разрешено от всички пациенти.
Статистически анализ
Резултатите са изразени като средно ± sd. A т-тестът е използван за групови сравнения. P-стойности на
Резултати
По време на 4-те седмици нито един пациент не е показал прогресия на диабетната ретинопатия в това проучване. Средното телесно тегло е намаляло значително (P 2). Висцералните мазнини са намалели значително (P 2, а подкожните мазнини също са намалели значително (P 2. 8-OHdG показа значително намаление (P Фигура 1
По време на 4-те седмици в това проучване, средният 8-OHdG (считан за маркер за оксидативен стрес) намаля значително (Таблица 1). Средният 8-OHdG обаче не показва значима корелация със загуба на тегло (r= 0,15, P= 0,66), намаляване на серумния креатинин (r= 0,02, P= 0,94), или намаляване на протеина в урината (r= 0,23, P= 0,50).
Промените в серумния креатинин на загуба на тегло и промените в уринарния протеин на загуба на тегло са стратифицирани от 4 степени на загуба на тегло. Не са открити различия между групите за промяната на серумния креатинин (Фигура 3а) и за промяната на уринарния протеин (Фигура 3b).
Промяна на серумния креатинин за загуба на тегло (а) и промяна на протеина в урината за загуба на тегло (б), стратифицирана от четири степени на загуба на тегло. Не са наблюдавани междугрупови разлики в промяната на серумния креатинин (а) и промяната в уринарния протеин (б). Пръчките представляват средната стойност ± sd.
Дискусия
Обикновено се счита, че висококалоричната диета с ниско съдържание на протеини защитава бъбречната функция и предотвратява влошаването на протеинурията при диабетна нефропатия. 5, 6, 7 Корекцията на анормалната гломерулна хемодинамика е механизмът, чрез който диетата с ниско съдържание на протеини подобрява бъбречното увреждане при диабетна нефропатия. 11 Въпреки това, ефектът от загубата на тегло върху бъбречната функция при пациенти със затлъстяване с диабетна нефропатия не е напълно изяснен. В това проучване наблюдавахме пациенти със затлъстяване с диабетна нефропатия, лекувани с нискокалорична нормално протеинова диета в продължение на 4 седмици при хоспитализация. В резултат на това средният серумен креатинин намалява значително с 41,6 ± 28,9 μmol/l, а средният пикочен протеин също намалява значително с 1,8 ± 1,7 g/ден. Въпреки че серумният креатинин може да бъде повлиян от намаляване на скелетната мускулатура, средният увеличен клирънс на креатинина показва очевидно увеличение в това проучване (не е значително). Тези резултати предполагат, че нискокалоричната диета, приемана от затлъстели пациенти с диабетна нефропатия, може да подобри бъбречната функция и протеинурията в краткосрочен план.
Беше проучена безопасността на загуба на тегло при затлъстели пациенти с диабетна нефропатия. Въпреки че бързият гликемичен контрол може да ускори прогресията на диабетната ретинопатия, 26 нито един пациент не е показал прогресия на ретинопатията в това проучване. Серумният албумин не се е променил значително, въпреки че се използва формулата диета. Важно е да се отбележи, че всички пациенти са показали намаление на серумния креатинин и протеини в урината. За да се установи оптималната загуба на тегло за подобряване на бъбречната функция, промените в серумния креатинин и протеини в урината на загуба на тегло са стратифицирани по степени на загуба на тегло. Степента на подобряване на бъбречната функция и протеинурията не се различават сред степента на загуба на тегло. Тези открития предполагат, че за кратък период на наблюдение от 4 седмици, серумният креатинин и уринарният протеин се подобряват, докато има загуба на тегло, независимо от размера на загубата. С други думи, краткосрочната употреба на формула диета за постигане на загуба на тегло изглежда безопасен метод за подобряване на бъбречната функция и протеинурия при затлъстели пациенти с диабетна нефропатия, тъй като ефектът се постига, докато пациентът отслабне без риск от прекомерно отслабване.
В това проучване ние използвахме диета с формула, осигуряваща 62–64 g протеин (0,9–1,2 g/kg) на ден като нормална протеинова диета за предотвратяване на протеинов катаболизъм. Обикновено при диабетна нефропатия се препоръчва диета с ниско съдържание на протеини. Накамура и др 9 съобщават, че натоварванията с аланин, глицин и аргинин предизвикват гломерулна хиперфилтрация in vivo. Аминокиселинният състав на ObeCure, нормално протеинова диета, може да не повлияе неблагоприятно на диабетната нефропатия. В бъдеще трябва да сравним нискобелтъчна диета за затлъстели пациенти с диабетна нефропатия. В това проучване загубата на тегло може да е подобрила нефропатията, свързана със затлъстяването, но дали загубата на тегло подобрява диабетната нефропатия, не е напълно изяснено. Трябва да проведем дългосрочно проучване за ефекта от загубата на тегло върху диабетната нефропатия при затлъстели лица.
Заключение
Загуба на тегло, използвайки формула диета подобри бъбречната функция и протеинурия при пациенти със затлъстяване с диабетна нефропатия в краткосрочно проучване. Средният серумен креатинин и средният протеин в урината намаляват значително и както серумният креатинин, така и протеинът в урината корелират значително със загубата на тегло. Тези резултати предполагат, че загубата на тегло при пациенти със затлъстяване с диабетна нефропатия, постигната чрез приемане на диета с формула, може да подобри бъбречната функция и протеинурията безопасно в краткосрочен план, а промените в получените от адипоцити цитокини и оксидативният стрес могат да бъдат механизмите, чрез които загубата на тегло се подобрява бъбречна функция и протеинурия при диабетна нефропатия със затлъстяване.
Препратки
De Fronzo RA. Диабетна нефропатия: етиологични и терапевтични съображения. Диабет Rev 1995; 3: 510–564.
Могенсен CE. Как да защитим бъбреците при пациенти с диабет със специално позоваване на IDDM. Диабет 1997; 46: S104 – S110.
Изследователската група за контрол и усложнения на диабета. Ефектът на интензивното лечение на диабета върху развитието и прогресирането на дългосрочни усложнения при инсулинозависим захарен диабет. N Engl J Med 1990; 329: 977–986.
Kedziora-Kornatowska KZ, Luciak M, Blaszczyk J, Pawlak W. Липидна пероксидация и активност на антиоксидантните ензими в еритроцитите на пациенти с неинсулинозависим диабет със или без нефропатия. Нефрол Dial трансплантация 1998; 13: 2829–2832.
Barsotti G, Ciardella F, Morelli E, Cupisti A, Mantovanelli A, Giovannetti S. Хранително лечение на бъбречна недостатъчност при диабетна нефропатия тип 1. Clin Nephrol 1988; 29: 280–287.
Walker JD, Bending JJ, Dodds RA, Mattock MB, Murrells TJ, Keen H, Viberti GC. Ограничение на хранителните протеини и прогресиране на бъбречната недостатъчност при диабетна нефропатия. Лансет 1989; ii: 1411–1415.
Zeller K, Wittaker E, Sullivan L, Raskin P, Jacobson HR. Ефект от ограничаването на диетичния протеин върху прогресията на бъбречната недостатъчност при пациенти с инсулинозависим захарен диабет. N Engl J Med 1991; 324: 78–84.
Praga M, Hernandez E, Andres A, Leon M, Ruilope LM, Rodicio JL. Ефект от загубата на телесно тегло и лечението с каптоприл върху протеинурията, свързана със затлъстяването. Нефрон 1995; 70: 35–41.
Nakamura H, Ebe N, Ito S, Shibata A. Бъбречни ефекти на различни видове протеини при здрави доброволци и пациенти с диабет. Грижа за диабета 1993; 16.: 1071–1075.
Марк К, Карлос Дж, Брус Н. 8-хидрокси-2′-дезоксигуанозин в урината като биологичен маркер на in vivo окислително увреждане на ДНК. Proc Natl Acad Sci САЩ 1989; 86: 9697–9701.
Parving HH, Kastrup H, Smidt UM, Andersen AR, Feldt-Rasmussen B, Christiansen JS. Нарушена авторегулация на скоростта на гломерулна филтрация при пациенти с диабет тип 1 (инсулинозависими) с нефропатия. Диабетология 1984; 27: 547–556.
Обединено кралство Проспективна група за изследване на диабета Строг контрол на кръвното налягане и риск от макросъдови и микросъдови усложнения при диабет тип 2: UKPDS 38. BMJ 1998; 317: 703–713.
Пробната изследователска група за контрол на диабета и усложненията. Ефектът на интензивното лечение на диабета върху развитието и прогресирането на дългосрочни усложнения при инсулинозависим захарен диабет. N Engl J Med 1993; 329: 977–986.
Ohkubo Y, Kishikawa H, Araki E, Miyata T, Isami S, Motoyoshi S, Kojima Y, Furuyoshi N, Shichiri M. Интензивната инсулинова терапия предотвратява прогресирането на диабетните микроваскуларни усложнения при японски пациенти с неинсулинозависим захарен диабет: рандомизирано проспективно 6-годишно проучване. Diabetes Res Clin Pract 1995; 28: 103–117.
Cianciaruso B, Bellizzi V, Minutolo R, Tavera A, Capuano A, Conte G, De Nicola L. Прием на сол и бъбречен изход при пациенти с прогресиращо бъбречно заболяване. Майнер Електролит Metab 1998; 24: 296–301.
Allen TJ, Waldron MJ, Casley D, Jerums G, Cooper ME. Ограничаването на солта намалява хиперфилтрацията, уголемяването на бъбреците и албуминурията при експериментален диабет. Диабет 1997; 46: 19–24.
Jennette JC, Charles L, Grubb W. Гломеруломегалия и фокална сегментна гломерулосклероза, свързани със затлъстяване и синдром на сънна апнея. Am J Kidney Dis 1987; 10: 470–472.
Kambham N, Markowitz G, Valeri AM, Lin J, D'Agati VD. Гломерулопатия, свързана със затлъстяването: възникваща епидемия. Бъбрек Int 2001; 59: 1498–1509.
Morales E, Angeles M, Leon M, Hernandez E, Praga M. Благоприятни ефекти от загуба на тегло при пациенти с наднормено тегло с хронични протеинови нефропатии. Am J Kidney Dis 1980; 41: 319–327.
Stokholm KH, Brochner-Mortensen J, Hoilund-Carlsen PF. Повишена скорост на гломерулна филтрация и адренокортикална функция при жени със затлъстяване. Int J Obes 1980; 4: 57–63.
Kasiske BL, Crosson JT. Бъбречно заболяване при пациенти с масивно затлъстяване. Arch Intern Med 1986; 146: 1105–1109.
Wolf G, Hamann A, Han DC, Helmchen U, Thaiss F, Ziyadeh FN, Stahl RA. Лептинът стимулира пролиферацията и TGF-β експресия в ендотелни клетки на бъбречна гломерула: потенциална роля в гломерулосклерозата. Бъбрек Int 1999; 56: 860–872.
van Harmelen V, Elizalde M, Ariapart P, Bergstedt-Lindqvist S, Reynisdottir S, Hoffstedt J, Lundkvist I, Bringman S, Arner P. Асоциацията на експресията на човешкия адипозен ангиотензиногенен ген с коремното разпределение на мазнините при затлъстяване. Int J Obes Relat Metab Disord 2000; 24: 673–678.
Erdos B, Snipes JA, Miller AW, Busija DW. Цереброваскуларната дисфункция при плъхове със затлъстяване Zucker се медиира от оксидативен стрес и протеин киназа С. Диабет 2004; 53: 1352–1359.
Sonta T, Inoguchi T, Tsubouchi H, Sekiguchi N, Kobayashi K, Matsumoto S, Utsumi H, Nawata H. Доказателства за принос на съдова NAD (P) H оксидаза за повишен оксидативен стрес при животински модели на диабет и затлъстяване. Безплатно Radic Biol Med 2004; 37: 115–123.
Funatsu H, Yamashita H, Ohashi Y, Ishigaki T. Ефект на бързия гликемичен контрол върху прогресията на диабетната ретинопатия. Jpn J Офталмол 1992; 36: 356–367.
- Диета за поддържане на загуба на тегло и метаболитно здраве при затлъстели жени в постменопауза - пълна
- Ефект от индуцирана от диетата загуба на тегло върху нивата на липопротеини (а) при затлъстели индивиди със и без
- За затлъстелите хора кето диетата може да означава по-бързо отслабване, отколкото упражняването на традиционна
- Премахване на излишната кожа след отслабване (отказване от пушене, пациенти, стомах, биопсия) - Диета и тегло
- Лесна и евтина диета за отслабване за Android - Изтегляне на APK