Субекти
Резюме
Въведение
Ракът на стомаха е един от най-честите злокачествени карциноми в света 1,2,3. През последните години има около 680 000 нови случая в Китай всяка година, което представлява около половината от глобалните случаи и повечето от тях се диагностицират в напреднали стадии, където резекцията е единственото доказано лечение за удължаване на преживяемостта на пациентите с рак на стомаха 4 . За да се избегнат следоперативни усложнения от анастомотично изтичане и следоперативен паралитичен илеус, традиционната идея е, че храненето не трябва да започва за пациенти след резекция на стомаха, докато плоските или дефекации не документират връщането на функцията на червата 5,6 .
Многобройни доказателства обаче показват, че ранното следоперативно хранене през устата има добър ефект и се счита за безопасен и осъществим метод за управление на пациентите след резекция на колоректален рак 7,8,9,10,11,12. Като един от най-важните елементи на мултимодалните протоколи за подобрено възстановяване след операция (ERAS), който беше предложен за първи път от Kehlet в края на 90-те години на 13, 14, ранното следоперативно перорално хранене, често наричано ранно хранене в рамките на 48 часа след операцията, има са били все по-често възприети в клиничната практика 7,12,15,16,17. През последните 20 години програмата ERAS се прилага широко в колоректалната хирургия и е доказано, че значително намалява постоперативната реакция на стрес и влияе положително на краткосрочните резултати 18,19,20. Въпреки това ситуацията при операция на рак на стомаха не е добре приета 6. Това се дължи главно на факта, че пациентите, подложени на операция за гастректомия, са по-малко толерантни към перорално хранене, отколкото пациентите, подложени на колоректална хирургия, и следователно ERAS лечението на стомашна резекция не е толкова привлекателно за колоректалната хирургия.
Целта на това едноцентрово ретроспективно проучване е да установи добре поносим режим на ранно перорално хранене за нашите локални пациенти с рак на стомаха след гастректомия. От 2014 г. нашата болница стартира внимателно съобразена програма ERAS за тези пациенти. Този протокол за периоперативно управление включва повечето компоненти на ERAS, използвани от много институти 14,21,22,23,24. След приключване на операцията, ранното перорално хранене е включено в програмата и сравнителните резултати в различни аспекти са представени по-долу.
Материали и методи
Дизайн на изследването и критерии за включване/изключване
От май 2014 г. до май 2018 г. са записани общо 87 пациенти с рак на стомаха, които са били подложени на селективна гастректомия. Критериите за включване включват стомашен карцином чрез ендоскопска биопсия, на възраст от 18 до 80 години, селективна гастректомия (междинна или пълна резекция; чрез отворен или лапароскопски подход), нормална функция на органа, без анамнеза за химиотерапия или лъчетерапия преди операцията. Критериите за изключване включват пациенти с рак с обструкция, перфорация или кървене, пациенти с друг рак едновременно, пациенти, които преди това са претърпели стомашна операция, и пациенти с нарушена сърдечна, чернодробна или бъбречна функция.
Периоперативни грижи и проследяване
Оценка на хирургичните резултати
Първичните резултати са следоперативно усложнение (степенувано според класификацията на Clavien-Dindo) 27,28, продължителността на следоперативния болничен престой (DPOS), времето на първия плосък проход (преминаване на газ), 30-дневните нива на реадмисия след освобождаване от отговорност и болнична смъртност. Вторичният резултат беше толерантността към ранното орално хранене (способно да погълне 60% или повече от дадено хранене, което се понася, в противен случай е непоносимо) и спазването на други разпоредби на протокола ERAS.
Статистически анализ
Тъй като размерът на пробата в това проучване беше малък (n = 87), беше проведено проучвателно проучване на всички пациенти. Описателната статистика беше изчислена и в съответствие с общите принципи. Ако непрекъснатите променливи са нормално разпределени, те се представят като средно ± sd. В противен случай те ще бъдат показани чрез медианни (интерквартилен диапазон; IQR) стойности и сравнени с непараметричен тест (Mann-Whitney), докато броят и честотата се използват за категорични променливи. За да се изследва връзката между възможните влияещи фактори и вероятността за реагиращо събитие - Ранна нетолерантност към орално хранене, първо се извърши еднофамилен логистичен регресионен анализ, последван от метод на поетапна регресия. ИЛИ (95% CI) се изчислява за всеки предиктор и OR> 1 показва висок риск от непоносимост, ИЛИ
Резултати
Клиникопатологични характеристики
От май 2014 г. до май 2018 г. в това ретроспективно проучване са включени 87 допустими пациенти. Таблица 7 обобщава клиникопатологичните характеристики на всички участници. Имаше 56 мъже и 31 жени. Сред тях 23 (26%) са на възраст над 70 години. 39 (43%) са имали едно или повече предоперативни медицински състояния, 52 (60%) са имали индекс на телесна маса (ИТМ) по-малко от 25 kg/m 2, а 84 (97%) се считат за притежаващи Американско дружество по анестезиолози ( ASA) степен I или II. 69 пациенти (79%) са претърпели субтотална резекция на стомаха, а 18 пациенти (21%) са подложени на тотална гастректомия; общо 54 пациенти (62%) са претърпели лапароскопски операции, съответно със 7 и 47 случая на тотални и субтотални стомашни резекции. Според седмото издание на класификацията AJCC TNM има 28 (32%), 11 (13%), 46 (53%) и 2 (2%) съответно в TNM етап I, II, III и IV.
Хирургични резултати
Според таблица 8 средното време (IQR) до първия плосък е 2 (1) дни. След изпълнение на критериите за изписване, 59 пациенти (68%) бяха изписани в рамките на POD 6, а средната продължителност (IQR) на следоперативния болничен престой беше 6 (3) дни за всички пациенти (Таблица 8).
Следоперативни усложнения са настъпили при 23 (26%) пациенти след хирургична резекция и възстановяване. От тях 13 (15%) са леки (Clavien-Dindo степен 1), от които 9 (10%) са имали само постоперативно гадене и повръщане, а 3 (3%) са тежки (Clavien-Dindo степен 3-5). Таблица 9 показва подробно описание на тези усложнения. Двама пациенти бяха приети повторно поради стомашна задържане и чревен илеус в рамките на 30 дни след изписването и бяха излекувани чрез консервативно медицинско лечение. Не се наблюдава нито една смъртност в болницата.
Поносимостта към ранно перорално хранене
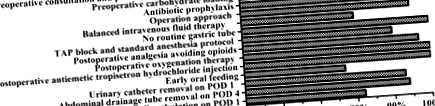
Шестдесет и седем пациенти (77%) успешно започнаха прием на вода на POD 1 и успешно започнаха полутечна диета на POD количество 4 (Таблица 8). Двадесет (23%) пациенти не са могли да понасят следоперативния график за ранно перорално хранене. От тези 20 пациенти 14 пациенти са забавили графика за перорално хранене поради стомашно-чревни симптоми, като повтарящо се гадене, повръщане и постоянен дискомфорт в корема или болка, а 6 пациенти са преустановени с перорален прием изцяло поради следоперативни усложнения (3 случая на паралитичен илеус, 2 случая на луминални кръвоизливи и 1 случай на анастомотично изтичане) (Таблица 9). В допълнение, съгласно фиг. 1, може да се види, че при всички елементи от протокола ERAS пациентите са имали най-ниско съответствие с ранното перорално хранене (77%), последвано от другите две по-ниски: Балансирана интравенозна течна терапия (80% ) и Пълна амбулация на POD 1 (82%).
Съответствие с елементите на протокола ERAS.
Възможни предиктори за ранна непоносимост към перорално хранене след резекция на стомаха
Двадесет (23%) пациенти не са спазили ранния следоперативен график за перорално хранене след началото на приема на вода или полутечна диета. За да разкрием променливи, които показват ранната следоперативна непоносимост към перорално хранене, сравнихме успеха и неуспеха по отношение на възрастта на пациента, пола, медицинската съпътстваща болест, степента на ASA, ИТМ, вида на резекцията, оперативния подход и етапа на TNM. Резултатите от едномерния анализ на логистичната регресия (Таблица 10) показват, че оперативният подход може да бъде релевантен фактор, показващ ниското съответствие на пациентите с графика за ранно перорално хранене в протокола ERAS, и това е единственият фактор в модела, който използва поетапен подход . TNM етап III срещу. I (P = 0,06) също показва пределна значимост, свързана с отклонението на графика.
Дискусия
Ракът на стомаха е един от най-често срещаните злокачествени заболявания и резекцията е единственият начин да се удължи преживяемостта на пациентите с рак на стомаха 1,29. През последните години, с нарастващата честота на диагностициране на ранния рак на стомаха, непрекъснатото подобряване на лапароскопската гастректомия, общата степен на преживяемост на пациентите след операция на рак на стомаха също се увеличава 30,31,32,33,34. Следователно как да се подобри качеството на следоперативния живот и по-бързото възстановяване на пациенти с рак на стомаха се превърна във фокус на медицинските работници.
4 седмици след операцията постепенно преминавайте към нормална диета, яжте 6 пъти на ден с калории на всяко хранене между 250 и 300 kcal.
На теория се приема, че възрастта на пациента, степента на резекция на тумора, хирургичният подход и етапът на тумора оказват влияние върху ранната перорална толерантност към хранене при пациенти с постоперативен рак на стомаха. Например, скорошно проучване на Shimizu и др. подкрепя, че в сравнение с дисталните групи за гастректомия (DG), следоперативният престой е значително по-кратък в общите групи за гастректомия (TG), а честотата на следоперативни усложнения след ранно перорално хранене е по-ниска 40. Не са открити обаче разлики в продължителността на следоперативния престой между ранното орално хранене и нормалните групи от пациентите, получаващи дистална гастректомия (DG). Но е установена висока честота на следоперативни усложнения в ранните групи за перорално хранене на пациенти с DG 40. Този доклад изглежда показва, че степента на резекция (а не хирургичен подход) може да съкрати следоперативния престой и да намали следоперативните усложнения като полезни резултати от ранното перорално хранене. Независимо от това, както казват авторите, горните изводи далеч не са потвърдени поради недостатъчен размер на извадката в групата на TG, което изисква допълнителни изследвания.
Заключение
В заключение, това ретроспективно проучване стигна до заключението, че нашият протокол ERAS, включващ поетапно, специфичен за китайския пациент график за ранно перорално хранене, също е безопасен и полезен в сравнение с подобни чуждестранни проучвания в миналото. Той може да съкрати следоперативния престой в болница, без да увеличава честотата на следоперативни усложнения. Освен това, доколкото ни е известно, това е първият вътрешен доклад за подробен и най-важният подходящ план за ранно хранене за китайски пациенти след стомашна операция. Следователно, въпреки че проучването има някои ограничения, като малък размер на извадката и липса на контролни проучвания, то все пак заслужава допълнителни изследвания и популяризиране. И накрая, препоръчваме да се разработи персонализиран, оптимизиран план за орално хранене за местните китайски пациенти с техните диетични навици, раси и други фактори. Заедно с фина настройка на други съществени елементи на настоящия протокол ERAS, е предвидимо в близко бъдеще да бъде предложен по-ефективен протокол ERAS, включващ оптимизиран график за ранно перорално хранене за операция на рак на стомаха.
Наличност на данни
Наборите от данни, генерирани по време и/или анализирани по време на настоящото проучване, са достъпни от съответния автор при разумни искания.
- Приложимост и резултати от ранното орално хранене след тотална гастректомия за рак
- Ранно следоперативно орално хранене след пълна гастректомия при пациенти със стомашен карцином A
- Ранно перорално хранене при пациенти, подложени на избирателна анастомоза на дебелото черво - ScienceDirect
- Ранно срещу традиционно следоперативно перорално хранене при пациенти, подложени на избирателна колоректална
- Ранно срещу забавено (традиционно) следоперативно перорално хранене при пациенти, подложени на колоректално