От Kazuo Kajita, Ichiro Mori, Masahiro, Takahide Ikeda, Hiroyuki Morita и Tatsuo Ishizuka
Изпратено: 9 май 2014 г. Преглед: 16 октомври 2014 г. Публикувано: 1 април 2015 г.
информация за глава и автор
Автори
Кадзуо Каджита *
- Катедра по обща вътрешна медицина, Медицински факултет на университета Gifu, 1-1 Yanagido, Gifu, Япония
Ичиро Мори
- Катедра по обща вътрешна медицина, Медицински факултет на университета Gifu, 1-1 Yanagido, Gifu, Япония
Масахиро
- Катедра по обща вътрешна медицина, Медицински факултет на университета Gifu, 1-1 Yanagido, Gifu, Япония
Такахиде Икеда
- Катедра по обща вътрешна медицина, Медицински факултет на университета Gifu, 1-1 Yanagido, Gifu, Япония
Хироюки Морита
- Катедра по обща вътрешна медицина, Медицински факултет на университета Gifu, 1-1 Yanagido, Gifu, Япония
Тацуо Ишизука
- Отделение по обща вътрешна медицина и ревматология, общинска болница Гифу, 7-1 Кашима-чо, Гифу, Япония
* Адресирайте цялата кореспонденция на: [email protected]
От редактирания том
Редактиран от Колийн Кронигер
1. Въведение
Въпреки значителните изследвания, връзката между затлъстяването и метаболитните нарушения все още не е напълно изяснена. Последните доказателства разкриха, че мастните депа, а не обемът на мазнините, са от съществено значение за определяне на системната чувствителност към инсулин. Мастната тъкан се класифицира във висцерална мастна тъкан, включително епидидимална, мезентериална и периренална мастна тъкан и подкожна мастна тъкан според нейното анатомично местоположение. Увеличаването на висцералната мастна тъкан се счита за свързано с инсулинова резистентност [1, 2]. По-специално се предполага, че мезентериалната мазнина е по-тясно свързана с метаболитните нарушения, тъй като мезентериалната мазнина отделя свободни мастни киселини и други вещества директно в порталната вена [3]. Въпреки че механизмите за регулиране на разпределението на мазнините остават неясни, половите хормони са несъмнено един от определящите фактори.
Тъй като мъжете са склонни да натрупват много повече висцерални мазнини от жените, андрогените се предполагат, че насърчават инсулиновата резистентност. На практика ниските нива на серумен тестостерон насърчават затлъстяването. Многобройни проучвания показват, че андрогенната депривационна терапия (ADT) увеличава риска от затлъстяване, метаболитен синдром, диабет тип 2 и сърдечно-съдови заболявания при пациенти с рак на простатата [4-8]. Basaria и сътр. Посочиха, че при мъже с рак на простатата, лекувани с ADT, се наблюдава висока мастна маса, както и ниска костна плътност и анемия, в сравнение с тези, лекувани без него. Те стигнаха до заключението, че пациентите, получаващи ADT, са изложени на повишен риск от инсулинова резистентност и сърдечно-съдови заболявания. Katznelson et al, съобщават, че процентът телесни мазнини е по-голям при придобити хипогонадни мъже в сравнение с контролите на еугонада, което е подобрено чрез заместителна терапия с тестостерон [9].
Напоследък е установено високо разпространение на хипогонадизъм при мъже със затлъстяване, метаболитен синдром и диабет тип 2. Dhindsa et al, съобщават, че общият тестостерон и свободният тестостерон обратно се свързват с ИТМ и мастната маса [10] при мъже с диабет тип 2. Kapoor et al, в проучване на напречно сечение на 355 пациенти с диабет тип 2, открива явен и граничен хипогонадизъм при 42%, като 42 от тези мъже имат нива на свободен тестостерон
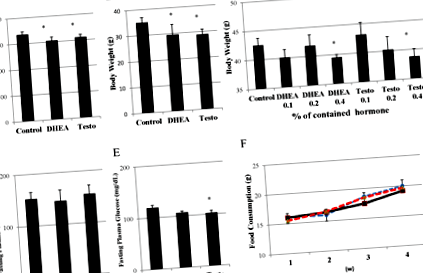
Фигура 1.
Ефекти от прилагането на DHEA и тестостерон върху телесното тегло. Показани са ефекти от лечението с 0,4% DHEA или тестостерон, съдържащ храна за 4 седмици върху телесно тегло при плъхове Wistar (n = 6) (A) и C56/черни мишки (n = 4) (B) на възраст 8 седмици. *: стр
3.2. Ефект на DHEA и тестостерон върху адипоцитите
Прилагането на DHEA или тестостерон потиска теглото на мазнините, включително това на подкожни, епидидимни и мезентериални мазнини (фиг. 2А). В допълнение, както DHEA, така и тестостеронът намаляват размера на адипоцитите еквивалентно (фиг. 2В). Установихме, че лечението с DHEA намалява експресията на PPARy в адипоцитите както in vivo, така и in vitro [42]. Лечението с DHEA и тестостерон намалява по подобен начин нивото на експресия на PPARy в мастна тъкан, изолирана от плъхове Wistar и адипоцити на 3T3-L1 (фиг. 2C, D). Гени, регулирани от PPARy, като FABP 4, LPL и адипонектин, са еднакво регулирани от DHEA и тестостерон в 3T3-L1 адипоцити. Нито един от хормоните не повлиява нивата на експресия на гени, които не са директно регулирани от PPARγ, като SREBP-1 и FAS (данните не са показани). Прилагането на DHEA или тестостерон намалява съдържанието на триглицериди в черния дроб и скелетните мускули до същата степен при плъхове (Фиг. 2 Д, Е).
Фигура 2.
Ефекти от прилагането на DHEA и тестостерон върху адипоцитите. Показани са ефектите от лечението с DHEA или тестостерон за 4 седмици върху теглото на мазнините (черно: подкожно, зелено: епидидимно, синьо: мезентериална мазнина, n = 6) (A) и хистологични находки (B). *: стр
След това изследвахме ефектите на тези хормони върху диференциацията на адипоцитите. Наблюдавахме диференциацията на F442A клетки, тъй като те спонтанно се диференцират в зрели адипоцити, когато достигнат сливането. DHEA и тестостеронът потискат натрупването на триглицериди (фиг. 3А) и появата на PPARy и FABP4 иРНК по време на процеса на диференциация. Тези данни показват, че DHEA и тестостеронът по подобен начин потискат диференциацията на адипоцитите.
Фигура 3.
Ефект от лечението с DHEA и тестостерон върху диференциацията на адипоцитите F442A. Преадипоцитите на F442A се култивират в DMED. Когато клетките достигнат сливане, както се съди по морфологичните находки (0d), към средата се добавят 50 пМ DHEA или тестостерон, последвано от последваща инкубация за посочения период. Натрупването на триглицериди се оценява с оцветяване в маслено червено при 7d (A). Нивата на експресия на PPARy и FABP4 са измерени с PCR в реално време на посочения ден (n = 4) (B). *: стр
3.3. Ефект на DHEA и тестостерон върху митохондриалната биогенеза
Както беше отбелязано по-горе, тъй като прилагането нито на DHEA, нито на тестостерон повлиява консумацията на храна, предположихме, че тези хормони повишават енергийните разходи. Следователно ние изследвахме ефектите от прилагането на тестостерон върху производството на енергия. Мишките бяха третирани със или без тестостерон в продължение на 4 седмици, а след това, консумацията на кислород и двигателната активност бяха измервани чрез индиректна калориметрия. Консумацията на O2 и производството на CO2 се увеличават значително при мишки, лекувани с тестостерон, независимо дали стойностите са нормализирани според телесното тегло или не (Фиг. 4B-E). В допълнение, производството на топлина, чиито стойности са нормализирани според телесното тегло, е повишено при третирани с тестостерон мишки (фиг. 4G). Не е открита разлика в скоростта на дихателен обмен между контролните и лекуваните с тестостерон мишки (фиг. 4Н). За наша изненада прилагането на тестостерон потиска локомоторната активност (Фиг. 4I).
Фигура 4.
Ефекти от лечението с тестостерон върху консумацията на кислород, производството на топлина и двигателната активност. C56/черни мишки на възраст 8 седмици бяха третирани с тестостерон в продължение на 4 седмици и индивидуалната консумация на кислород и двигателната активност бяха определени чрез индиректна калориметрия (А). Кумулативна консумация на O2 за 24 часа (B) и нормализирани стойности по телесно тегло (C), производство на CO2 (D) и нормализирани стойности по телесно тегло (E), производство на топлина за 24 часа (F) и нормализирани стойности по телесно тегло (G ) са показани. Показани са също стойности на RER (H) и двигателна активност (I) за 24 часа. *: стр
Тези резултати показват, че прилагането на тестостерон увеличава основния метаболизъм. Следователно, ние оценихме ефектите от прилагането на тези андрогени върху митохондриалната биогенеза и неговия регулатор нагоре по веригата, PGC1α. Експресията на митохондриален протеин, Cox4 и PGC1α беше повишена в скелетните мускули, но не и кафяв НДНТ или черен дроб, изолирани от лекувани с тестостерон плъхове (Фиг. 5А). Увеличението на Cox4 в скелетната мускулатура, индуцирано от DHEA приложение, е по-малко от това, индуцирано от тестостерон (Фиг. 5В). Индуцираното от тестостерона повишаване на нивата на иРНК на PGC1α и цитохром С са по-големи от тези, индуцирани от DHEA в миотръбите C2C12 (фиг. 5С). Тези резултати показват, че повишената биогенеза на митохондриите от тези хормони води до регулиране на енергийните разходи, което може да доведе до намалено затлъстяване.
Фигура 5.
Ефект от лечението с DHEA и тестостерон върху митохондриалната биогенеза. Плъховете Wistar бяха третирани с DHEA или тестостерон в продължение на 4 седмици. Показани са ефектите от лечението с тестостерон върху експресията на PGC1α и Cox4 в скелетната мускулатура, НДНТ и черния дроб (A). Типичните резултати от уестърн блот са показани в левия панел, а количествените резултати са показани в десния (n = 4). Бяло: контролно, черно: лекувано с тестостерон. *: стр
4. Дискусия
За да изясним механизмите, залегнали в основата на андроген-индуцираното намаляване на теглото, анализирахме ефекта от прилагането на тестостерон върху енергийните разходи. Прилагането както на DHEA, така и на тестостерон повишава ректалната температура при плъхове [44]. Въпреки че не е установена необичайно висока телесна температура, при мишки, лекувани с тестостерон, се наблюдава повишена консумация на O2 и производство на CO2 (фиг. 4A-D) Въпреки че производството на топлина се увеличава при мишки, третирани с тестостерон, не е важно, когато тези стойности не се нормализират по телесно тегло (фиг. 4Е). Нямаме данни за чиста телесна маса или вода. Ако чистата телесна маса не се влияе от тестостерона, индуцираното от тестостерон намаляване на затлъстяването не може да бъде резултат от увеличаване на енергийните разходи. От друга страна, нашите резултати показват, че базалната скорост на метаболизма се увеличава при лекуваните с тестостерон мишки, тъй като производството на топлина при тези мишки не намалява въпреки потисната двигателна активност. Резултатът от потисната двигателна активност при мишки, лекувани с тестостерон, е неочакван, тъй като в ARKO се съобщава и за по-ниска двигателна активност [51]. Все още не можем да обясним това несъответствие, вероятно защото промяната в двигателната активност може да не се случи успоредно с андрогенен сигнал.
Резултатите от нашите проучвания са обобщени на фиг. 6. DHEA и тестостеронът по равно потискат пролиферацията на преадипоцити, диференциацията на адипоцитите и експресията на PPARγ и неговите гени надолу по веригата, включително адипонектин в адипоцитите. Както DHEA, така и тестостеронът регулират PGC1α и митохондриалната биогенеза, по-активно в последните, отколкото в скелетните мускули. Кой орган играе основната роля в индуцираното от андрогените намаляване на затлъстяването, остава интересен проблем. Нашите резултати предполагат, че намаленото затлъстяване при животни, лекувани с тестостерон, може да бъде получено от намалена експресия на PPARγ и потисната диференциация в адипоцити. Умереното потискане на активността на PPARγ от неговия антагонист HX531 води до намаляване на мастната маса и повишена консумация на кислород [56] и следователно индуцираното от андроген намаляване на експресията на PPARγ може да бъде в състояние да повлияе на системния метаболизъм.
Фигура 6.
Ефект на DHEA и тестостерон върху мозъка, адипоцитите и скелетните мускули
Заглушаването на AR за цялото тяло води до затлъстяване с късно начало [51, 56]. Съвременната технология улесни генерирането на специфично за органите делеция на ген. Адипоцитно специфични AR дефицитни мишки показват идентично телесно тегло и затлъстяване с див тип на 20 седмици на възраст в едно проучване, въпреки че авторите не показват данните на по-възрастни мишки [57]. Тъй като късното затлъстяване след 20 седмици е отличителната черта на ARKO, този момент е важен. Обратно, мишките, които нямат AR в централната нервна система, развиват затлъстяване и инсулинова резистентност с късно начало [59]. Въпреки че няколко проучвания съобщават, че нокдаунът, специфичен за миоцитите, не влияе върху телесното тегло и затлъстяването [60, 61], свръхекспресията на AR, специфична за миоцитите, води до повишена скорост на метаболизма и телесна маса на мазнините [62]. Тези резултати предполагат, че скелетните мускули и мозък могат да бъдат отговорни органи за индуцирано от андрогени намаляване на затлъстяването. Понастоящем обаче ролята на AR в адипоцитите в системната инсулинова чувствителност не може да бъде изключена. Ще бъдат необходими допълнителни експерименти, които да помогнат за изясняването на тези въпроси.
- Ефекти против затлъстяване и анти-инсулинова резистентност на напитката от доматен оцет при затлъстяване, предизвикано от диета
- 8 най-добри добавки за повишаване на тестостерона, които помагат за повишаване на тестостерона
- Балансирана диета Energy Diet Smart отзиви на лекари, характеристики и ефекти
- Alli Употреба, дозировка; Информация за страничните ефекти
- Аллергични ефекти на Alternaria в домашен Enviroklenz