Резюме
Заден план
Глутатионът играе решаваща роля в детоксикационната и антиоксидантната системи на клетките и се използва за лечение на остро отравяне и хронични чернодробни заболявания чрез интравенозно инжектиране. Това е първо проучване, изследващо терапевтичните ефекти на пероралното приложение на глутатион при пациенти с неалкохолна мастна чернодробна болест (NAFLD).
Методи
Проучването е отворено, с едно рамо, многоцентрово, пилотно изпитание. Тридесет и четири пациенти с NAFLD, диагностицирани с ултрасонография, бяха проспективно оценени. Всички пациенти първо са подложени на интервенция за подобряване на техните навици на живот (диета и упражнения) в продължение на 3 месеца, последвано от лечение с глутатион (300 mg/ден) в продължение на 4 месеца. Оценихме техните клинични параметри преди и след лечение с глутатион. Ние също така определихме количествено чернодробната мастна тъкан и фиброзата, като използвахме контролирана от вибрации преходна еластография. Основният резултат от проучването е промяната в нивата на аланин аминотрансфераза (ALT).
Резултати
Двадесет и девет пациенти завършиха протокола. Нивата на ALT значително намаляват след лечение с глутатион в продължение на 4 месеца. В допълнение, нивата на триглицериди, неестерифицирани мастни киселини и феритин също намаляват с лечение с глутатион. След дихотомизиране на ALT респондентите въз основа на средно 12,9% намаление спрямо изходното ниво, установихме, че респондентите на ALT са по-млади на възраст и нямат тежък диабет в сравнение с ALT неотговорилите. Параметърът на контролираното затихване също намалява при респондентите на ALT.
Заключения
Това пилотно проучване демонстрира потенциалните терапевтични ефекти от орално приложение на глутатион в практична доза за пациенти с NAFLD. Необходими са мащабни клинични проучвания, за да се провери неговата ефикасност.
Пробна регистрация
UMIN000011118 (дата на регистрация: 4 юли 2013 г.).
Заден план
Безалкохолната мастна чернодробна болест (NAFLD) е важна причина за хронично чернодробно увреждане в световен мащаб [1, 2]. Спектърът на NAFLD варира от неалкохолен мастен черен дроб до неалкохолен стеатохепатит (NASH), цироза и хепатоцелуларен карцином [3]. NAFLD се свързва с метаболитни синдроми и честотата на NAFLD се увеличава с течение на времето [4, 5]. Първата линия на лечение на NAFLD е модификация на начина на живот, за да се постигне намаляване на теглото, особено чрез диета и упражнения [6]. Намаляването на теглото обаче е много трудно за постигане и поддържане. Все още не е установена ефективна терапия за NAFLD.
Глутатионът, γ-L-глутамил-L-цистеинил-глицин, е трипептид, присъстващ във всяка клетка на човешкото тяло [7]. Въпреки че функциите му са сложни и остават обект на настоящите изследвания, смята се, че глутатионът играе решаваща роля в детоксикационните и антиоксидантните системи в клетките. Тъй като е установено, че намаляването на нивата на глутатион в клетките увеличава риска от заболявания и отравяния, директното интравенозно инжектиране на глутатион се използва за лечение на пациенти с хронични чернодробни заболявания и отравяния [8, 9].
Глутатионът се синтезира в клетките от глутаминова киселина, цистеин и глицин. Цистеинът и глицинът се генерират съответно от метионин и серин, а глутаминовата киселина се синтезира от α-кетоглутарат, метаболит на глюкозата. Тези аминокиселини обикновено се доставят от храната. Съобщава се, че пероралното приложение на глутатион не променя нивата на глутатион и глутатион дисулфид в депротеинизираната фракция на кръвта [10] и се предполага, че орално приложеният глутатион се разгражда до съставляващи аминокиселини и не проявява специфична активност отвъд източника на аминокиселини. Съобщава се обаче, че глутатионът може да премине през монослоя на Caco-2 клетки без разграждане [11]. В допълнение, Park et al. съобщава за увеличаване на свързаната с протеините форма на глутатион в човешката кръв след перорално приложение, докато глутатионът в депротеинизираната фракция не се променя [12]. Тези проучвания предполагат, че орално приложеният глутатион се абсорбира в кръвта и може да има ефект върху редокс състоянието в човешкото тяло. Такива открития ни насърчиха да изследваме терапевтичните ефекти на пероралното приложение на глутатион върху NAFLD.
Целта на настоящото проучване е да се демонстрира терапевтичният потенциал на перорално приложение на глутатион в отворено, едноцентрово, многоцентрово, пилотно проучване преди последващи мащабни клинични изпитвания. В това проучване сравнихме клиничните параметри преди и след лечение с глутатион. Също така оценихме контролиран параметър на затихване (CAP) и измерване на сковаността на черния дроб (LSM), както беше определено чрез контролирана от вибрации преходна еластография (VCTE).
Методи
Пациенти и дизайн на проучването
Протоколът за изследване е проведен в съответствие с насоките, съдържащи се в Декларацията от Хелзинки, и е одобрен от комитетите по етика на градския университет в Йокохама и Медицинския университет в Киото. Писмено информирано съгласие е получено от всички участници преди влизане в проучването. Проучването е регистрирано в Регистъра за клинични изпитвания на университетската болница (UMIN) (UMIN000011118).
Тъй като се съобщава, че нивата на серумна аланин аминотрансфераза (ALT) предсказват хистологичния ход на NASH и тъй като е необходим строг контрол на ALT, за да се предотврати прогресията на NASH [13], основният резултат от това проучване е промяна в нивата на ALT.
Антропометрични и лабораторни оценки
Теглото и височината на пациента се измерват с помощта на калибрирана скала, след като пациентите свалят обувките и тежкото си облекло. Взети са проби от венозна кръв, след като пациентите са гладували цяла нощ (12 часа). Брой на тромбоцитите и концентрации на кръвна захар на гладно (FBS), хемоглобин A1c (HbA1c), имунореактивен инсулин (IRI), липопротеин с висока плътност (HDL) холестерол, холестерол на липопротеини с ниска плътност (LDL), триглицериди, неестерифицирани мастни киселини ( NEFA), аспартат аминотрансфераза (AST), ALT, у-глутамил транспептидаза, феритин и тип IV колаген 7 бяха измервани с помощта на стандартни лабораторни техники преди и след лечение с глутатион. Пациентите с FBS ≥126 mg/dL, HbA1c ≥6.5% и/или понастоящем използващи антидиабетни лекарства са определени като диабет според критериите на Японското общество за диабет [14].
Глутатионът в депротеинизираната фракция и свързаната с протеините фракция на плазмата се определят, използвайки метода, описан от Park et al. [12]. Накратко, 100 μL плазма се смесва с три части етанол. Супернатантът се използва като депротеинизираната фракция. Утайката се екстрахира с използване на 100 μL 5% трихлороцетна киселина, съдържаща 2% 2-меркаптоетанол. Супернатантът се използва като фракция, свързана с протеина. Глутатионът в тези фракции се алкализира и дериватизира с 6-аминохинолил-N хидрокси сукцинимидил карбамат, както е описано по-горе. Производните се разтварят и откриват с помощта на течна хроматография/йонизация с електронно пулверизиране/тандемна спектрометрия в режим на многореакционно наблюдение.
Контролирана от вибрации преходна еластография
VCTE се извършва с помощта на устройство с М-сонда (Fibroscan; EchoSens, Париж, Франция). Подробности за техниката и процедурата за изследване на LSM са описани по-рано [15, 16]. CAP се измерва с помощта на VCTE за стадиране на стеатоза. Техниката е патентован алгоритъм, базиран на коефициента на ултразвуково затихване на срязващата вълна на VCTE, оценка на общото ултразвуково затихване при 3,5 MHz. CAP използва същите радиочестотни данни като LSM и се оценява само ако придобиването е валидно. Изразява се в децибели на метър. Измерванията бяха получени от десния лоб на черния дроб през междуребрените пространства, с пациент, легнал в гръбначна декубитална позиция и дясната ръка в максимално отвличане. Само VCTE измервания, базирани на поне 10 валидни снимки и успеваемост ≥60%, се считат за надеждни и се използват за статистически анализ.
Статистически анализ
Данните са изразени като средно ± стандартно отклонение, освен ако не е посочено друго. Размерът на извадката беше определен чрез препратка към предишен доклад [17]. Изчислихме, че при този размер на извадката изследването ще има 80% мощност да открие абсолютна разлика в степента на подобрение на ALT от 30 процентни пункта, с двустранна грешка от тип 1 от 0,05. Всички статистически анализи бяха извършени с помощта на JMP ver. 11.2.0 софтуер (SAS Institute, Cary, NC, USA). Едномерните сравнения между групи пациенти бяха анализирани с помощта на Student's т-тест или U-теста на Ман-Уитни, според случая. A стр-стойност
Резултати
Биохимичен отговор след 4-месечно лечение с глутатион
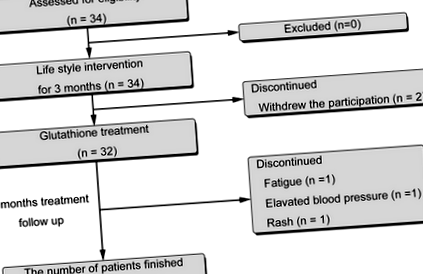
Схемата на изследването е показана на фиг. 1. От 34 записани пациенти, двама са се оттеглили преди началото на лечението. Останалите 32 са лекувани с L-глутатион (300 mg/ден; KOHJIN Life Sciences, Токио, Япония, US FDA GRAS # GRN000293) в продължение на 4 месеца чрез перорално приложение. Двадесет и девет пациенти (14 мъже, 15 жени, средна възраст 56.0 ± 13.3 години) са завършили протокола от проучването. Трима пациенти отпаднаха, по един поради умора, повишено кръвно налягане и обрив.
Проучете диаграмата, показваща разпределението на пациента
Клиничните и лабораторни характеристики на участниците в изследването са показани в Таблица 1. Двадесет и четири пациенти (82,8%) са имали дислипидемия и 12 (41,4%) са приемали статини. Четиринадесет пациенти (48,3%) са имали диабет.
След 4 месеца лечение с глутатион, нивата на ALT намаляват значително. Лечението с глутатион намалява концентрациите на триглицериди, NEFA и феритин. Нивата на HbA1c се повишават след лечение с глутатион. Неочаквано глутатионът във фракцията на плазмените протеини намаля значително след лечение с глутатион. Няма значителна разлика в нивата на глутатион в депротеинизираната фракция. Въпреки че лечението с глутатион не повлиява значително стойностите на CAP и LSM, и двете имат тенденция да намаляват.
Лечението с глутатион подобрява стойностите на CAP при отговорилите на ALT
Средното намаление на нивото на ALT спрямо изходното ниво е 12,9%. 29-те пациенти бяха разделени на отговорили на ALT (н = 15), дефинирани като тези с намаление на ALT ≥12,9% и неотговорили ALT (н = 14), дефинирани като тези с намаляване на ALT 2 спрямо 26,6 ± 3,8 kg/m 2, стр = 0,47). Въпреки че процентите на ALT отговорилите и неотговорилите с дислипидемия не се различават (80,0% срещу 85,7%, стр = 0,68), нивата на HDL холестерол и LDL холестерол са по-високи при респондентите на ALT. Честотата на употребата на статини обикновено е по-ниска при респондентите с ALT, отколкото при неотговорилите (26,7% срещу 57,1%, стр = 0,10). Нивата на диабет също са склонни да бъдат по-ниски (33,3% срещу 64,3%, стр = 0,10) и нивата на HbA1c са значително по-ниски при респондентите с ALT в сравнение с неотговорилите. Няма значителни разлики в нивата на глутатион в плазмените протеини и депротеинизирани фракции между респондентите на ALT и неотговорилите преди лечение с глутатион.
Характеристиките на ALT реагиращите и неотговарящите преди и след лечението с глутатион са показани в Таблица 3. Лечението с глутатион намалява нивата на ALT при отговорилите на ALT (фиг. 2а), но повишава нивата на AST и ALT при неотговорилите на ALT (фиг. 2b). При отговорилите на ALT лечението с глутатион намалява нивата на NEFA, феритин и HDL холестерол, но повишава нивата на HbA1c. При неотговорилите на ALT лечението с глутатион намалява нивата на триглицеридите, но увеличава нивата на FBS. Лечението с глутатион значително намалява глутатиона в плазмената фракция на протеинови протеини при отговорилите на ALT; няма промяна в неотговорилите ALT. Изненадващо, стойностите на CAP бяха значително намалени при отговорилите на ALT; не е имало разлики в неотговорилите ALT.
Нива на аланин аминотрансфераза (ALT) преди и след лечение с глутатион през а Респонденти на ALT и б Неотговарящи на ALT
Дискусия
Съобщава се, че нивото на свързаната с протеините форма на глутатион се увеличава 1-2 часа след поглъщане на глутатион, което предполага, че орално приложеният глутатион се абсорбира в кръвта [12]. Този свързан с протеини глутатион може да се отложи в черния дроб, като отслабва хепатита.
Съобщава се, че нивата на свързан с протеините глутатион се връщат към изходните нива след бързо нощуване [12]. В настоящото проучване установихме, че изходното ниво на свързаната с протеините форма на глутатион значително намалява след едно нощно гладуване след 4-месечно приложение на глутатион, особено при отговорилите на ALT. Нивата на свързан с протеините глутатион при пациенти в настоящото проучване са значително по-високи от тези на здрави доброволци в предишни проучвания [12], изчислени по същия метод. Лечението с глутатион също намалява свързания с протеини глутатион до нормалните изходни нива. Тези открития показват, че пероралното приложение на глутатион може да увеличи включването на свързан с протеините глутатион в черния дроб или да намали патологичната екскреция на глутатион от черния дроб.
NAFLD е сложно заболяване. Смята се, че неговата патогенеза включва различни фактори, включително инсулинова резистентност, липотоксичност, сигнали, получени от червата/хранителни вещества, адипоцитокини, оксидативен стрес и генетични фактори. Дислипидемия се съобщава при 20–80% от пациентите с NAFLD [20]. Нашето предишно проучване разкри, че орално прилаганият глутатион ускорява усвояването на мастните киселини чрез повишаване на нивата на активирания от протеина пероксизомен пролифератор рецептор-γ коактиватор-1α и митохондриална ДНК с намалени плазмени нива на NEFA [21]. Настоящото проучване разкри също така, че 24 (82,8%) от нашите пациенти са имали дислипидемия, а лечението с глутатион е намалило значително нивата на триглицеридите и NEFA.
Увеличенията на запасите от феритин и желязо в организма се откриват често при пациенти с НАЖБП [22, 23]. Феритинът и желязото могат да насърчат развитието на NAFLD чрез оксидативен стрес [24]. Резултатите от проучването PIVENS показаха, че пероралното приложение на антиоксидант витамин Е подобрява чернодробната дисфункция и патологичните състояния на NASH [17]. Въпреки това, дългосрочното лечение с витамин Е е свързано с увеличаване на смъртността от всички причини и риска от рак на простатата [25,26,27], което предполага необходимостта от оценка на ефикасността и безопасността на този агент. В настоящото проучване лечението с глутатион значително намалява нивата на феритин, но механизмът, който стои зад намаляването, остава неясен. Смята се, че глутатионът подобрява хиперферитинемията и оксидативния стрес и има терапевтични ефекти при пациенти с NAFLD.
Чернодробните мазнини се оценяват неинвазивно, като се използва VCTE с CAP. Мета-анализ установи, че ОСП има добра чувствителност и специфичност за откриване на чернодробни мазнини [28]. Стойностите на CAP в нашето проучване са склонни да намаляват при всички пациенти и значително да намаляват при отговорилите на ALT след 4 месеца лечение с глутатион. Въпреки че връзката между хистологичното подобрение на чернодробната стеатоза и намаляването на стойностите на ОСП все още не е определена, глутатионът може да намали чернодробната стеатоза.
Ние също така изследвахме факторите на пациента, свързани с терапевтичните ефекти на глутатиона. Установихме, че нивата на HDL холестерол и LDL холестерол са по-високи, а нивата на HbA1c по-ниски при респондентите с ALT, отколкото при неотговарящите. Въпреки че процентът на пациентите, използващи статини, не се различава значително между двете групи, процентът обикновено е по-нисък при респондентите с ALT, отколкото при неотговорилите на ALT. Въпреки че това не може да бъде нищо повече от спекулации поради малкия размер на пробата, пациентите, които са показали терапевтични ефекти след лечение с глутатион, изглеждат по-млади и нямат диабет или имат лек диабет.
Трима пациенти се оттеглиха от проучването поради умора, повишено кръвно налягане и обрив. При отговорилите на ALT нивата на HbA1c се повишават и нивата на HDL холестерол намаляват след лечение с глутатион. Изследване на 6522 пациенти установява, че 24 (0,4%) са имали нежелани реакции, като най-честите са анорексия, гадене, повръщане и обрив [29]. Въпреки че приложението на глутатион може да е било свързано с обрив при един пациент в настоящото проучване, причинно-следствените връзки между глутатиона и други нежелани ефекти са неясни.
Това проучване имаше някои ограничения. Първо, нашето проучване беше проучване с една ръка без контролна група. Второ, проучването е ограничено от малкия размер на извадката и краткия период на лечение (4 месеца). Трето, тъй като патологичните състояния на пациентите не бяха оценени чрез чернодробна биопсия, включването на орално приложен глутатион в черния дроб не беше потвърдено. Четвърто, редица пациенти се оттеглиха от проучването, но не може да се определи причинно-следствена връзка.
Заключения
Лечението с глутатион значително подобрява нивата на ALT. В допълнение, стойностите на CAP бяха значително намалени при респондентите на ALT. Нашето пилотно проучване предполага, че пероралното приложение на глутатион поддържа чернодробния метаболизъм и подобрява NAFLD. За да се изясни механизмът на благоприятните ефекти на глутатиона, са необходими допълнителни проучвания, които изследват включването на орално администриран глутатион в черния дроб и ефектите върху редокс системата на гостоприемника, използвайки стабилен изотоп-белязан глутатион и животински модели. Необходими са мащабни клинични проучвания, за да се потвърдят терапевтичните ефекти на глутатиона.
- Диетичен състав и безалкохолна мастна чернодробна болест SpringerLink
- Хронична бъбречна болест и неалкохолна мастна чернодробна болест - има ли връзка
- Първото национално проучване предсказва ескалираща епидемия от безалкохолна мастна чернодробна болест (NAFLD)
- Профили на микробиота в изпражненията и кръвта и наличие на безалкохолна мастна чернодробна болест при затлъстяване
- Диетичното ленено масло предотвратява диета, предизвикана от западен тип, безалкохолна мастна чернодробна болест в