Резюме
Заден план
Затлъстяването е здравословен проблем в много страни и поддържането на идеално тегло е предизвикателство. Moringa oleifera екстракт от листа (ME) е богат на полифеноли с антиоксидантен и фармацевтичен потенциал. Настоящото проучване изследва потенциалния защитен ефект на Moringa oleifera екстракт от листа срещу затлъстяване, предизвикано от диета с високо съдържание на мазнини (HFD), оксидативен стрес и нарушаване на метаболитните хормони в сравнение със симвастатин (SIM) или тяхната комбинация.
Резултати
Заключение
Предлагаме екстрактът от ME да има затлъстяване и антиоксидантен потенциал и може да се използва като понижаващо липидите лекарство за контрол на теглото, затлъстяването и неговите патофизиологични последици.
Въведение
Допълнителната и алтернативна медицина се използва в цял свят за лечение на различни заболявания и разстройства, които включват оксидативен стрес. Растителните полифеноли са ефективни антиоксиданти, които се използват за контрол на оксидативния стрес при различни заболявания. Растителните полифеноли почистват свободните радикали, хелатните преходни метали, като желязо и мед, и защитават ендогенните антиоксидантни системи [1]. Тези полифеноли се намират във всички растителни части и представляват важна част от човешката диета. Основният източник на естествени полифеноли са лечебните растения, които се различават значително по функционална група и биологична активност при управлението на човешките заболявания [2].
Много растителни екстракти и техните пречистени съединения контролират кръвната захар и обратните физиологични аномалии [3]. От решаващо значение е агентите, които намаляват оксидативния стрес, да бъдат терапевтично полезни. Следователно, анти-затлъстяването и антиоксидантните свойства на растителните полифеноли са свързани. Маркерите за оксидативен стрес се увеличават при затлъстели лица. Увеличението на производството на реактивни кислородни видове (ROS) в мастната тъкан е свързано с повишаване на регулирането на NADPH оксидазата и понижаване на регулирането на антиоксидантните ензими [4]. Плъховете, хранени с диета с високо съдържание на мазнини (HFD), натрупват телесно тегло с повишен оксидативен стрес в черния дроб [5] и мускулите [6]. Последният автор съобщава за увеличаване на производството на водороден пероксид и намаляване на супероксиддисмутазата в мускулите. HFD също води до тежки промени в митохондриалните липиди и свръхпродукция на реактивни кислородни видове (ROS) в черния дроб [7].
Консумацията на диета с високо съдържание на мазнини е свързана с метаболитни синдроми, особено диабет [8] и затлъстяване [9, 10]. Тези нарушения увеличават риска от развитие на инсулинова резистентност и хипертония [11]. Инсулиновата резистентност се отнася до недостатъчен отговор на нормалните нива на инсулин в периферната прицелна тъкан, включително черния дроб, мускулите и мастната тъкан. Въпреки напредъка на новите лекарства, диабетът и затлъстяването остават водещата причина за заболеваемост и смъртност, с нарастващи социални и здравни смущения в световен мащаб [8]. Следователно естествените и безопасни агенти, които намаляват затлъстяването, а не хирургичната интервенция и прилагането на синтетични наркотици, са важен въпрос в модернизираните и развиващите се страни.
Инсулинът, лептинът и герлинът са трите метаболитни хормона, отговорни за управлението на нивото на глюкозата в кръвта, регулирането на запасите от телесни мазнини, разхода на енергия и наддаването на телесно тегло [12]. Видът и количеството на приеманата храна оказват значително влияние върху нивата и баланса между тези хормони. Нарушаването на тези хормони значително влияе върху развитието на метаболитен синдром при пациенти със затлъстяване [13].
Moringa oleifera Lam е малко по размер дърво, което принадлежи към семейство Moringaceae и се отглежда в Африка и Азия. Листата на M oleifera проявяват фармацевтична активност поради своите фитоконституенти и естествени антиоксидантни молекули, включително витамини и каротеноиди [14, 15]. Полезните фармакологични действия на M oleifera включват противовъзпалителни, заздравяващи рани, диуретични [16], противогъбични [17] и антиоксидантни [18] дейности.
Симвастатин се предлага на пазара като Zocor и принадлежи към фармацевтичната група на статините, които се използват за понижаване на холестерола в кръвта при различни състояния [19]. Симвастатин показва значителни защитни ефекти върху ендотелните клетки и антикоагулацията [20]. За съжаление симвастатин също има многобройни нежелани странични ефекти, като стомашно-чревни разстройства, главоболие и обрив [21] и някои от тези ефекти представляват реална заплаха за живота и здравето на пациентите [22].
Все по-голям брой проучвания съобщават за хипогликемичните и антиоксидантните ефекти на Moringa oleifera [14, 15, 18]. Настоящото проучване изследва потенциалния защитен ефект на Moringa oleifera екстракт от листа срещу индуцирано от HFD затлъстяване, оксидативен стрес и нарушаване на метаболитните хормони при плъхове, хранени с HFD, в сравнение с понижаващото холестерола лекарство симвастатин и тяхната комбинация.
Материали и методи
Химикали
Симвастатин е получен от Global Napi Pharmaceuticals, Египет. Холестеролът е закупен от химическата компания Sigma (Сейнт Луис, Мисури, САЩ). Всички други химикали са с аналитичен клас.
Изготвяне на Moringa oleifera екстракт от листа
Листа от Moringa oleifera са получени от местен пазар в Мансура и са удостоверени в катедрата по ботаника на Университета Мансура в Египет. Листата бяха почистени, изсушени и смлени. Смлените листа (40 g) се мацерират в етилов алкохол (70%) при непрекъснато разбъркване в продължение на 3 дни при 4 ° С. Екстрактът се филтрува и лиофилизира, за да се получи твърд прах, който се съхранява при 4 ° С. Добивът на екстракта е 17,5%. Дозата, използвана в настоящия експеримент, е 300 mg/kg и се приготвя в дестилирана вода за перорално приложение [23].
Животни
Възрастни мъжки плъхове Wistar, 200–230 g, са получени от Холдинговата компания за биологични продукти и ваксини (VACSERA, Кайро, Египет). Животните бяха поставени в клетки от неръждаема стомана при нормални лабораторни условия и изложени на 12-часови цикли светлина/тъмнина. Всички плъхове се аклиматизират за една седмица преди експериментиране. Експерименталният протокол е извършен в съответствие с насоките на Националния здравен институт за грижи и използване на лабораторни животни (NIH Publication No. 8523, ревизиран през 1996 г.) и в съответствие с местния експериментален комитет по етика на животните от Университета Мансура, Египет.
Групи животни
Животните бяха разделени на шест групи от шест плъха. Плъховете от контролната група са получавали обикновена диета и вода ad libitum. В група 2, Моринга група, третирана с екстракт от листа (ME), получава ежедневно перорално приложение от 300 mg/kg [23] телесно тегло в продължение на шест седмици. Плъховете от 3-та група получават HFD ежедневно в продължение на шест седмици. Плъховете от 4-та група са били хранени с HFD и едновременно получавали перорален ME екстракт всеки ден в продължение на шест седмици. Петата група получава HFD и симвастатин (SIM) 40 mg/kg дневно в продължение на шест седмици. SIM се администрира чрез gavage. Плъховете от 6-та група получават HFD и ME и SIM при същите дози и начин на приложение като другите групи. HFD е смес от 68% стандартна чау диета, 30% животински мазнини и 2% холестерол [24].
Теглото на тялото се записва през първия ден от експеримента, след това седмично за последователни шест седмици, като се използва цифров вез.
Плъховете се гладуват през нощта след шест седмици и се обезболяват, като се използват смес от кетамин и ксилазин. Кръвни проби се събират чрез сърдечна пункция. Серумни проби се получават след центрофугиране при 5000 х g в продължение на 10 минути при 4 ° С. Анестезираните плъхове се евтаназират и дисектират, за да се получат чернодробни проби, които се почистват и хомогенизират в охладен буфер Tris-HCl (0,1 М) рН 7,4 в мелнички за тъкани Potter-Elvehjem за биохимични анализи.
Биохимични анализи
Нивата на серумна глюкоза и липидни фракции (триглицериди (TG), общ холестерол (TC) и липопротеин с висока плътност (HDL холестерол)) бяха изследвани с помощта на колориметричен комплект за анализ от Biodiagnostic Co, Египет. Стойността на LDL е изчислена с помощта на екв. LDL = холестерол - триглицериди/5 -HDL.
Нивата на серумен инсулин, лептин, херлин, T3 и T4 бяха изчислени с помощта на комплекти ELISA за плъхове (Siemens healthcare diagnostics, Cambridge, MA, USA). Оценката на модела на хомеостазата за инсулинова резистентност (HOMA-IR), количествен индекс за проверка на инсулиновата чувствителност (QUICKI) и атерогенен индекс бяха оценени, както е описано по-рано [25].
Дейностите на аспартат амино трансфераза, аланин амино трансфераза, алкална фосфатаза и гама глутамилтрансфераза в серуми бяха измерени с помощта на комплект от Elitech Group, Puteaux, Франция.
Малондиалдехидът (MDA) беше измерен, използвайки реакцията на MDA с тиобарбитурова киселина, за да се получат реактивни вещества с тиобарбитурова киселина (TBARS), следвайки инструкциите на производителя (Biodiagnositic Kit, Египет). Нивото на протеиновия карбонил се изчислява в съответствие с инструкциите на набор от колориметрични анализи от Cayman Chemical, САЩ. Азотният оксид е изчислен с помощта на Biodiagnositic Kit, Египет. Общият антиоксидантен капацитет, нивото на глутатион (GSH) и супероксиддисмутазата (SOD), каталазата (CAT) глутатион пероксидаза (GPx) и глутатион редуктазата (GR) бяха определени, както е описано в Biodiagnositic Kit, Египет.
статистически анализи
Данните бяха анализирани с помощта на GraphPad Prism 5.0 (GraphPad Software Inc., Сан Диего, Калифорния, САЩ) и резултатите са изразени като средните стойности ± SD (н = 6). Статистическите сравнения бяха извършени с помощта на еднопосочен ANOVA, последван от post-hoc тест на Student's Newman – Keuls. Отчетена е значителна разлика при P
Резултати
Плъховете с HFD показват значително увеличение на телесното тегло в сравнение с нормалните диетични животни (Таблица 1). Две седмици от Моринга лечението с екстракт от листа (ME) значително намалява процента на повишаване на телесното тегло в сравнение с HFD плъхове. Последващото наддаване на телесно тегло на 3-та, 4-та, 5-та и 6-та седмица е по-ниско от HFD групата. Плъхове, хранени със симвастатин (SIM) или ME плюс SIM, показват по-ниско наддаване на телесно тегло, отколкото плъхове, хранени с HFD.
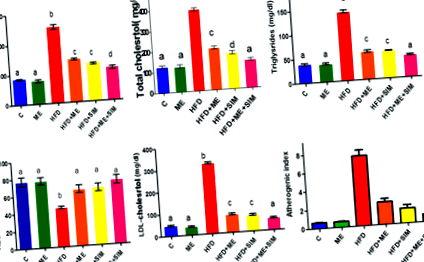
Изследвани са ефектите на ME и SIM върху липидите при HFD плъхове (Фиг. 1). Животните, хранени с HFD в продължение на шест последователни седмици, показват значително увеличение на общите липиди, холестерол, триглицериди и LDL, намален HDL (фиг. 1) и повишен атерогенен индекс (фиг. 1) в сравнение с контролните плъхове, хранени с нормална диета. Лечението с ME, SIM или и двете агенти значително предотвратява дислипидемията и намалява атерогенния индекс при плъхове с HFD. Подобни резултати бяха получени при използване на стандартното лекарство SIM и SIM плюс ME върху липидите и атерогенния индекс.
Плъховете, хранени с HFD, показват значително увеличение на серумните нива на глюкоза и лептин и намалени нива на инсулин и херлин (фиг. 2). Също така се наблюдава значително увеличение на HOMA-IR и значително намаляване на QUICKI в сравнение с контролните животни (фиг. 2). Едновременната добавка с ME предотвратява хипергликемията и подобрява промените в нивата на инсулин, херлин и лептин. Подобни ефекти се наблюдават след лечение със SIM и комбинацията от SIM и ME. Лечението на HFD плъхове с комбинацията от ME и SIM в продължение на 6 седмици доведе до превъзходни благоприятни ефекти върху инсулина и лептина в сравнение с всеки отделен агент.
Плъхове, хранени с HFD, показват значително намаляване на кръвните нива на Т3 и Т4 в сравнение с контролната група (фиг. 3). Лечението с ME, SIM и тяхната комбинация значително подобри тези промени и показа сравними стойности с контролната група.
Фигура 4 показва, че плъхове, хранени с HFD в продължение на 6 седмици, показват значително повишаване на чернодробните ензими, включително ALT, AST, AP и GGT, в сравнение с контролната група. Лечението с ME едновременно с HFD значително подобрява повишаването на чернодробните ензими. Подобни резултати бяха получени при използване на стандартното лекарство SIM и комбинацията от SIM и ME.
Плъховете с HFD показват значително увеличение на липидната пероксидация, окисление на протеини и азотен оксид (фиг. 5) и намалени нива на GSH и GR, GPx, SOD и CAT активности в черния дроб (фиг. 6). Лечението с ME, SIM или тяхната комбинация доведе до значително предотвратяване на тези промени в параметрите на оксидативен стрес и антиоксиданти в черния дроб. Комбинацията от SIM и ME оказа по-добро въздействие от всяко лекарство самостоятелно (фиг. 5).
Дискусия
Настоящото проучване разкрива, че HFD повишава нивата на серумна глюкоза, инсулин и лептин и повишава HOMA-IR, които са значително подобрени от едновременното добавяне на ME, SIM и тяхната комбинация в сравнение с контролните плъхове. ME показа подобни ефекти на SIM и тяхната комбинация. ME подобрява инсулиновата резистентност на тъканите, нивата на глюкозата и намалява наддаването на телесно тегло при плъхове, хранени с HFD, което подкрепя предишни проучвания, използващи богати на полифенол растителни екстракти [28, 29]. Инсулинът и глюкозата регулират нивата на лептин. Предишни проучвания показват положителна корелация между регулирането на лептина и телесните мазнини чрез инсулин [30] и метаболизма на глюкозата [31]. Повишеният лептин отразява инсулиновата резистентност [32] и показва значителна корелация с HOMA-IR [13].
Настоящото проучване демонстрира, че секрецията на герлин е значително намалена при плъхове, хранени с HFD. Механизмът на намалена секреция на герлин не е ясен. Има четири предложени фактора, които да обяснят потискането на нивата на герлин, включително хиперинсулинемия [33], хипергликемия [34], хиперлептинемия [35] и повишено телесно тегло [36]. Настоящото проучване подкрепя тези възможности въз основа на повишени нива на инсулин, лептин и глюкоза и повишено телесно тегло при плъхове, хранени с HFD. Потискането на секрецията на герлин от стомаха на плъховете е свързано с по-високото освобождаване на стомашен соматостатин [37]. Тези резултати показват, че няколко хормонални сигнала контролират секрецията на герлин от стомаха. Лечението с ME, SIM и тяхната комбинация подобриха нивата на герлин, а комбинираното лечение беше по-добро при повишаване на нивата на герлин при плъхове, хранени с HFD.
Настоящото проучване демонстрира ниски нива на Т3 и Т4 при плъхове, хранени с HFD, което показва хипотироксинемия. Това откритие подкрепя неотдавнашен доклад, че повишеният прием на HFD и повишените серумни липидни фракции причиняват нарушения в липидния профил на щитовидната жлеза и хипотироксинемия и повишени нива на TSH в отговор на намалените хормони на щитовидната жлеза [38], което беше подобрено чрез диетична модификация [39]. Поддържането на хомеостазата на щитовидната жлеза е от съществено значение за човешкото здраве. Едновременният прием на ME коригира нарушението в хормоните на щитовидната жлеза, вероятно през оста хипоталамус-хипофиза-щитовидна жлеза [40].
Лечението с ME нормализира няколко антиоксиданта в черния дроб на плъхове, хранени с HFD. Супероксиддисмутазата (SOD) и каталазата (CAT) са два антиоксидантни ензима, които са отговорни за димутацията на супероксидните аниони във водороден прекис, вода и кислород. SOD елиминира супероксидните радикали в черния дроб и намалява нивата на кръвната глюкоза [47]. Едновременното лечение с ME води до по-високи активности на SOD и CAT в черния дроб на плъхове, хранени с HFD, което показва способността на ME да почиства ROS или да защитава системата SOD/CAT, която елиминира супероксидните радикали. Важен фактор за определяне на промените в редокс баланса в организма е общият антиоксидантен капацитет (TAC), който изразява основната способност за почистване [48]. Настоящото проучване демонстрира, че ME повишава TAC в черния дроб на плъхове, хранени с HFD, което показва антиоксидативната способност на ME.
Защитата, наблюдавана след лечение с ME на плъхове, хранени с HFD, предполага профилактично въздействие на ME срещу индуцирано от HFD метаболитно нарушение чрез нормализиране на ROS. ME регулиран глутатион (GSH) в черния дроб на плъхове, хранени с HFD, в сравнение с контролните плъхове в настоящото проучване. GSH е важен за елиминирането на свободните радикали и действа като субстрат за глутатион пероксидазата (GPx) за неутрализиране на водородния пероксид и органичните хидропероксиди в липидните клетъчни мембрани срещу окислително увреждане [49]. Нарастващата активност на GPx забележително намалява оксидативния стрес в черния дроб [50]. Антиоксидативният ефект на ME върху окисляването на липидите и протеините може да бъде свързан с фенолните съединения на този растителен екстракт. За отбелязване е, че съотношението между редуциран и окислен глутатион (GSH/GSSG) играе ключова роля в хомеостазата на глюкозата при затлъстяване, тъй като сулфхидрилните групи са от решаващо значение в редокс състоянието на хепатоцитите [51]. ME може да има регулирано съдържание на GSH чрез подобряване на активността на глутатион редуктаза (GR), което намалява GSSG до GSH и подобрява съотношението GSH/GSSG. Следователно тези промени намаляват окисляването на липидите и протеините и подобряват глюкозата и нейния метаболизъм.
HFD нарушава стабилността и синтеза на азотен оксид (NO) и предизвиква инсулинова резистентност [52]. NO се произвежда екстензивно от ендотелни клетки, Kupffer клетки и хепатоцити в отговор на възпаление [53]. Прекомерното производство на NO е цитотоксично поради производството на хидроксилни радикали и може да предизвика оксидативен стрес [54]. Настоящото проучване демонстрира високи нива на NO при плъхове, хранени с HFD. Това повишение е значително подобрено след лечение с ME, SIM и тяхната комбинация. Ниското производство на NO подобрява метаболизма на глюкозата чрез регулиране на усвояването на глюкоза от скелетните мускули чрез Glut транспортера и увеличава и активира митохондриалната биогенеза [55]. Този ефект може да бъде потенциалният защитен механизъм за МЕ в черния дроб на затлъстелите субекти.
Черният дроб е многофункционален орган, който отговаря за метаболизма в цялото тяло и е подложен на повишено производство на ROS и увреждане от оксидативен стрес [53]. Тази роля изостря индуцирането на метаболитен синдром и увреждане на черния дроб. Потискането на оксидативния стрес и регулирането на системните антиоксиданти от ME може да играе важна роля в защитата на черния дроб по време на консумация на HFD. ME защити черния дроб на мишки, хранени с HFD, което беше показано чрез нормализиране на чернодробните функционални ензими, включително ALT, AST, AP и GGT.
В заключение, Моринга екстракт от листа контролира наддаването на телесно тегло, когато се дава едновременно с HFD, което показва по-ниско състояние на затлъстяване. Този ефект е придружен от подобрения в серумните липидни фракции, глюкозата, метаболитните хормони и по-ниския оксидативен стрес и чернодробната функция. Основният механизъм за мелиоративните промени, свързани със затлъстяването, може да се отдаде на антиоксидантните ефекти на полифенолите в ME. Подобряването на пътищата за редокс баланс е добра терапевтична стратегия в случаите на затлъстяване и свързаните с него неблагоприятни последици.
Наличност на данни и материали
Наборите от данни, използвани и/или анализирани по време на настоящото проучване, са достъпни от съответния автор при разумна заявка.
- Свързана със затлъстяването метаболитна ендотоксемия е свързана с оксидативен стрес и нарушена сперматозоидна ДНК
- Оксидативен стрес и сърдечно-съдов риск Затлъстяване, диабет, пушене и замърсяване Част 3 на
- Защитен ефект на екстракт от ацетон Curcuma amada срещу диета с високо съдържание на мазнини и захар
- Защитете се срещу затлъстяване Екстракт от мангостин Матакана Суперхрани
- Родителският стрес е напречен анализ на асоциациите с детското затлъстяване, физическо