Анкан Банерджи
1 Молекулярна биология на Архея, Институт за земна микробиология Макс Планк, Karl-von-Frisch-Strasse 10, 35043 Марбург, Германия
Чи-Лин Цай
2 Отдел за науките за живота, Национална лаборатория Лорънс Бъркли, 1 Cyclotron Road, Бъркли, Калифорния 94720, САЩ
Паушали Чаудхури
1 Молекулярна биология на Архея, Институт за земна микробиология Макс Планк, Karl-von-Frisch-Strasse 10, 35043 Марбург, Германия
4 Молекулярна биология на Архея, Институт по биология, Университет във Фрайбург, Schaenzlestrasse 1, 79211 Фрайбург, Германия
Патрик Трип
1 Молекулярна биология на Архея, Институт за земна микробиология Макс Планк, Karl-von-Frisch-Strasse 10, 35043 Марбург, Германия
4 Молекулярна биология на Архея, Институт по биология, Университет във Фрайбург, Schaenzlestrasse 1, 79211 Фрайбург, Германия
Андрю С. Арвай
3 Катедра по молекулярна и клетъчна онкология, Университет на Тексас, MD Anderson Cancer Center, Holcombe Boulevard 1515, Хюстън, Тексас 77030, САЩ
Джъстин П. Ишида
2 Отдел за науките за живота, Национална лаборатория Лорънс Бъркли, 1 Cyclotron Road, Бъркли, Калифорния 94720, САЩ
Джон А. Тайнер
2 Отдел за науките за живота, Национална лаборатория Лорънс Бъркли, 1 Cyclotron Road, Бъркли, Калифорния 94720, САЩ
3 Катедра по молекулярна и клетъчна онкология, Университет на Тексас, MD Anderson Cancer Center, Holcombe Boulevard 1515, Хюстън, Тексас 77030, САЩ
Соня-Верена Алберс
1 Молекулярна биология на Архея, Институт за земна микробиология Макс Планк, Karl-von-Frisch-Strasse 10, 35043 Марбург, Германия
4 Молекулярна биология на Архея, Институт по биология, Университет във Фрайбург, Schaenzlestrasse 1, 79211 Фрайбург, Германия
Свързани данни
Обобщение
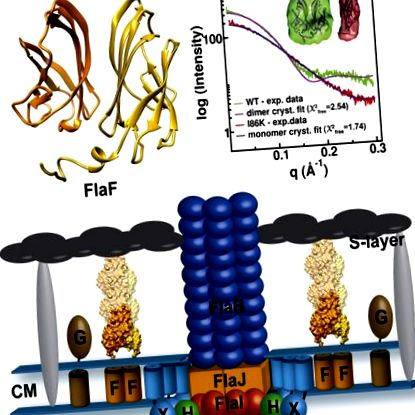
Archaea използва архаелум, тип IV pilus-подобна наномашина, за подвижност на плуването. В кренархеона Sulfolobus acidocaldarius архаелът се състои от седем протеина: FlaB/X/G/F/H/I/J. FlaF е запазен и е от съществено значение за сглобяването на архаел, но не съществуват структури от FlaF. Тук ние съкратихме края на FlaF N и решихме кристални структури с разделителна способност 1,5-A и 1,65-A на този монотопен мембранен протеин. Структурите разкриха N-терминална α-спирала и осем-верижен β-сандвич, имуноглобулиноподобна гънка с поразително сходство с протеини от S-слой. Кристалните структури, разсейването на рентгенови лъчи и мутационните анализи предполагат, че е необходимо димерно сглобяване за in vivo функция. Единственият компонент на обвивката на клетъчната обвивка на S. acidocaldarius е паракристален S-слой и FlaF е специфично свързан с S-слой протеин, което предполага, че неговият домен на взаимодействие се намира в псевдопериплазмата с нейната N-крайна спирала в мембраната. От тези данни FlaF може да действа като неизвестен досега стационарен протеин на архелум, който закрепва въртящия се архелум към обвивката на археалната клетка.
Графичен резюме
Въведение
Докато бактериите използват бичурите за подвижност на плуването, археите използват архаели (бивши археални бичури) за придвижване в течна среда или по повърхности. Архаелите се намират във всички подвижни археални видове и наскоро бяха идентифицирани и в новия археален тип Thaumarchaeota (Jarrell and Albers, 2012; Spang et al., 2012). Въпреки че архаелите функционално наподобяват бактериални биччета, те се сглобяват чрез механизъм, напомнящ на тип IV пили (Craig et al., 2004). Археите и бактериите притежават много структури от тип IV пили, които изпълняват много разнообразни функции при адхезия към повърхностите, поемане на ДНК, както и вирулентност и потрепваща подвижност при бактериите (Burrows, 2012; Hamilton and Dillard, 2006; Henche et al., 2012). Важно е, че архаелът е първата структура, подобна на пилус от тип IV, която придава подвижност чрез въртеливо движение на нишката и не е известно как това въртене се постига от неговия двигателен комплекс или как въртящият се компонент може да бъде прикрепен към обвивката на археалната клетка ( Marwan et al., 1991; Shahapure et al., 2014).
Резултати
FlaF, дълъг изпъкнал N-терминал α-спирала и β-лист кълбови домейн протеин
Вторична структура предсказване и сравнение с кристалната структура на sFlaF
Пълноразмерната вторична структура на FlaF е предсказана от сървъра Phyre 2. N-терминалните остатъци 3–42 бяха предвидени да присъстват като дълга спирална област. Действителната вторична структура, получена от кристалната структура на sFlaF верига B (PDB, 4P94), е показана за сравнение под прогнозата. Последователността беше цветно кодирана от циан (най-променлива) до тъмно лилава (най-запазена) като консервация, показана на фигура 6 А.
Определяне на кристалната структура
Нативните кристални структури на рекомбинантен sFlaF (естествен 1, остатъци 46–164; PDB, 4ZBH; и естествен 2, остатъци 49–164 във верига А и 35–164 във верига В; PDB, 4P94) бяха определени при 1,50 Å и Резолюция 1,65 Å, съответно. Нативната 1 sFlaF структура е фазирана с платиново производно чрез единично изоморфно заместване с аномално разсейване (SIRAS) (Таблица 1). Структурата на естествения 2 sFlaF е фазирана чрез молекулярно заместване с естествен 1 sFlaF като модел за търсене. И двете кристални структури са от една и съща конструкция (остатъци 35–164 с N-краен His-етикет), но кристализират в различни форми. Нативният кристал sFlaF 1 (Фигура S2A) в космическа група P43212 съдържа по една молекула на асиметрична единица със съдържание на разтворител 43%; естествен кристал 2 (Фигура S2B) в космическа група I23 съдържа две молекули (верига А и В) на асиметрична единица със съдържание на разтворител 58%. Генерираната кристалографска симетрия на нативния 1 показва почти идентичната димерна структура на нативната 2 sFlaF. Средно-квадратното отклонение (rmsd) и за двете димерни кристални структури е около 0.50 Å за 207 подравнени Cα атоми. Тъй като верига В на естествената 2 sFlaF структура (PDB, 4P94) съдържа пълната последователност, тя се използва за анализи и фигури, освен ако не е посочено друго.
маса 1
Статистика за събиране и рефиниране на рентгенова дифракционна информация на sFlaF
- Химическо картографиране на РНК взаимодействията с полипиримидиновия тракт, свързващ протеин
- Химическо картографиране на РНК взаимодействията с полипиримидиновия тракт, свързващ протеин Nucleic
- Разберете дали високо протеиновите диети и косопадът са свързани коса за коса
- Златни протеинови хапки
- Пратеиновите шейкове работят мускулно наддаване и отслабване