Андрея Асунсао Соарес
1 Катедра по биохимия, Държавен университет в Маринга, Маринга 87015-900, Бразилия; Имейли: moc.liamg@7seraosadna (A.S.S.); rb.moc.lob@sirahcana (A.B.S.-N.); rb.moc.lou@thcarbeda (A.B.); rb.meu@azuosmgc (C.G.M.S.)
Анахарис Бабето де Са-Наканиши
1 Катедра по биохимия, Държавен университет в Маринга, Маринга 87015-900, Бразилия; Имейли: moc.liamg@7seraosadna (A.S.S.); rb.moc.lob@sirahcana (A.B.S.-N.); rb.moc.lou@thcarbeda (A.B.); rb.meu@azuosmgc (C.G.M.S.)
Аделар Брахт
1 Катедра по биохимия, Държавен университет в Маринга, Маринга 87015-900, Бразилия; Имейли: moc.liamg@7seraosadna (A.S.S.); rb.moc.lob@sirahcana (A.B.S.-N.); rb.moc.lou@thcarbeda (A.B.); rb.meu@azuosmgc (C.G.M.S.)
Сандра Мария Гомеш да Коста
2 Катедра по биология, Държавен университет в Маринга, Маринга 87015-900, Бразилия; Имейл: moc.liamg@15ignufardnas
Eloá Angélica Koehnlein
3 Департамент по хранене, Федерален университет на Южната граница, Реалеза 85770-000, Бразилия; Имейл: moc.liamtoh@acilegna-aole
Кристина Джати Маркиз де Соуза
1 Катедра по биохимия, Държавен университет в Маринга, Маринга 87015-900, Бразилия; Имейли: moc.liamg@7seraosadna (A.S.S.); rb.moc.lob@sirahcana (A.B.S.-N.); rb.moc.lou@thcarbeda (A.B.); rb.meu@azuosmgc (C.G.M.S.)
Розане Марина Пералта
1 Катедра по биохимия, Държавен университет в Маринга, Маринга 87015-900, Бразилия; Имейли: moc.liamg@7seraosadna (A.S.S.); rb.moc.lob@sirahcana (A.B.S.-N.); rb.moc.lou@thcarbeda (A.B.); rb.meu@azuosmgc (C.G.M.S.)
Резюме
Специфичните характеристики на растежа и развитието на гъбите в природата водят до натрупване на множество вторични метаболити като фенолни съединения, терпени и стероиди и основни компоненти на клетъчната стена като полизахариди, β-глюкани и протеини, някои от които с биологични дейности . Настоящата статия очертава и обсъжда наличната информация за защитните ефекти на екстрактите от гъби срещу увреждане на черния дроб, предизвикано от екзогенни съединения. Сред гъбите Ganoderma lucidum безспорно е най-широко изследваният вид. В този преглед обаче се набляга на проучвания с други гъби, особено на тези, които представят усилия за приписване на хепатопротективни дейности на специфични химични компоненти, обикновено присъстващи в екстрактите от гъби.
1. Въведение
Гъбите са макрогъби с отличителни базидиомати или аскомати, които могат да бъдат или хипогенни, или епигеални, достатъчно големи, за да се виждат с невъоръжено око и да се събират на ръка. Броят на различните видове гъби в земята се оценява на около 140 000. Приблизително само 10% от видовете вече са описани и около 2000 от тях са годни за консумация. По-малко от 25 вида се използват до голяма степен като храни, произвеждани в търговски мащаб. Като храна гъбите се оценяват по целия свят заради вкуса и вкуса им и се консумират както в прясна, така и в преработена форма. Те са бедни на калории и богати на протеини, фибри, въглехидрати и важни витамини като тиамин, рибофлавин, аскорбинова киселина и минерали [1,2,3,4,5]. Проучванията показват, че редовната консумация на гъби или консумацията на изолирани биоактивни съставки, присъстващи в гъбите, е от полза за здравето. Те обикновено се считат за функционални храни или хранителни продукти [6,7].
Терминът нутрицевтици обикновено се използва за описване на тези вещества или комбинация от вещества, които имат значителен потенциал като хранителни добавки и за използване при профилактика и лечение на различни човешки заболявания без проблеми - някои странични ефекти, които често придружават лечение, включващо синтетични лекарства. По-конкретно, гъбеният нутрицевтик е рафиниран/частично рафиниран екстрактив от мицела или от базидиома и аскомата, който се консумира под формата на капсула или таблетка като хранителна добавка (не като обикновена храна) с потенциални терапевтични приложения [8,9, 10].
Лечебните гъби имат дълга история на употреба в традиционните източни терапии, а гъбичните метаболити се използват все по-често за лечение на широк спектър от заболявания [11,12]. Освен това, годни за консумация гъби не трябва да се разглеждат просто като храна, тъй като е доказано, че някои от тях са богати на биоактивни съединения [13]. Гъбите съдържат много вещества и няколко от тях биха могли да имат някаква биологична активност. Дългият списък включва полизахариди, феноли, протеини (гъбични имуномодулиращи протеини - FIP, лектини, гликопротеини и негликозилирани протеини и пептиди), полизахаридно-протеинови комплекси, липидни компоненти (ергостерол) и терпеноиди, алкалоиди, малки пептиди и амино киселини, нуклеотиди и нуклеозиди. Този дълъг списък представлява голям набор от биологични свойства, които включват антиоксидант [9,14,15], противотуморен/противораков [16], антимикробен [13], имуномодулиращ [17], противовъзпалителен [18,19], антиатерогенен [20 ] и хипогликемични действия [21]. Освен това са докладвани и хепатопротективни свойства за екстракти от гъби и молекули, получени от гъби [22,23]. Последното свойство е именно основният фокус на настоящия доклад, който представя и обсъжда настоящите знания за хепатопротективните свойства на гъбите и молекулите, получени от гъби.
2. Чернодробни и биомаркери за хепатоксичност
Черният дроб е голям, сложен орган, който е добре проектиран за централната си роля в метаболизма на въглехидратите, протеините и мазнините. Това е мястото, където отпадъчните продукти от метаболизма, като амоняк, се детоксикират. Във връзка с далака той участва в унищожаването на остатъците от червените кръвни клетки и в рециклирането на техните съставки. Той е отговорен за синтеза и секрецията на жлъчка и за синтеза на липопротеини и плазмени протеини, включително фактори на съсирването. Той поддържа стабилно ниво на глюкоза в кръвта, като приема и съхранява глюкоза като гликоген (гликогенеза), разгражда я до глюкоза, когато е необходимо (гликогенолиза) и образува глюкоза от невъглехидратни източници като аминокиселини (глюконеогенеза). Черният дроб също играе важна роля в елиминирането и детоксикацията на лекарства, а увреждането на черния дроб може да бъде причинено от много ксенобиотици, като алкохол и много лекарства, недохранване, инфекции и анемия [24,25]. Увреждането на черния дроб е широко разпространено заболяване, което в повечето случаи включва оксидативен стрес и се характеризира с прогресивна еволюция от стеатоза до хроничен хепатит, фиброза, цироза и хепатоцелуларен карцином [26].
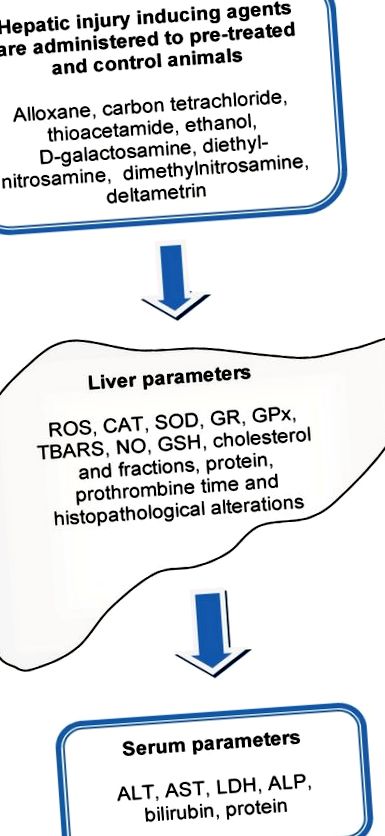
Общата схема, използвана за оценка на хепатопротективната способност на естествен екстракт или изолирана молекула, е показана на фигура 1. Хепатотоксичността се определя като увреждане на черния дроб, което е свързано с нарушена чернодробна функция, причинена от излагане на лекарство или друг неинфекциозен агент [27]. Хепатотоксичните агенти могат да реагират с основните клетъчни компоненти и следователно да предизвикат почти всички видове чернодробни лезии. Нараняването на черния дроб, било то остро или хронично, в крайна сметка води до повишаване на серумните концентрации на аминотрансферази: аспартат аминотрансфераза (AST) и аланин аминотрансфераза (ALT). AST и ALT са ензими, които катализират трансфера на α-амино групи от аспартат и аланин към α-кето групата на кетоглутаровата киселина за генериране на оксалооцетна и пировиноградна киселини, съответно, които са важни компоненти на цикъла на лимонената киселина.
Обща схема, използвана за оценка на хепатопротективните ефекти на сурови или полупречистени екстракти и изолирани молекули. Животните се третират за определен период с вероятно хепатозащитно средство. Лезията се индуцира чрез въвеждане на агент, предизвикващ чернодробно увреждане. Няколко биомаркери на хепатотоксичност се оценяват в черния дроб и серума на третирани и нелекувани животни. TBARS: вещества, реагиращи с тиобарбитурова киселина; ROS: реактивни кислородни видове; КАТ: каталаза, SOD: супероксиддисмутаза; GR: глутатион редуктаза; GPx: глутатион пероксидаза; NO: азотен оксид; GSH: глутатион; ALT: аланин аминотрансфераза; AST: аспартат аминотрансфераза; LDH: лактат дехидрогеназа; AP: алкална фосфатаза.
И двете аминотрансферази са силно концентрирани в черния дроб. AST също е дифузно представен в сърцето, скелетните мускули, бъбреците, мозъка и червените кръвни клетки. АЛАТ присъства само при ниски концентрации в скелетните мускули и бъбреците. Следователно повишаването на серумните нива на ALT е по-специфичен показател за увреждане на черния дроб. В черния дроб ALT се локализира единствено в клетъчната цитоплазма, докато AST е 20% цитозолна и 80% митохондриална [28]. Понастоящем предклиничните тестове включват някаква комбинация от плазмени AST, ALT, алкална фосфатаза (ALP) и лактат дехидрогеназа (LDH) в допълнение към нивата на билирубин и албумин. Хистологичните анализи на чернодробната тъкан също често се използват за оценка на хепатопротективното действие на екстракти и изолирани съединения. Сред тези анализи някои са по-специфични и/или чувствителни от други за откриване на чернодробна токсичност [29].
Участието на свободните радикали в патогенезата на чернодробното увреждане е изследвано в продължение на много години [30]. Различни експериментални проучвания установяват, че токсините и лекарствата причиняват натрупване на реактивни кислородни видове (ROS) като супероксид, хидроксилен радикал и водороден прекис в хепатоцитите. Това натрупване на ROS е основната причина за оксидативен стрес, дисбаланс между повишеното излагане на свободни радикали и антиоксидантната защита. Последните включват както антиоксиданти с малко молекулно тегло, като глутатион, така и антиоксидантни ензими. Антиоксидантните ензими са каталаза (CAT), супероксиддисмутаза (SOD), глутатион редуктаза (GR) и глутатион пероксидаза (GPx) (Фигура 1). Свободните радикали причиняват директно увреждане на критични биомолекули, включително ДНК, липиди и протеини, поради което нараняват хепатоцитите [31]. Когато ROS разграждат полиненаситените липиди, настъпва повишаване на клетъчния малондиалдехид (MDA). Производството на този алдехид, който обикновено се определя като реактивни вещества с тиобарбитурова киселина (TBARS), често се използва като биомаркер за измерване на липидната пероксидация и нивото на оксидативен стрес в организма [32].
Наличието на оксидативен стрес може да се тества по един от трите начина: (1) директно измерване на ROS; (2) измерване на степента на увреждане на биомолекулите; и (3) количествено определяне на естествените антиоксидантни молекули. Директното измерване на ROS може да изглежда предпочитаният метод, но много от реактивните видове кислород са изключително нестабилни и е трудно да се измери директно. Поради това много изследователи предпочитат да измерват щетите върху протеини, ДНК, РНК, липиди или други биомолекули. Въпреки че това е индиректен подход, много маркери на увреждане са значително стабилни и следователно осигуряват по-надежден метод за измерване на оксидативния стрес. Друг подход е да се измерват нивата на антиоксидантните ензими и други редокс молекули, които могат да компенсират ROS, генерирани в клетката. Налични са тестове за измерване на активността на специфични антиоксидантни ензими, като каталаза и супероксиддисмутаза. Освен това има анализи, които могат да тестват антиоксидантния капацитет на определени биомолекули и хранителни екстракти.
3. Основни хепатотоксични агенти, използвани при хепатопротективни изследвания
Токсините и лекарствата са сред основните етиопатогенетични агенти на острата чернодробна недостатъчност в западните страни [33]. Независимо от това, химическите токсини (включително ацетаминофен, тетрахлорид на въглерод, тиоацетамид, етанол, d -галактозамин, диетилнитрозамин и диметилнитрозамин) често се използват като моделни вещества, причиняващи експериментално увреждане на хепатоцитите както при in vivo, така и при in vitro условия [10,34,35,36, 37,38,39,40,41,42,43,44,45,46,47].
В черния дроб CCl4 се активира метаболитно от зависими от цитохром Р450 смесени оксидази в ендоплазмения ретикулум, за да образува радикал CCl3, който се комбинира с клетъчни липиди и протеини в присъствието на кислород, за да предизвика липидна пероксидация чрез абстракция на водород [48,49]. Това води до структурни промени в ендоплазмения ретикулум и други мембрани и загуби в активирането на метаболитните ензими с последващо увреждане на чернодробните функции.
Етанолът, мастноразтворим не електролит, който лесно се абсорбира, бързо се дифузира в циркулацията и се разпределя равномерно в тялото. Етанолът се метаболизира почти изключително в организма чрез ензимно катализирани окислителни процеси. Образуваният в първия етап ацеталдехид се окислява допълнително до ацетат, който след това се превръща във въглероден диоксид чрез цикъла на лимонената киселина. Етанолът или неговите метаболити могат също да причинят автоокисление на чернодробните клетки, като действа като прооксидант или чрез намаляване на нивата на антиоксиданти, което води до изразена хепатотоксичност [50]. Липидната пероксидация и свързаните с нея мембранни увреждания са ключова характеристика на алкохолното увреждане на черния дроб, причинявайки чернодробна фиброза, водеща до развитие на необратима цироза.
N-галактозамин (d -GalN) е един от най-полезните експериментални хепатотоксини за скрининг и изследване на хепатопротективни лекарства. Хепатотоксичността на d -GalN се дължи на метаболизма му в черния дроб, което причинява намаляване на няколко урацилови нуклеотида. В резултат на това той инхибира синтеза на РНК и протеини и нарушава биосинтеза на гликопротеини, което влошава клетъчните мембрани [62,63]. Последният от своя страна нарушава калциевата хомеостаза и митохондриалното дишане [64] и води до прекомерно генериране на ROS. Един от най-важните антиоксидантни ензими в хепатоцитите, SOD, се изчерпва и натрупването на ROS утежнява увреждането в хепатоцитите и митохондриите, което ще доведе до изтичане на AST и ALT [65,66].
Тиоацетамид, селективен хепатотоксин е добре известен като индуктор на чернодробна недостатъчност в рамките на кратък период от време след приложението на лекарството [67]. Той претърпява обширен метаболизъм до ацетамид и тиоацетамид S-диоксид чрез оксидазната система със смесена функция [68]. Тиоацетамидът S-диоксид е силно реактивно съединение [69,70]. Неговото свързване с тъканни макромолекули предизвиква чернодробна некроза [70].
4. Получаване на екстракти от гъби: Basidioma или Ascoma срещу Mycelia Biomass
- Хепатопротективни ефекти на Erythrina abyssinica Lam Ex Dc срещу безалкохолен мастен черен дроб
- Хипохолестеролемични и хепатопротективни ефекти на необработеното масло от авокадо при диета
- Хепатопротективни и метаболитни ефекти на диетични соеви фитоестрогени срещу хиперкалорична диета в
- Хепатопротективни и противовъзпалителни ефекти на общите флавоноиди на Qu Zhi Ke (кора от цитрусови плодове)
- Диаграма на гликемичния индекс и ефекти от храни с нисък и висок ГИ dLife