Шаран Бадигер
Цитирайте тази статия като: BJMP 2019; 12 (2): a010
Изтеглете PDF
Въведение
Хипергликемията е състояние, при което прекомерно количество глюкоза циркулира в кръвната плазма. Произходът на термина е гръцки: хипер-, което означава прекомерен; -glyc-, което означава сладко; и -аемия, което означава "на кръвта". Хипергликемията или високата кръвна глюкоза е сериозен здравословен проблем за тези с диабет. Нормалната глюкоза на гладно е 126 mg/dl 1. Няколко стойности над нормата са посочени преди поставяне на диагноза нарушена глюкоза на гладно или диабет на гладно. Два вида хипергликемия могат да се наблюдават при пациенти с диабет, те са хипергликемия на гладно, дефинирана като кръвна захар по-голяма от 126 mg/dl след гладуване в продължение на поне 8 часа и хипергликемия след хранене или след хранене, определена като кръвна захар, обикновено по-голяма от 180 mg/dl. При хора без диабет захарите след хранене или след хранене рядко надвишават 140 mg/dl, но понякога, след голямо хранене, нивото на глюкоза след хранене за 1-2 часа може да достигне 180 mg/dl.
Постоянно повишените високи нива на глюкоза след хранене могат да бъдат индикатор, че човек е изложен на висок риск от развитие на диабет тип 2. Стресната хипергликемия, наричана още стрес диабет или диабет на увреждане, е медицински термин, отнасящ се до преходно повишаване на кръвната глюкоза поради стрес от заболяване. Обикновено се решава спонтанно, но трябва да се разграничава от различните форми на захарен диабет. Често се открива, когато рутинните измервания на кръвната химия при болен пациент разкриват повишена кръвна глюкоза. Кръвната глюкоза може да бъде оценена или с помощта на глюкометър при нощно легло, или с плазмена глюкоза, както се извършва в лаборатория. Глюкозата обикновено е в диапазона от 140-300 mg/dl, но понякога може да надвишава 500 mg/dl, особено ако се усилва от лекарства или интравенозна глюкоза. Кръвната глюкоза обикновено се нормализира в рамките на часове, освен ако продължават предразполагащите лекарства и интравенозната глюкоза.
Стресовата хипергликемия е особено често при пациенти с хипертонична дехидратация и такива с повишени нива на катехоламин. Стероидният диабет е специфична и продължителна форма на стресова хипергликемия. При някои хора стресовата хипергликемия може да показва намален секреторен капацитет на инсулин или намалена чувствителност и понякога е първата следа за започването на диабет (имате предвид безвкусен диабет). Поради това понякога е подходящо да се извършват скринингови тестове за диабет след възстановяване от заболяване, при което е настъпила значителна стрес хипергликемия Таблица 1 .
Таблица 1: Етиология на хипергликемията
| Тест за толерантност към глюкоза | Нарушена глюкоза на гладно |
| Лекарства | Кортикостероиди, растежен хормон, естроген, орални контрацептиви, никотинова киселина, салицилати, НСПВС, тиазид, диуретици, фенитоин, епинефрин |
| Захарен диабет | Захарен диабет тип I, Диабетна кетоацидоза, Захарен диабет тип II, Гестационен диабет |
| Болест на панкреаса | Остър или хроничен панкреатит, панкреатектомия, карцином на панкреаса, хемохроматоза, муковисцидоза |
| Повишени контрарегулаторни хормони | Миокарден инфаркт, инсулт или друго неврологично заболяване, бъбречна недостатъчност, чернодробна недостатъчност |
| Ендокринни нарушения | Акромегалия, синдром на Кушинг, феохромоцитом, хипертиреоидизъм (щитовидна буря), глюкагоном |
| Други | Амилоидоза |
Разпространение и риск от хипергликемия
Острата хипергликемия е често срещана при пациенти с миокарден инфаркт с елевация на ST (STEMI), дори при липса на анамнеза за захарен диабет тип 2 (DM). Хипергликемия се среща при до 50% от всички пациенти със STEMI, докато преди диагностицираният DM е налице само при 20% до 25% от пациентите със STEMI 2. Преобладаването на DM 2 тип или нарушен глюкозен толеранс може да достигне до 65% в миокарда пациенти с инфаркт без предварително DM, когато се извършва орално тестване на глюкозен толеранс 3. Повишените плазмени нива на глюкоза и гликиран хемоглобин при постъпване са независими прогнози за както вътреболничния, така и дългосрочния резултат, независимо от диабетичния статус 4, 5. За всяко увеличение на нивото на глюкоза от 18 mg/dl има 4% увеличение на смъртността при недиабетни пациенти 6. Когато нивото на глюкоза при прием надвиши 200 mg/dl, смъртността е подобна при не-DM и DM пациенти с миокарден инфаркт (MI). Приемът на глюкоза е идентифициран като основен независим предиктор както за застойна сърдечна недостатъчност, така и за смъртност в STEMI 7 .
Глюкозата на гладно в деня след приемането изглежда по-добър предиктор за ранна смъртност от нивото на глюкоза при прием 8. Пациентите с повишен прием на глюкоза и повишена глюкоза на гладно на следващия ден имат 3-кратно увеличение на смъртността. По същия начин, провалът на пониженото ниво на глюкоза да падне в рамките на 24 часа след приема е свързан с излишната смъртност при пациенти със STEMI без DM 9. Наличието и степента на хипергликемия може да не корелират с размера на инфаркта, както обикновено се смята 6. Противорегулаторните хормони като катехоламин, растежен хормон, глюкагони и кортизол се освобождават пропорционално на степента на сърдечно-съдовия стрес и могат да причинят хипергликемия и повишаване на свободните мастни киселини, като и двете водят до увеличаване на чернодробната глюконеогенеза и намаляване на инсулина. медиирано периферно изхвърляне на глюкоза.
Патогенеза на хипергликемия
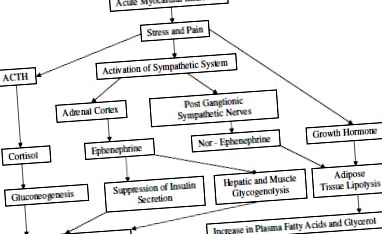
Когато острата запушване на коронарните артерии води до симптоми, помощ не винаги е така, има стимулация на постганглионарните симпатикови нервни окончания с освобождаване на норепинефрин и на надбъбречната медула с освобождаване на епинефрин. И двата катехоламини присъстват във високи концентрации в плазмата и урината през първите 24-48 часа след появата на симптомите. Концентрациите на тези катехоламини в плазмата достигат високи нива през първите няколко часа след появата на симптомите и по-късно изглежда са свързани с тежестта на инфаркта. Норадреналин действа чрез бета-адренергични рецептори, за да активира аденилциклазната система в мастната тъкан, причинявайки превръщане на аденозин трифосфат (АТФ) в цикличен аденозин монофосфат (АМР), а цикличният АМФ активира липолитична система, водеща до хидролиза на съхраняваните триглицериди до диглицериди, свободни мастни киселини (FFA), а също и глицерол. Докато настъпва известна реестерификация на FFA, нетният ефект е освобождаването на FFA и глицерол в циркулацията. При остър миокарден инфаркт плазмените концентрации на FFA са повишени в рамките на 4 часа от появата на симптомите. Най-високите стойности се откриват през първия ден, а на шестия ден обикновено се достигат нормални стойности.
Нивата на глицерол също са повишени. Съществува тясна връзка между стойностите на катехоламин в кръвта и FFA при миокарден инфаркт. Епинефринът има слаб ефект върху липолизата на мастната тъкан, но основното му действие по това време е да стимулира гликогенолизата в черния дроб и мускулите с повишаване на нивата на кръвната глюкоза. Епинефринът също така потиска активността на бета-клетките в панкреаса с намаляване на секрецията на инсулин, което води до по-нататъшно повишаване на кръвната глюкоза. По този начин хипергликемията се появява след остър миокарден инфаркт и повече от половината от тези пациенти имат абнормен тест за глюкозен толеранс през първите 72 часа от пристъпа. Намаляване на секрецията на инсулин е доказано при пациенти след остър миокарден инфаркт след интравенозно натоварване с глюкоза и интравенозен тест за толбутамид. Степента на неуспех в тези отговори е положително корелирана с тежестта на заболяването и с наличието на кардиогенен шок.
Секрецията на кортизол и плазмените хормони на растежен хормон се повишават през първите 24 часа след началото на остър миокарден инфаркт. С подобряването на клиничното състояние степента на непоносимост към глюкоза намалява и секрецията на инсулин се увеличава. През втората седмица плазмените нива на инсулин са над нормалните и на този етап анаболният ефект на инсулина при засилване на транспорта на аминокиселини в клетките и тяхното включване в протеина е важен за възстановяването на увредения миокард. Кортизолът стимулира разграждането на протеина за глюконеогенни цели, а също и ключовите глюконеогенни ензими, но е съмнително дали тези действия действат, докато остър период не премине 10, Фигура 1 .
Сърдечно-съдови ефекти на хипергликемия
Острата хипергликемия е свързана с многобройни неблагоприятни ефекти, които допринасят за лошия резултат при STEMI. Острата хипергликемия бързо потиска медиираната от потока вазодилатация, вероятно чрез повишено производство на свободни радикали, получени от кислород 11. Хипергликемията повишава свързването на вътреядрения ядрен фактор-В и активира проинфламаторни транскрипционни фактори, които увеличават експресията на матричната металопротеиназа, тъканния фактор и инхибитора на плазминогенен активатор-1. Степента на оксидативен стрес корелира най-тясно с остри, а не хронични флуктуации на глюкозата 12 .
Повишеният оксидативен стрес пречи на вазодилатацията, медиирана от азотен оксид, и намалява коронарния кръвен поток на микросъдово ниво. При пациенти със STEMI острата хипергликемия е свързана с намален поток от степен 3 по TIMI преди интервенцията в сравнение с еугликемия и е най-важният предиктор за отсъствието на коронарна перфузия 13. По същия начин пациентите с диабет са намалили степента на зачервяване на миокарда и са намалили разделителната способност на ST сегмента след успешна коронарна интервенция при STEMI, в съответствие с намалена микросъдова перфузия 14 .
Острата хипергликемия е свързана с нарушена микроциркулаторна функция, което се проявява чрез „липса на обратен поток“ на контрастна ехокардиография на миокарда след перкутанна коронарна интервенция 15. Съществуващите нива на HbA1c и диабетният статус не се различават между подгрупите със и без пренасочване, което предполага, че острата, а не хроничната хипергликемия е доминиращият фактор. И накрая, добре известните неблагоприятни ефекти на хипергликемията върху функцията на тромбоцитите, фибринолиза, коагулация и исхемична предварителна подготовка вероятно допринасят за неблагоприятните ефекти на острата хипергликемия при STEMI. Хипергликемията е отражение на относителната инсулинопения, която е свързана с повишена липолиза и генериране на свободни мастни киселини, както и намалено усвояване на глюкоза в миокарда и намаляване на гликолитичния субстрат за енергийните нужди на миокарда в STEMI. Миокардната исхемия води до повишена скорост на гликогенолиза и усвояване на глюкоза чрез транслокация на GLUT-4 рецептори към сарколемалната 16. Тъй като глюкозното окисление изисква по-малко кислород от окисляването на свободни мастни киселини на молекула произведен АТФ, енергията на миокарда е по-ефективна по време на повишената зависимост от окисляването на глюкозата с исхемия.
При относителна инсулинопения обаче, исхемичният миокард е принуден да използва свободни мастни киселини вместо глюкоза като енергиен източник, тъй като усвояването на глюкоза в миокарда е остро нарушено. По този начин може да настъпи метаболитна криза, тъй като хипоксичният миокард става по-малко енергийно ефективен в условията на хипергликемия и инсулинова резистентност. Острата хипергликемия може да предизвика осмотична диуреза. Полученото изчерпване на обема може да повлияе на откровения механизъм на скорца за неуспешната лява камера, при който увеличеният краен диастоличен обем води до увеличен ударен обем, като по този начин намалява сърдечната мощност 17, Таблица 2 .
Таблица 2: Остри сърдечно-съдови ефекти на хипергликемията
| Ендотелна дисфункция |
| Тромбоцитни хиперреактивност |
| Повишено активиране на цитокините |
| Намалена гликолиза и окисляване на глюкозата |
| Повишена липолиза и нива на свободни мастни киселини |
| Повишен оксидативен стрес (? Повишена миокардна апоптоза) |
| Нарушена микроциркулаторна функция (феномен „без пренасочване“) |
| Нарушена исхемична предварителна подготовка |
| Нарушена секреция на инсулин и усвояване на глюкоза на базата на инсулин |
Заключение
Съществена диагностична характеристика на диабета е повишената концентрация на глюкоза в кръвта и основната цел на лечението на диабета е нормализиране на кръвната глюкоза. Хипергликемия може да възникне и когато нормалният хормонален контрол на концентрацията на глюкоза в кръвта е нарушен от стреса, свързан с остър миокарден инфаркт.
Кръвната глюкоза се повишава в непосредствен период след остър миокарден инфаркт, независимо от състоянието на диабет. В тази обзорна статия се обсъжда настоящото разбиране за значението на хипергликемията, възникваща в резултат на остър миокарден инфаркт.
Значителна част от прегледа е насочена към обсъждането на епидемиологичното разпространение, което потвърждава връзката между хипергликемия и смъртност след миокарден инфаркт.
Остава ясно и безспорно, че има връзка между хипергликемия и повишена смъртност след остър миокарден инфаркт. Прегледът на различни статии, вариращи от експериментални и клинични проучвания, демонстрира няколко механизма, чрез които хипергликемията може да повлияе неблагоприятно на резултата от миокарден инфаркт. В заключителната част на прегледа се стигна до заключението, че ако лечението е насочено към нормализиране на кръвната захар, подобрява резултата от пациенти с остър миокарден инфаркт, които имат хипергликемия.
| Конкуриращи се интереси Никой не е деклариран Подробности за автора ШАРАН БАДИГЕР, д-р, професор, Катедра по медицина, Медицински колеж Шри Б М Патил, Виджаяпур, Карнатака, Индия. КОРЕСПОНДЕНЦИЯ: ШАРАН БАДИГЕР, д-р, професор, Медицински отдел, Медицински колеж Шри Б М Патил, Виджаяпур, Карнатака, Индия. Имейл: [email protected] |
Горната статия е лицензирана под международен лиценз Creative Commons Attribution-NonCommercial-NoDerivatives 4.0.
- Насоки за недостиг на желязо при бременност има надежда в изобилие - Auerbach - 2020 - British Journal of
- JKMS Journal of Korean Medical Science
- По-висок прием на протеин, свързан с по-бърз спад на бъбречната функция след инфаркт на миокарда
- Диета с ниско съдържание на въглехидрати от растителни или животински източници и смъртност при миокарден инфаркт
- Придържане към средиземноморската диета и синергия с остър миокарден инфаркт и неговите детерминанти