Елиан А. Лукасен
Лаборатория по неврофизиология, Катедра по молекулярна клетъчна биология, Университетски медицински център в Лайден, Лайден, Холандия
Джовани Чица
Секция по невроендокринология на затлъстяването, NIDDK, Национални здравни институти, сграда 10, CRC, Rm 6-3940, Bethesda, MD 20892-1613, САЩ
Резюме
Затлъстяването, излагането на стрес и недостатъчният сън са преобладаващи явления в съвременното общество. В този преглед ние се фокусираме върху техните взаимоотношения и критично оценяваме причинно-следствената връзка. При затлъстели индивиди една от основните стресови системи, хипоталамо-хипофизарно-надбъбречната ос, се променя и концентрациите на кортизол са повишени в мастната тъкан поради повишена локална активност на 11β-хидроксистероид дехидрогеназа (HSD) тип 1. Кратък сън намаленото качество на съня също е свързано със затлъстяването. В допълнение, експерименталното ограничаване на съня предизвиква промени в оста на HPA, които от своя страна могат да повлияят негативно на съня. Тези открития показват, че затлъстяването, стресът и загубата на сън са свързани в омагьосан кръг. И накрая, обсъждаме нови стратегии за борба със затлъстяването чрез модулиране на нивата на кортизол в мастната тъкан от 11β-HSD1 инхибитори или чрез подобряване на продължителността на съня.
Въведение
Националното проучване за здравни и хранителни изследвания съобщава, че през 2009–2010 г. 33% от възрастните американци са с наднормено тегло ((индекс на телесна маса (ИТМ) 25,0–29,9 kg/m 2)) и 36% са с наднормено тегло (BMI ≥ 30,0 kg/m 2) - значително увеличение от 1960 до 1962 г. - когато подобен процент на американците са с наднормено тегло (31%), но само 13% са с наднормено тегло [1]. Затлъстяването води до значителни здравословни проблеми, засягащи почти всяка система от органи, включително сърдечно-съдовата система и ендокринната панкреаса, причинявайки диабет тип 2. Успоредно с епидемията от затлъстяване, обществото става все по-забързано, представяйки ни многобройни стресови фактори, включително липса на възстановителен сън. В допълнение, продължителността на самосъобщаващия се сън е намаляла с 1,5 до 2 часа през последните 50 години в Америка [2]. Епидемиологичните и експериментални изследвания натрупват, че както стресовата система [3], така и качеството и продължителността на съня са засегнати при лица със затлъстяване.
Според неотдавнашен мета-анализ, включващ общо 23 372 индивида, психологическият стрес е в положителна корелация с измерванията на затлъстяването една до 38 години по-късно [5]. Общият размер на ефекта е относително малък (r = 0,014; 0,002–0,025) и размерът на ефекта е по-голям при мъжете, отколкото при жените (0,024 срещу 0,017), след по-продължително проследяване и при проучвания с по-високо качество. Връзката между обичайния кратък сън (обикновено по-малко от 5 часа на нощ) и затлъстяването беше допълнително демонстрирана в мета-анализ на 45 проучвания с напречно сечение, включително 604 509 възрастни (OR: 1,55; 1,43–1,68) [6]. Освен това съкращаването на съня и хроничният стрес са свързани независимо. В извадка от 1300 субекта възприеманият хроничен стрес е отрицателно свързан със самооценката на продължителността на съня [7]. Трябва да се отбележи обаче, че тези наблюдателни проучвания не могат да разграничат причината и следствието.
В този преглед ще разгледаме съответно връзката между затлъстяването и оста HPA, затлъстяването и съня и HPA оста и съня. За всяка от съобщените асоциации ние ще оценим критично експериментални изследвания в опит да определим причинно-следствената връзка и нейната посока. Накрая ще оценим потенциала на стратегиите, които имат за цел да подобрят нарушенията на оста HPA и да увеличат продължителността на съня за борба със затлъстяването.
Оста на HPA и затлъстяването
Физиология и оценка на HPA-ос
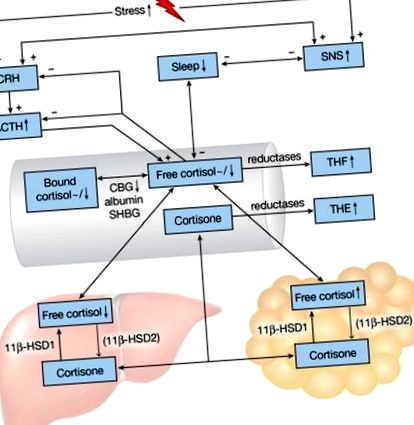
Схематично представяне на ос на HPA и промени в съня при затлъстяване. Знаците плюс и минус показват съответно положителни и отрицателни ефекти. Стрелки нагоре/надолу и тилди (
Кортизолът изобразява циркадна ритмичност, с пик сутрин, последван от постепенно падане през деня, което за кратко се прекъсва от хранене, и надир около 3 часа сутринта [4]. Само 5–10% от кортизола циркулира в активна свободна форма; кортизол свързващият глобулин (CBG) свързва повечето кортизол (80–90%) с висок афинитет и 10–15% се свързва с албумин и глобулин, свързващ половите хормони с по-нисък афинитет (фиг. 1) [11, 12]. CBG е напълно наситен при нива на кортизол над 500 nmol/l и също така показва дневна променливост, с пик в ранния следобед [12, 13].
Нивата на кортизол могат да бъдат определени в плазмата, слюнката и урината [13]. В плазмата обикновено се измерват общите нива на кортизол и несвързаната, белтъчна фракция се оценява индиректно, като се използва уравнението на Coolens [12]. Измерванията в слюнката оценяват биологично активния кортизол без протеини; следователно ефектите от промените в субекта или разликите между субектите в CBG се елиминират. Образците на слюнката се събират по-лесно от плазмата и поради неинвазивното събиране те са без стрес. Въпреки че свободният кортизол в урината се отнася до неконюгиран кортизол, нивото му е пропорционално на свободния (несвързан с протеини) кортизол в кръвта. Получаването на урина за безплатно, неконюгирано измерване на кортизол също е без стрес, но тестът изисква 24-часово събиране в присъствието на киселинен консервант. Нивата на кортизол в слюнката се увеличават в рамките на 5 минути след повишаване на плазмения кортизол в плазмата и въпреки че нивата са с 30-50% по-ниски, под 500 nmol/l те обикновено са добре корелирани с плазмените нива [13].
Два NAPD (H) -зависими изоензима 11β-хидроксистероид дехидрогеназа (11β-HSD1 и 11β-HSD2) вътреклетъчно превръщат неактивния кортизон в хормонално активен кортизол и обратно (фиг. 1) [14]. 11β-HSD1 се експресира главно в черния дроб и мастната тъкан, докато 11β-HSD2 упражнява своята функция в бъбреците и дебелото черво, правейки кортизоловото действие специфично за тъканите. Кортизолът и кортизонът се метаболизират до неактивни тетрахидрометаболити (THM) чрез чернодробна 5α- и 5β-редуктаза. Кортизолът се превръща в кортол и тетрахидрокортизол (THF, 5α-THF и 5β-THF), докато кортизонът се метаболизира до кортолон и тетрахидрокортизон (THE) - метаболити, често измервани в урината. Промените в активността на 11β-HSD1 се отразяват от съотношението на урината (THF + 5α-THF + кортол)/(THE + кортолон), например намалената активност на 11β-HSD1 би довела до повишени нива на THE и по-ниски нива на THF, като по този начин до намалено (THF + α-THF)/съотношението.
Асоциация на HPA-ос и затлъстяване
Сутрешните нива на кортизол в слюнката и плазмата или не показват корелация, или корелират отрицателно с различни мерки за затлъстяване (фиг. 1) [15]. Еднократните определяния на кортизола обикновено са недостатъчни, за да се направи заключение за функционалния статус на оста HPA, като се има предвид неговата динамична природа: реакцията на пробуждане на кортизола, т.е. повишението на плазмения кортизол, настъпващо 20–30 минути след обичайното време за събуждане, е по-информативен за тази цел, но е силно променлив сред хората. Освен това измерванията на кортизола могат да бъдат объркани от стресорите през деня. Два пъти на час измерените плазмени нива на кортизол са непрекъснато по-ниски в продължение на 24 часа при затлъстели индивиди (среден ИТМ 35,4 kg/m 2) в сравнение с мъже без затлъстяване (среден BMI 26,8 kg/m 2) [16]. В други проучвания 24-часовите нива на кортизол без урина не корелират с ИТМ или обиколката на талията, но продуктите на разграждане на кортизола (THM) са положително корелирани с тези антропометрични измервания [17–19]. 5β-THE в урината са били увеличени при затлъстяване, което показва, че повишеното 5β намаляване на кортизона може да бъде механизмът в основата на повишения процент на клирънс на кортизол при затлъстяване [19]. По този начин при затлъстяването изглежда, че има повишен оборот (производство и катаболизъм на кортизол), без непременно да се променят нивата на циркулация или кортизол (фиг. 1).
Средните 24-часови нива на ACTH в плазмата са положително свързани с ИТМ, вероятно отразяващи повишено хипоталамусно шофиране и/или намалена отрицателна обратна връзка на кортизола [16, 24]. Хората с висок ИТМ са по-малко чувствителни към потискане на кортизола от 4 mg дексаметазон [15], но не и от по-ниски дози дексаметазон (0,0035 mg/kg и 1 mg) [14, 25]. Друго проучване установява по-ниска супресия на кортизол при жени, но не и при мъже, с 0,0035 mg/kg – 0,015 mg/kg или стандартна доза от 1 mg дексаметазон, което показва, че връзката между затлъстяването и HPA-супресията може да бъде както дозата, така и пола. зависим [26]. От друга страна, HPA-стимулацията с интравенозна овча CRH [16], ACTH [25] или тестове за психически стрес [25] повишава нивата на кортизол повече при затлъстели и слаби индивиди. По този начин оста HPA изглежда свръх-реагираща на стрес при затлъстели индивиди и въпреки това, по-малко реагираща на отрицателна обратна връзка, вероятно за предотвратяване на падането на нивата на свободен кортизол под нормалните граници.
В допълнение, симпатиковата нервна система изглежда хиперактивна при субекти с централно затлъстяване, както се посочва от по-високо нервно отделяне от мускулната симпатикова активност [27]. Повишената секреция на адипокин от коремната мастна тъкан, включително лептин и свободни мастни киселини, може да повиши централно симпатиковата активност, тъй като адипокините често са в състояние да преминат през кръвно-мозъчната бариера. На свой ред, хронично повишената активност на SNS може да наруши β-адренергичната сигнализация и да дерегулира оста на HPA, допринасяйки за затлъстяването [27].
Промени в оста на HPA при затлъстели субекти: причина и следствие?
За да се определи връзката между стреса и регулирането на телесното тегло, оста HPA е изследвана при затлъстели лица преди и след загуба на тегло. Шестнадесет седмици с много нискокалорична диета предизвикват загуба на тегло от 29 кг, което е свързано със значително намаляване на експресията на 11β-HSD1 иРНК в мастната тъкан [32]. По подобен начин се съобщава за четирикратно намаляване на експресията на иРНК на 11β-HSD1 при затлъстели жени 2 години след операция за стомашен байпас след средна загуба на тегло от 40 kg [33]. В допълнение, тези жени са имали намален THM в урината и намалена прогнозна активност на 5α-редуказа, което показва, че свързаното със затлъстяването повишено регулиране на 5α-редуктазата е адаптивна реакция за противодействие на хиперкортизолизма [33]. Субклиничното възпаление при затлъстяване може да допринесе за промени в оста на HPA; например затлъстяването е свързано с повишени нива на циркулиращ IL-6, което от своя страна повишава регулирането на експресията на 11β-HSD1 [34]. Тези открития предполагат, че редуванията на оста HPA са както причина, така и ефект от затлъстяването и че те са потенциално обратими до определена точка.
Сън при затлъстяване
Недостатъчният сън е свързан с повишен ИТМ (фиг. 1) [4, 6]. Затлъстелите възрастни (ИТМ: 41 ± 1 kg/m 2) без сънна апнея спят 88 минути по-малко от слаби субекти, както се оценява чрез полисомнография [35]. В проспективни проучвания се наблюдава отчетливо, но умерено наддаване на тегло при къси траверси (по-малко от 5–6 часа), които са качили 0,4 кг при 16-годишно проучване и 2 кг при 6-годишно проучване [4]. Въпреки това, хората с кратка обичайна продължителност на съня са имали 31% и 35% по-голям шанс за клинично значимо наддаване на тегло (5 kg и 15 kg), което предполага голяма вариабилност в тази асоциация.
HPA-ос и сън
HPA-Axis Dynamics и Sleep
Последици от неадекватен сън върху функцията на HPA-ос
Началото на съня предизвиква инхибиторен ефект върху нивото на кортизол, предизвиквайки намалени нива на кортизол за 1-2 часа след началото на съня [10]. Този ефект се наблюдава, когато субектите са били изложени на 3-часов цикъл сън-събуждане или са спали през деня. Инхибирането на нивата на кортизол се наблюдава и при условия на „свободно бягане“, когато индивидите нямат времеви сигнали и сънят обикновено се започва в по-късна фаза на вътрешния циркаден ритъм на кортизол [10]. В допълнение, нощните пробуждания временно повишават нивата на кортизол, докато сутрешното пробуждане предизвиква значително и по-трайно покачване на нивата на кортизол. Бавният сън е в корелация с най-ниските нива на кортизол и най-ниския отговор на кортизол/ACTH към приложението на CRH [10].
Слюнченият и плазменият кортизол бяха повишени следобед и вечер след експериментално частично и пълно лишаване от сън, докато сутрешните нива бяха непроменени или дори намалени [4]. Средните 24 h плазмени нива на кортизол, измерени на всеки 30 минути, са непроменени [4]. Някои проучвания също съобщават за намален пик на кортизол след лишаване от сън и по-бавен спад на нивата на кортизол след неговата акрофаза [4]. В допълнение, сънят може да повлияе на динамиката на оста HPA: субекти, показващи лош сън, са имали преувеличена реакция на комбинирано предизвикателство дексаметазон/CRH [40 •].
Острото лишаване от сън е стресор, за който е известно, че активира симпатиковата активност, като същевременно намалява парасимпатиковия тонус, както е показано от повишените плазмени нива на епинефрин и норепинефрин (фиг. 1) [4].
Последици от промени в HPA върху съня
Пациентите със синдром на Кушинг често имат обструктивна сънна апнея, което от своя страна влияе върху качеството на съня [16, 41]. В допълнение, дори пациенти с ACTH-зависим синдром на Кушинг без сънна апнея имат 18% намаление на ефективността на съня (съотношението между времето на сън и времето, прекарано в леглото), пациентите се събуждат два пъти по-често (6 срещу 3 пъти) и 12 % увеличение в сън от етап 1 в сравнение с нормалните контроли [41]. Това показва директните вредни ефекти върху съня на необичайно повишени нива на циркулиращи глюкокортикоиди. Сънят при пациенти с болест на Адисън е по-малко проучен, но не се проявява с големи нарушения на съня [42, 43]. При заместваща терапия с хидрокортизон обаче продължителността на REM съня се увеличава при тези пациенти [42].
Интравенозното приложение на CRH или ACTH при овце намалява REM и SWS [43]. Инфузията на кортизол също намалява REM, като същевременно увеличава SWS, което показва, че ефектите на оста HPA върху REM могат да бъдат медиирани от кортизол, но увеличаването на SWS в инфузията на кортизол може да се дължи на отрицателна обратна връзка за CRH [43]. Прилагането на синтетичен стероид преднизолон намалява REM, но няма ефект върху SWS [43].
Борба с промени на оста на HPA и загуба на сън: нови терапии за затлъстяване?
Тъй като както оста на HPA, така и промените в съня влияят върху регулирането и състава на телесното тегло, насочването им към борба с епидемията от затлъстяване изглежда жизнеспособна стратегия. Неотдавнашно рандомизирано контролно проучване за отслабване съобщи, че афро-американските жени с наднормено тегло или със затлъстяване с високи нива на стрес са склонни да губят повече тегло, ако терапията за управление на стреса се добави към 12-седмична програма за начин на живот (2,7 срещу 1,4 кг); последователно сутрешният слюнчен кортизол има тенденция да намалява в по-голяма степен в тази група [44 •]. Това малко проучване има ограничена статистическа мощност само с 22 жени на група, но намеква, че намаляването на общите нива на стрес може да допринесе за загуба на тегло.
Новите фармакологични подходи за противодействие на затлъстяването чрез манипулации на оста HPA са се фокусирали върху 11β-HSD инхибитори, което по принцип би позволило специфични за тъканите промени в концентрациите на кортизол, без да се засягат нивата на циркулация. Карбеноксолон е неселективен инхибитор на 11β-HSD1 и 11β-HSD2. Някои проучвания, използващи този инхибитор, съобщават за по-ниска експресия на 11β-HSD1 в мастната тъкан, докато някои не [19, 20 •]. Едно проучване съобщава за по-ниски нива на холестерол и намалена глюкогенолиза при здрави пациенти след 7-дневно приложение на 300 mg карбеноксолон [45]. Инхибирането на 11 • -HSD2 обаче може да доведе до кортизол-зависим минералокортикоиден излишък, тъй като кортизолът може да активира минерално-кортикоидния рецептор в бъбреците, предизвиквайки задържане на натрий, хипокалиемия и задържане на течности.
Удължаването на продължителността на съня при хронично лишени от сън субекти е предизвикателна задача. Малко наблюдателно проучване съобщава, че късите траверси (по-малко от 6 часа на нощ; среден ИТМ 27 kg/m 2), които съобщават, че са удължили съня си на 7-8 часа 6 години по-късно, са увеличили една точка в ИТМ, докато хората, които съобщават, че все още спят по-малко от 6 часа на нощ увеличава техния ИТМ с 2,1 точки [49]. Това проучване не е рандомизирано и оценява продължителността на съня само в две времеви точки и с въпросник, субективно измерване. В момента провеждаме голяма рандомизирана контролирана пътека (ClinicalTrials.gov, идентификатор:> NCT00261898), за да изследваме ефекта от удължаването на съня в кохорта от хора със затлъстяване с къс сън [50 •].
Заключения
Субектите със затлъстяване показват промени както в оста на HPA, така и в съня. Въпреки че нивата на циркулиращия кортизол често са непроменени при индивиди със затлъстяване, HPA оста изглежда хиперактивна, тъй като има специфични за тъканите промени в концентрациите на кортизол поради диференциалната експресия на 11β-HSD. Кратката обичайна продължителност на съня и експерименталното ограничаване на съня водят до телесни промени, които могат да доведат до затлъстяване, вероятно чрез повишен апетит и прием на храна, но недостатъчният сън също нарушава оста на HPA. Независимо от това, проучванията, изследващи динамиката на оста HPA при това състояние, са оскъдни и няма пряка информация за специфичните корелации на, например, активност 11β-HSD, циркулиращи нива на CBG и сън, доколкото ни е известно. От своя страна активирането на оста HPA може да повлияе негативно на съня. Въпреки че се съобщава за повишено разпространение на сънна апнея или повишен стрес/HPA-активиране, липсват преки доказателства за възможността затлъстяването да доведе до влошен сън.
Тъй като загубата на сън и оста HPA изглежда участват в патогенезата на затлъстяването, подходите, насочени към модулиране на тези системи, изглеждат жизнеспособни. Генерирането на тъканно специфични 11β-HSD1 инхибитори е особено обещаващо, тъй като това може ефективно да насочи кортизола в избрани тъкани, без да повлиява нивата на циркулиращия кортизол, поради което има ограничени нежелани странични ефекти. Привлекателността на нов клас лекарства, базирани на обобщения механизъм, се отразява от мащаба на текущите изследвания. В момента се провеждат клинични проучвания, насочени към намаляване на общите нива на стрес или подобряване на хигиената на съня чрез увеличаване на продължителността на съня.
В заключение, затлъстяването, сънят и оста на HPA изглежда са свързани в пагубен цикъл с много сложни взаимодействия, включително имунната система и регулирането на апетита. Необходими са допълнителни изследвания в тази област, за да се разберат промените в тези системи и в крайна сметка да се преборим със затлъстяването.
Благодарности
Това проучване беше изцяло подкрепено от Националните здравни институти (NIH), Интрамурална програма за изследвания: Национален институт по диабет и храносмилателни и бъбречни заболявания (NIDDK). Бихме искали да благодарим на д-р Gyorgy Csako за полезни предложения при прегледа на тази статия.
E.A. Лукасен е получил безвъзмездна подкрепа от стипендията на Фулбрайт, стипендията на VSBfonds, стипендията на Университетския фонд в Лайдън. G. Cizza получи безвъзмездна помощ от ZIA DK047054-04 Хронично лишаване от сън като рисков фактор за ендокринни и имунни промени.
Бележки под линия
Разкриване Не са докладвани потенциални конфликти на интереси, свързани с тази статия.
Информация за сътрудника
Елиан А. Лукасен, Лаборатория по неврофизиология, Катедра по молекулярна клетъчна биология, Медицински център на Университета в Лайден, Лайден, Холандия.
Джовани Чица, Секция по невроендокринология на затлъстяването, NIDDK, Национални здравни институти, сграда 10, CRC, Rm 6-3940, Bethesda, MD 20892-1613, САЩ.
Препратки
Хартиите от особен интерес, публикувани наскоро, бяха подчертани като:
- Връзката между детското затлъстяване и хроничните заболявания Статии Mount Nittany Health System
- Световната федерация по затлъстяването признава затлъстяването като хронично рецидивиращо прогресивно заболяване Д-р
- Връзката между съня и затлъстяването
- Лечение на тежко затлъстяване за намаляване на диспнея при пациенти с хронична белодробна практика
- Разбиране на връзката между хронична болка и затлъстяване HCPLive