Холинът (триметил-β-хидроксиетиламоний) е кватернерно амониево съединение със сложна роля в различни важни неврохимични процеси.
Свързани термини:
- Магнитен резонанс
- Ейкозаноиден рецептор
- Ацетилхолин
- Ензими
- Метионин
- Креатин
- Инозитол
- Липиди
- Протеин
- Клетъчната мембрана
Изтеглете като PDF
За тази страница
Аминокиселини и азотни съединения
Храносмилане и абсорбция
Съдържащите холин фосфолипиди се разцепват от панкреатичната фосфолипаза А2 (EC3.1.1.4) и полученият лизофосфатидилхолин (който става част от смесени мицели) се поема в тънкочревния ентероцит.
Свободният холин се поема както чрез медииран транспорт, така и чрез дифузия по цялото тънко черво (Zeisel, 1994). Катионният аминокиселинен транспортер 2 (CAT-2, y +, SLC7A2) се експресира в четката на тънките черва и специфично медиира поемането на холин в ентероцитите. Голяма част от абсорбирания холин се включва във фосфолипидите и се секретира с хиломикрони в лимфата.
Лизофосфолипазата (EC3.1.1.5) разцепва лизофосфатидилхолин и след това глицерилфосфохолин фосфодиестеразата (EC3.1.4.2) накрая освобождава холин. Износът на свободен холин през базолатералните мембрани все още не е добре разбран. Поглъщането на бетаин от чревния лумен също се нуждае от допълнителни изследвания. Установено е, че при пилетата участват зависими от натрий и натрий независими компоненти (Kettunen et al., 2001).
Забележка: Чревните бактерии разграждат значителна част от погълнатите холин и холин фосфолипиди до бетаин и до триметиламин (ТМА). Както бетаинът, така и ТМА се абсорбират. Флавин-съдържаща монооксигеназа (FMO, EC1.14.13.8) N-окислява ТМА. Основната изоформа, отговорна за метаболизма в черния дроб, е FMO3 (Treacy et al., 1998). FMO2 допринася в по-малка степен. Установено е, че близо 4% от субектите с подозрение за телесна неприятна болест имат силно нарушено TMA N-окисление (синдром на миризма на риба). Техните родители са имали по-слабо изразено (но все още забележимо) намаление на FMO активността (Ayesh et al., 1993).
ХОЛИН | Физиология
Обобщение
Холинът в диетата е важен по много причини. Тъй като нашето разбиране за важността на храненето с фолиева киселина и хомоцистеин се увеличава, трябва да се увеличи интересът към това как холинът взаимодейства с метаболизма на фолатите и хомоцистеина. Последните открития за холина в развитието на мозъка трябва да стимулират сравними проучвания при хора. През следващите няколко години е вероятно данните за състава на храните да бъдат на разположение за холин и това ще позволи да се изследват взаимодействията между холин, фолат и метионин при разглеждане на епидемиологични данни. Освен това трябва да научим повече за изискванията за холин при жените. Поради тези причини интересът към холина като хранително вещество за хората трябва да се поддържа.
ХОЛИН | Свойства и определяне
Заден план
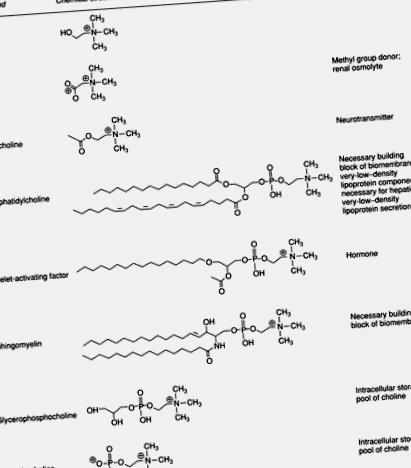
Холинът е често срещана съставка на храните и е съществен компонент на човешката диета. Този кватернерен амин е важен за структурната цялост и сигналните функции на клетъчните мембрани; той е основният източник на метилови групи в диетата; той пряко влияе върху холинергичната невротрансмисия; и е необходим за липиден транспорт/метаболизъм. Повечето холин в човешките тъкани се намират във фосфолипиди като фосфатидилхолин и сфингомиелин. В някои компоненти, като човешкото мляко, холиновите естери фосфохолин и глицерофосфохолин са преобладаващите форми на холин. Въпреки че представляват по-малка част от общия холинов пул, важните метаболити на холина включват фактор, активиращ тромбоцитите, ацетилхолин, холин плазмологени, лизофосфатидилхолин и бетаин (Фигура 1).
Фигура 1 . Биологично важни метаболити на холина.
Витамини
1 холин
Холинът е особено забележителен, тъй като играе ключова роля в метаболизма на метиловата група, канцерогенезата и транспорта на липиди като компонент на лецитина (Garrow, 2007). Холинът обикновено се произвежда в достатъчно количество; обаче при млади растящи животни може да се получи положителен растежен отговор при добавяне на холин, предлаган в търговската мрежа като триметил хидроксиетил амониев хлорид или като битартрат. Холинът обикновено се добавя към диетите, за да се намали нуждата от активирани метилови групи, доставяни от метионин. По-икономично е да се добавя холин за тези метилови групи, отколкото да се добавя метионин.
Холинът е един от предшествениците на ацетилхолин. Холинът също е компонент на сфингомиелин и лецитин. Образуването на бетаин от холин осигурява важни източници на лабилни метилови групи за реакции на трансметилиране. Холинът може също да бъде синтезиран de novo от етаноламин, когато метионинът или диметилцистеинът или бетаинът са в достатъчни количества. Най-разпространеният източник на холин в диетата е лецитинът. Основният признак на недостиг на холин е затлъстяването на черния дроб. При маймуни, кучета, котки и плъхове също е доказано, че продължителният дефицит на холин води до цироза. При мишки и плъхове продължителният дефицит в крайна сметка води до хепатоцелуларен рак, уникален пример за хранителен дефицит, водещ до неоплазма. Често се добавят петстотин до 1000 mg холин на килограм диета (Garrow, 2007).
Холин и фосфатидилхолин
Чревна абсорбция
Свободният холин и съдържащите холин фосфолипиди се абсорбират в червата по няколко механизма. Част от свободния холин се метаболизира до бетаин от чревните бактерии, който след това се абсорбира с помощта на активни Na + и Cl-свързани транспортни системи и пасивна Na + -независима транспортна система. Останалият свободен холин се абсорбира в ентероцитите с помощта на транспорт, медииран от носител. Холин-съдържащите фосфолипиди (включително фосфатидилхолин) първо се хидролизират от панкреатични ензими и от липази от чревни лигавични клетки, освобождавайки холиновата молекула от фосфолипидния скелет. Бионаличността на холин от фосфолипиди е различна при децата, отколкото при възрастните, поради разликите във физиологията на храносмилателната им система. Тъй като новородените разчитат почти изключително на майчиното мляко или адаптирано мляко, съдържанието на холин и неговата бионаличност в млякото са съществени фактори за постигане на препоръчания прием на холин през първите 6 месеца от живота (Таблица 1).
Маса 1 . Адекватен прием на диетичен холин, горни граници и неблагоприятни ефекти от прекомерното добавяне
| Кърмачета и деца | 0–6 месеца | 125 | Не е установено | Рибна телесна миризма, гадене и диария (150 mg kg -1 ден на ден и повече) |
| 7–12 месеца | 150 | Не е установено | ||
| 1–3 години | 200 | 1 | Дразнене на стомашно-чревния тракт, повръщане, сълзене и анорексия (8 g на ден -1 и повече) | |
| 4–8 години | 250 | 1 | ||
| 9–13 години | 375 | 2 | Замъглено зрение (9 g на ден -1 и повече) | |
| Момчета | 14–18 години | 550 | 3 | |
| Момичета | 14–18 години | 400 | 3 | |
| Бременни жени | Всички възрасти | 450 | 14–18 години: 3 g | |
| 19 години и повече: 3,5 g | ||||
| Кърмещи жени | Всички възрасти | 550 | 14–18 години: 3 g | |
| 19 години и повече: 3,5 g | ||||
| Други мъже | 550 | 3.5 | ||
| Други жени | 425 | 3.5 |
Яйчен холин
Холинът е създаден като основно хранително вещество през 1999 г. с препоръчителна дневна доза (RDI) от 550 mg d -1 за мъже и 450 mg d -1 за жени. RDI за холин се увеличава по време на бременност и кърмене поради високата скорост на трансфер на холин от майката към плода и в кърмата. Изследванията върху животни показват, че холинът играе съществена роля в развитието на мозъка, особено в развитието на центровете за памет, на плода и новороденото. Последните проучвания показват, че по-високият прием на холин е свързан с намален риск от дефекти на нервната тръба, намаляване на плазмените маркери на възпалението и намален риск от рак на гърдата. Изследванията също така показват, че в САЩ по-малко от 10% от възрастните мъже и жени постигат препоръчителния AI за холин, включително само 1 на 10 бременни жени. Лецитинът от яйчен жълтък (фосфотидилхолин) е отличен източник на диетичен холин, осигуряващ 125 mg холин на голямо яйце, а добавянето на яйце на ден към диетата може значително да увеличи броя на възрастните с достатъчен прием.
Патофизиологични роли и клинично значение на биомаркерите при остър коронарен синдром
Cangel Pui-yee Chan, Timothy Hudson Rainer, в Advances in Clinical Chemistry, 2013
7.1 Холин
Холинът е водоразтворимо органично съединение с молекулно тегло 104,17 g/mol. Класифициран е като основно хранително вещество от Съвета по храните и храненето на Медицинския институт [85]. Той участва в синтеза на фосфолипиди и други структурни компоненти на клетъчните мембрани и като предшественик на важния невротрансмитер ацетилхолин [86]. Хората могат да синтезират холин в малки количества чрез превръщане на фосфолипида, фосфатидилетаноламин, във фосфатидилхолин чрез de novo синтез. Хората обаче не могат да синтезират достатъчно холин, за да отговорят на метаболитните нужди. Достатъчно количество холин може да се получи чрез диетата.
Необходими са допълнителни проучвания за изследване на клиничното му значение при пациенти със съмнение за ОКС. Също така в момента холинът се определя чрез използване на високоефективна течна хроматография-масспектрометрия, което усложнява приемането му в рутинната клинична употреба. Необходимо е разработване на бърз и прост анализ, за да се оцени дали холинът може да идентифицира високорискови пациенти в клиничната практика.
Мозъчна и нервна система: биология, метаболизъм и хранителни изисквания
Холин
Селскостопански и свързани биотехнологии
4.57.6.1 Холин
Структура и функция на холин-свързващите протеини
Серджо Галан-Бартуал,. Хуан А. Хермосо, в Streptococcus Pneumoniae, 2015
Структурна пластичност на CBR: Функционални последици
CBR обикновено са подредени в ββ-3 соленоид, показващ 120 ° въртене в посока на въртене на часовниковата стрелка. Тази структурна подредба е независима от броя на ароматните остатъци, участващи в стабилизирането на холина. Мутациите и/или вмъкванията в повторението обаче засягат суперхеличната геометрия, изключват свързването на холин и насърчават специфични структурни промени в CBP, които са критични за тяхната специфична функция. Наличието на допълнителна β-верига със заредени остатъци в p10 повторението на LytC създава триверижен анти-успореден β-лист, който прекъсва въртенето на суперхелика. Повторението p11 също променя структурата си, благоприятствайки стабилизирането на каталитичния домен и ориентирането на неговия активен център към CBM, което води до характерната кукообразна конформация на LytC (Фигура 11.3F), която е критична за неговата физиологична функция (виж Autolysin LytC ”раздел).
Фигура 11.3. Триизмерни структури на CBP.
(A) Лентова диаграма на Pce с пълна дължина (PDB код 2BIB), показваща CBM във виолетово, каталитичния модул в оранжево и линкер в зелено. Холиновите аналози са изобразени като зелени сфери, а (2,2 ′: 6 ′, 2 ″ -терпиридин) -платина (II), използвана за фазиране на C-LytA, е представена като циан сфери. Този цветен код се поддържа във всички панели. Продуктите от реакцията (PC) в активния сайт са изобразени като жълти сфери. (B) Кристална структура на CbpM (PDB код 3HIA). (C) Триизмерна структура на R2 домейна на CbpA (PDB код 1W9R). (D) Лентова диаграма на CbpF с CBM във виолетово, домейн на линкер в циан и N-краен домейн в оранжево (PDB запис 2V04). Консенсус (p1 – p5) и неконсенсус (dp1 – dp6) CBR са обозначени. (E) Триизмерни структури на CBM на LytA (C-LytA) (PDB запис 1HCX) и каталитичния модул на LytA (PDB код 4IVV). Димерното подреждане се основава на кристалографски и SAXS изследвания [53]. (F) Триизмерна структура на пневмококов автолизин LytC (PDB запис 2WWD). Повторенията p10 и p11, представящи различно структурно подреждане, са оцветени в синьо. (G) Триизмерна структура на каталитичния модул на LytB. Модулът от фамилия гликозид хидролаза 73 е оцветен в оранжево, модулът WW в циан, а модулът SH3b в тъмно синьо. (Н) Структура на LB домейна на PspA.
В CbpF вмъкванията в каноничните повторения водят до напълно различна триизмерна структура. Неговият N-краен домейн е изграден от шест неконсенсусни CBR, осигуряващи дискообразна конформация за този домейн (Фигура 11.3D), решаваща за неговата регулаторна роля (вижте раздела „Холин-свързващ протеин F“). Друга структурна вариация се наблюдава при Cpl-1, CBP, кодиран от пневмококов фаг Cp-1, при който последните две повторения (наречени p5 и p6), заедно със С-крайната опашка, са сгънати в удължен шест-верижен β -лист, който предотвратява свързването на холин и насърчава интермодулни взаимодействия с каталитичния домейн (Фигура 11.4А).
Фигура 11.4. Триизмерни структури на фагови CBP.
(A) Триизмерна структура на ендолизин Cpl-1 с пълна дължина в комплекс с холин (зелени сфери) (PDB код 1OBA). Модулът лизозим (семейство GH25) е оцветен в оранжево, линкерът в циан, а CBM във виолетово. Първите четири повторения (p1 – p4) са сгънати в суперхелично подреждане, което позволява свързване на холин, докато крайните повторения (p5 – p6) и С-крайната опашка са сгънати в шест-верижен β-лист, който позволява интермодулни взаимодействия с каталитичния модул. (B) Структура на CBM на фагов LytA-подобен протеин (PDB код 4IWT). Както се наблюдава в LytA, CBM образува димер чрез взаимодействия на повторенията на С-терминала. Молекули на холин, представени в пръчки.
Въпреки че основната роля на CBR е свързването на холин, досега докладваните структурни примери показват голяма пластичност на тези повторения, като по този начин позволяват различни структурни и функционални роли във всеки CBP.
- Ендокринна болест - общ преглед на ScienceDirect теми
- Жажда за храна - общ преглед на ScienceDirect теми
- Консервирани меса - общ преглед на ScienceDirect теми
- Усложняване на затлъстяването - общ преглед на ScienceDirect теми
- Въглехидратите в човешкото хранене - общ преглед на ScienceDirect теми