1 Здравен център, Университет Фукуока, 8-19-1 Нанакума, Джонан-ку, Фукуока 814-0180, Япония
2 Център за клинични изследвания, Медицински център Кюшу, Национална болнична организация, Фукуока 810-8563, Япония
3 Катедра по гастроентерология, Медицински център Кюшу, Национална болнична организация, Фукуока 810-8563, Япония
Резюме
Безалкохолната мастна чернодробна болест (NAFLD) е често срещано хронично чернодробно заболяване, което варира в тежест от проста стеатоза до цироза. Счита се, че NAFLD е свързана с чернодробни метаболитни нарушения, водещи до свръхкумулиране на мастни киселини/триглицериди и холестерол. Патогенезата и прогресията на NAFLD обикновено се обясняват с „теорията за два удара“. Повечето изследвания на липидния метаболизъм в NAFLD черен дроб са фокусирани върху метаболизма на мастни киселини/триглицериди; следователно въздействието на метаболизма на холестерола все още е неясно. В тази статия ние правим преглед на последните проучвания за NAFLD от гледна точка на свързаните с чернодробния липиден фактор метаболизъм и обсъждаме влиянието на нарушен метаболизъм на холестерола в етиологията на NAFLD. Обсъжда се и клиничното значение на управлението на метаболизма на холестерола, вариант за лечение на NAFLD.
1. Въведение
Хистологичните характеристики на неалкохолната мастна чернодробна болест (NAFLD) включват стеатоза, хепатоцелуларен балон, образуване на тела на Mallory, апоптоза/некроза и възпаление [1]. Около 10–20% от пациентите с NAFLD имат неалкохолен стеатохепатит (NASH), който може да се развие в цироза и хепатоцелуларен карцином [2–5]. Тъй като излишният прием на храна е една от основните причини, NAFLD често се придружава от затлъстяване, инсулинова резистентност, хипертония и/или дислипидемия, които са прояви на метаболитния синдром [6]. Следователно, управлението на храненето и терапевтичните упражнения са основни стъпки за лечение на NAFLD.
Все по-често се възприема „теорията с два удара“, за да се обясни патогенезата на NAFLD и NASH [7]. В тази теория първото попадение се състои от натрупване на мастни киселини/триглицериди в черния дроб, докато второто попадение включва оксидативен стрес, митохондриална дисфункция и възпаление, които в крайна сметка причиняват увреждане на черния дроб. Също така е ясно, че възпалителните цитокини и инсулиновата резистентност са тясно свързани с затлъстяването на черния дроб по време на прогресията на NAFLD. В предишни проучвания, които са изследвали липидния метаболизъм в контекста на NAFLD, дисрегулацията на метаболизма на холестерола е получавала много по-малко внимание, отколкото мастните киселини и триглицеридите. В тази статия ние се фокусираме върху ролята на холестерола и неговите метаболити върху патогенезата на NAFLD, както и върху валидността на управлението на холестерола като метод за лечение на това заболяване.
2. Метаболизъм на мастните киселини в черния дроб на NAFLD
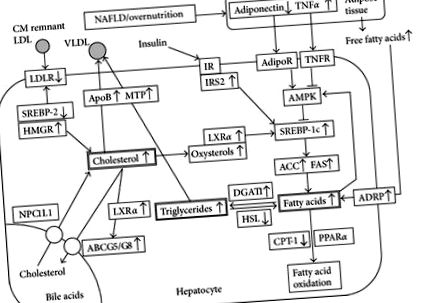
Чернодробната липидна хомеостаза представлява баланс между усвояването, синтеза, катаболизма и секрецията на липиди. Следователно, стеатозата, типична характеристика на NAFLD, се очаква да бъде причинена от нарушен липиден метаболизъм, по-специално инхибиране на окисляването на мастните киселини и засилена липогенеза. Идентифицирани са много фактори, участващи в пътищата на метаболизма на черния дроб, въпреки че точните клетъчни мрежи не са напълно изяснени.
Адипонектинът регулира усвояването на чернодробните мастни киселини и de novo липогенеза. АМР-активираната протеин киназа (AMPK) работи като главен метаболитен превключвател и нейната активност се регулира от адипонектин и тумор некрозис фактор-α (TNFα). Инхибирането на AMPK води до активиране на протеин-1с-свързващ регулаторен елемент на стерол (SREBP-1c), който усилва регулирането на ензимите, свързани с синтеза на мастни киселини, като ацетил-КоА карбоксилаза (ACC) и синтаза на мастни киселини (FAS). Това води до засилен синтез на мастни киселини и свръхпроизводство на триглицериди, което в крайна сметка води до чернодробна стеатоза [8]. Мастните киселини се използват за β-окисление в митохондриите и пероксизомите при регулиране на активирания от пероксизома пролифератор рецептор-α (PPARα). Мастните киселини са лиганди за PPARα, който трансактивира експресията на гени, участващи в транспорта, окисляването и износа на свободни мастни киселини, включително карнитин палмитоилтрансфераза-1 (CPT-1), ограничаващия скоростта ензим в мастната киселина β-окисление.
Последните открития показват, че канабиноидната система също участва в развитието на затлъстяване на черния дроб [22–24]. При проучвания върху животни канабиноид 1 (CB1) рецепторите се активират чрез диета с високо съдържание на мазнини чрез индукция на синтеза на ендоканабиноиди, като 2-арахидоноилглицерол и анандамид. Активирането на CB1 рецептора засили експресията на няколко липогенни фактора, включително SREBP-1c, ACC и FAS, и понижено регулиране на CPT-1, в резултат на което се увеличи de novo синтез на мастни киселини и потискане на окисляването на мастни киселини. Въпреки това, в контекста на липидния метаболизъм, сигналният път надолу по веригата на канабиноидния рецептор не е идентифициран.
3. Метаболизъм на холестерола при NAFLD
При хората холестеролът се абсорбира от храната и се синтезира от клетките в различни тъкани. Здравият мъж с тегло 60 kg съдържа приблизително 140 g холестерол, но само 1% от общия холестерол участва в динамичен метаболитен цикъл [25]. В едно проучване средният прием на диетичен холестерол се оценява на 300-500 mg/ден [14]. Те също така съобщават, че диетичният холестерол се агрегира в мицели с жлъчен холестерол (800–1300 mg/ден) в дванадесетопръстника [14]. Физиологично приблизително 50% от холестерола се абсорбира в йеюнума чрез транспортер на холестерол Niemann-Pick C1-подобен 1 (NPC1L1), експресиран върху мембраната на четката. След това холестеролът се транспортира до черния дроб под формата на хиломикрони и остатъци от хиломикрон [26]. NPC1L1, който може да улесни чернодробното натрупване на холестерол, се експресира върху каналикуларната мембрана на хепатоцитите при хората. Друга транспортна помпена система, включваща ATP-свързваща касета (ABC) G5/G8, екскретира холестерола в жлъчката [27].
Основните метаболитни пътища на холестерола в хепатоцитите включват (1) холестерол de novo синтез (път на ацетил-КоА-мевалонат-холестерол); (2) поемане на холестерол под формата на остатъци от LDL и хиломикрон; (3) отделяне на холестерол в кръвта под формата на VLDL; (4) отделяне и поемане на холестерол чрез жлъчката чрез ABCG5/G8 и NPC1L1, съответно; (5) синтез на жлъчни киселини и тяхното отделяне. При нормални условия тези пътища си взаимодействат, за да поддържат нивата на холестерола в рамките на определен диапазон.
4. Хранителен анализ при пациенти с NAFLD
5. Перспективи за терапия за управление на холестерола
Както е описано по-горе, изглежда, че претоварването с холестерол инициира развитието на NAFLD. Прогресията от проста стеатоза към стеатохепатит (NASH) обикновено включва второто попадение, като оксидативен стрес и възпаление. В някои проучвания на хранителни животински модели натрупването на холестерол, а не на мастни киселини/триглицериди играе критична роля в тази прогресия, вероятно поради повишената чувствителност към окислителна клетъчна смърт [41]. Предполага се също, че регулирането на холестерола може да контролира нивата на С-реактивния протеин и чувствителността към инсулин [41]. И обратно, в някои доклади прогресията на натрупването на триглицериди и потискането на окисляването на мастните киселини не са хепатотоксични и всъщност са защитени срещу влошаване на чернодробното увреждане [42]. Следователно, управлението на холестерола може да бъде обещаваща цел за лечение на NAFLD.
Езетимиб, агент за понижаване на холестерола в кръвта, е специфичен за NPC1L1 инхибитор и селективно блокира 54% от абсорбцията на холестерол от червата при хора и животни [43, 44]. Езетимиб се абсорбира бързо, навлиза в ентерохепаталната циркулация и има полуживот 24 часа. От хранителна гледна точка е важно езетимиб да не инхибира усвояването на мастноразтворимите витамини. В нашето клинично проучване пациентите с НОБНП, страдащи от НОБНП, показващи излишен прием на диетичен холестерол, са лекувани с езетимиб [45]. След започване на терапията, въпреки че не се наблюдават значителни промени в телесното им тегло, серумните нива на ALT намаляват с
% на 6 и 12 месеца, съответно. Нещо повече, стеатотичните открития при ултрасонография се подобряват при някои пациенти. Интересното е, че нокаутираните мишки NPC1L1 с излишен прием на храна са били устойчиви на затлъстяване на черния дроб, докато езетимиб предизвиква терапевтично значими ефекти при животински модели на NAFLD [46, 47]. Тези открития показват, че прекомерният прием и чернодробното натрупване на холестерол водят до активиране на LXRα-Пътят на SREBP-1c са тясно свързани с развитието на NAFLD. Съответно, инхибирането на абсорбцията на холестерол или намаляването на приема на диетичен холестерол може да предложи надеждна терапевтична стратегия за NAFLD. Съобщава се също така, че инхибиторите на HMG-CoA редуктазата (статини) подобряват серумните нива на ALT при пациенти с NAFLD [48-50].
Имайки предвид тези открития, намаляването на хепатоцитното натрупване на холестерол може да представлява основна стратегия за лечение на NAFLD [51]. За да се установят лечения, фокусирани върху управлението на холестерола, очевидно са необходими повече клинични доказателства. Например, диетата с ограничено съдържание на холестерол или липидните модулатори (езетимиб и статини) могат да бъдат по-малко ефективни при пациенти със затлъстяване с NAFLD с инсулинова резистентност, отколкото при пациенти, страдащи от безболезненост. Това е така, защото други фактори, свързани със затлъстяването и инсулиновата резистентност, участват в развитието на затлъстяване на черния дроб и тези фактори могат да прикрият ефекта на езетимиб. Има и други въпроси, на които също трябва да се отговори. Например, терапевтичният ефект на статина в комбинация с езетимиб надминава ли ефекта на монотерапия? Може ли дългосрочното управление на холестерола с езетимиб и/или статини наистина да подобри стеатозата, както и нивата на ALT при NAFLD? Също така е важно да се прецени дали клиничните ефекти от управлението на холестерола се наблюдават при пациенти със стеатохепатит (т.е. NASH), както и при пациенти с проста стеатоза и дали има синергичен/адитивен ефект от управлението на холестерола в комбинация с антиоксидантна терапия или чернодробна защитна терапия.
6. Заключения
Системата за обратна връзка, контролираща вътреклетъчните нива на липидите, е силно нарушена при NAFLD. Модификациите на начина на живот предлагат прости терапевтични цели за NAFLD. Когнитивната хранителна подкрепа, която е насочена към намаляване на приема на калории и избягване на преяждането, трябва да се развие заедно с фармацевтични лечения, за да се предотврати прогресирането на заболяването до цироза и HCC. Излишният прием на холестерол, по-специално, е основен стимулатор за развитието на затлъстяване на черния дроб. Натрупването на холестерол, а не на триглицериди, може да играе критична роля за прогресията от проста стеатоза до стеатохепатит. Съответно, стратегиите, насочени към натрупване на холестерол, предлагат основни терапевтични подходи за пациенти с NAFLD и терапията за управление на холестерола изглежда представлява обещаващо лечение за NAFLD. Потенциалната клинична полза от управлението на холестерола за лечение на NAFLD по отношение на чернодробна стеатоза и нараняване трябва да бъде оценена в подходящо планирани проучвания.
Конфликт на интереси
Авторите нямат конфликт на интереси, който да декларират.
Препратки
- Безалкохолно мастно чернодробно заболяване през 60-те години Въздействие на саркопенията и затлъстяването - PubMed
- Безалкохолна мастна чернодробна болест (NAFLD) MNGI
- Безалкохолни мастни чернодробни заболявания Симптоми, причини и др
- PRIME PubMed Разпространение на безалкохолна мастна чернодробна болест при амбулаторни пациенти в Ростов на Дон
- Без хранителни вещества пълноценният куркумин подобрява безалкохолната мастна чернодробна болест чрез инхибиране