Виктория М. Гершуни
1- Катедра по хирургия, Медицинско училище Perelman, Университет на Пенсилвания, Филаделфия, Пенсилвания
2- Отдел по гастроентерология, Медицински факултет на Перелман, Университет в Пенсилвания; Филаделфия, Пенсилвания
Стефани Л. Ян
3- Отдел по гастроентерология и хепатология, Катедра по вътрешни болести, Калифорнийски университет в Дейвис, Дейвис, Калифорния
Валентина Медичи
3- Отдел по гастроентерология и хепатология, Катедра по вътрешни болести, Калифорнийски университет в Дейвис, Дейвис, Калифорния
Резюме
Цел на прегледа:
Целта на настоящата статия е да направи преглед на съвременната литература за хранителната кетоза в контекста на управлението на теглото и метаболитния синдром - а именно инсулинова резистентност, липиден профил и риск от сърдечно-съдови заболявания и развитие на безалкохолна мастна чернодробна болест. Ние предоставяме информация за механизма на кетогенезата и описваме хранителната кетоза.
Последни открития:
Установено е, че хранителната кетоза подобрява метаболитните и възпалителни маркери, включително липиди, HbA1c, високочувствителен CRP, нива на инсулин и глюкоза на гладно и помага при управлението на теглото. Ние обсъждаме тези открития и разглеждаме потенциалните механизми на кетоните за насърчаване на загуба на тегло, намаляване на глада и увеличаване на ситостта.
Резюме:
Хората са се развили с капацитета за метаболитна гъвкавост и способността да използват кетони за гориво. По време на състояния на нисък хранителен прием на въглехидрати, нивата на инсулин остават ниски и настъпва кетогенеза. Тези състояния насърчават разграждането на излишните запаси от мазнини, щаденето на чиста мускулатура и подобряването на чувствителността към инсулин.
ВЪВЕДЕНИЕ
Затлъстяването и свързаният с него метаболитен синдром са епидемии в западния свят. В световен мащаб затлъстяването се е утроило почти през 1975 г. През 2016 г. СЗО съобщава за наднормено тегло и затлъстяване в световен мащаб над 39% и 13%, съответно. В САЩ тези зашеметяващи статистически данни включват два милиарда възрастни и представляват над 149 милиарда долара за здравеопазване годишно. 1 Успоредно с това 40% от населението на възраст над 60 години има метаболитен синдром, който се определя от съзвездие от симптоми и биомаркери, включително: затлъстяване (обиколка на талията), повишена кръвна захар на гладно с инсулинова резистентност, хипертриглицеридемия, нисък HDL холестерол, и хипертония. 2 Метаболитният синдром е системно възпалително състояние, свързано с 5-кратно повишен риск от диабет и 2-кратен риск от сърдечно-съдови заболявания (ССЗ), като и двете са все по-чести причини за заболеваемост и смъртност. 3
Интригуващо е, че петте основни компонента на метаболитния синдром - затлъстяването, кръвната захар на гладно, високите триглицериди (TG), ниският HDL холестерол и хипертонията - се подобряват чрез ограничаване на въглехидратите, което предполага, че непоносимостта към въглехидрати е обща нишка. С индустриализацията на доставките на храни през последните няколко века се радваме на излишък от калории и хранителни продукти с преработена захар и въглехидрати. Във връзка с това наблюдаваме скокове на затлъстяване и наднормено тегло, както и влошаване на метаболитната годност.
Чрез ограничаване на диетичните въглехидрати, секрецията на инсулин може да се стабилизира на по-ниски нива. Когато нивата на инсулин са ниски, складираните мазнини в мастната тъкан се подлагат на липолиза чрез хормоночувствителна липаза. Веднъж освободени, свободните мастни киселини претърпяват бета-окисление в чернодробните митохондрии, за да произведат ацетил КоА за генериране на кетонни тела. Този процес може да предизвика състояние на хранителна кетоза, което може да доведе до промяна в метаболизма. 4,5 Намаленото освобождаване на инсулин насърчава метаболитната промяна към липидното окисление и използването на мастни киселини и кетони за енергия. 6
Кетони - алтернативен източник на гориво
Като вид, ние имаме метаболитна гъвкавост с възможността да разчитаме на алтернативни източници на гориво за енергия. Хората не са зависими от екзогенни източници на глюкоза за оптимална функция; по-скоро сме се развивали през хилядолетия, за да се приспособим към променящите се условия и да се приспособим както към недостига, така и към изобилието. Както д-р Рандъл обяснява в Lancet през 1963 г., „Субстратният метаболизъм в нормалното човешко тяло е гъвкав. Телата ни са се развили, за да използват различни източници на гориво в зависимост от тяхната наличност. " 7
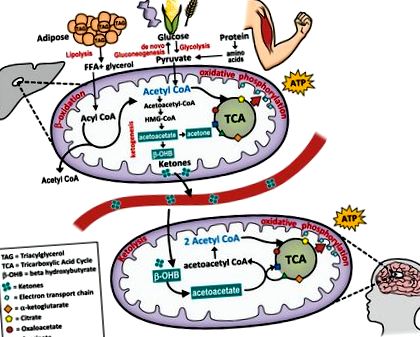
Като алтернатива на усвояването на глюкозата, тялото може метаболитно да се огъне в състояние на кетоза, което разчита на кетони, получени от мазнини, произведени в черния дроб, за да осигури гориво за почти всяка клетка в тялото (виж фигура 1). Кетоните - ацетоацетат, бета-хидроксибутират и ацетон - са водоразтворими молекули, произведени от черния дроб от мастни киселини, когато запасите от кръвна глюкоза и чернодробен гликоген са сведени до минимум. Настъпва изчерпване на гликогена и нивата на кетони се повишават в периоди на гладуване, нисък прием на въглехидрати, интензивни упражнения, глад или поради пълна липса на инсулин при нелекуван диабет тип I.
Кетогенезата, производството на кетони за гориво, е нормален физиологичен процес, който се осъществява чрез чернодробно бета-окисление на свободни мастни киселини в митохондриите на чернодробните клетки. Енергията, съхранявана като мазнина в мастната тъкан, се освобождава до ацетил-КоА и се превръща в кетони. Извънчернодробните тъкани са в състояние да претърпят кетолиза и да преобразуват кетоните обратно в ацетил-КоА, който влиза в TCA цикъла и се използва от митохондриите за генериране на АТФ за енергия.
Хормоналното активиране на липолизата и кетогенезата се медиира от епинефрин и глюкагон и се противопоставя от инсулина. При минимални диетични въглехидрати инсулинът е нисък, а глюкагонът се увеличава. В допълнение към стимулирането на гликогенолизата в черния дроб, глюкагонът стимулира липолизата за освобождаване на складирани мастни киселини от мастната тъкан. 8 В допълнение към образуването на кетони, мастните киселини могат да бъдат превърнати в ацетил КоА - междинен субстрат между окисляването на мастните киселини и метаболизма на глюкозата - който влиза в цикъла на лимонената киселина и след това се подлага на окислително фосфорилиране за генериране на АТФ. Обратно, в отговор на висока кръвна глюкоза (т.е. след хранене с високо съдържание на въглехидрати), нивата на инсулин се повишават и изключват кетогенезата в полза на de novo липогенезата (съхранение на мазнини). По този начин кетозата означава преминаване от медиирано от инсулин състояние, зависимо от глюкозата, към повишена способност за използване на хранителни мазнини и мастни запаси за гориво.
Чрез този процес получената от мазнини енергия се генерира в черния дроб и след това се доставя по цялото тяло, за да доставя енергия на мозъка, бъбречната кора, сърцето и скелетните мускули. 6 кетони могат да доставят до 60% от АТФ, необходим на организма; 9 останалата част е получена от ендогенна глюконеогенеза, която използва глицерол от триглицериди и глюкогенни аминокиселини от протеин за производството на глюкоза. Кетоните преминават през кръвно-мозъчната бариера и заместват глюкозата като основен източник на енергия за мозъка. Пионерската работа на Джордж Кахил, използвайки модели на кетоза за глад, разкрива, че мозъкът има метаболитна гъвкавост и може да премине от зависим от глюкоза орган (
150g/ден) до такъв, който получава 2/3 от енергията си от кетони. 9,10
Хранителна кетоза
Хранителната кетоза може да се определи като умишлено ограничаване на приема на диетични въглехидрати, за да се ускори производството на кетони и да се предизвика метаболитен ефект, който стабилизира кръвната захар, минимизира отделянето на инсулин и по този начин смекчава анаболните и туморогенните ефекти след дълготрайна инсулинова резистентност. Както е описано от Volek и Phinney, „добре формулираната“ кетогенна диета се състои от 5–10% въглехидрати (11 Това е в ярък контраст с патофизиологичното състояние на диабетна кетоацидоза от тип 1 и не трябва да се бърка с него). . Въпреки подобни звучащи имена, те са два различни метаболитни процеса. Производството на ендогенен инсулин е защитно срещу появата на DKA; обхватът на наличните кетони в DKA е 5-10 пъти по-голям от нивата, постигнати по време на хранителната кетоза. Освен това, докато при хранителна кетоза тялото е в състояние да поддържа нормални нива на глюкоза в кръвта и да поддържа нормално рН, за разлика от изключително повишените кръвни захари и киселинното рН, свързани с DKA.
След много седмици настъпва „кето-адаптация“, което означава способността на телата да се адаптират и да реагират предимно на използването на кетони за гориво. Една от потенциалните причини това да се случи е вторична по отношение на регулираната транскрипция на гени, които кодират метаболитния механизъм, водещ до повишена митохондриална плътност в окислителните тъкани като мозъка и мускулите. Проучванията на мишки предполагат, че това може да се случи чрез повишена митогенеза или намалено увреждане на митохондриите. 12,13 Освен това кетоните са способни да индуцират епигенетична регулация чрез инхибиране на хистоновото деацетилиране, което показва, че те са сигнална молекула в допълнение към енергиен източник. 14.
Произход на кетогенната диета като медицинска терапия
Оригиналните изследвания на кетогенната диета започват в началото на 1900 г. като начин за управление на епилепсията и минимизиране на припадъчната активност. Чрез индуциране на кетоза, пациентите имат смекчаване на припадъчната активност и подобрения в когнитивната функция, подчертавайки способността на кетоните да осигуряват енергия на мозъка. 15 От 60-те години нататък много нисковъглехидратните кетогенни диети (VLCKD) стават все по-известни като методи за лечение на затлъстяване. Неотдавнашната работа през последните няколко десетилетия предостави доказателства за терапевтичния потенциал на кетогенните диети при много патологични състояния, включително диабет, СПКЯ, акне, неврологични заболявания (епилепсия, болест на Алцхаймер, CVA), рак и подобряване на риска от респираторни и сърдечно-съдови заболявания фактори. 15 Възможността, че модифицирането на приема на храна може да намали или премахне нуждата от лекарства, които често носят значителни странични ефекти, изисква сериозно разследване. Диетичният прием на въглехидрати е проучен с променливи находки, което често се дължи на липса на стандартизация на приема на въглехидрати и невъзможност за потвърждаване на кетозата без проверка на нивата на кетони в кръвта.
Според Volek и Phinney 5,16 основната характеристика на кетогенните диети е установяването на кетоза и стабилизирането на нивата на инсулина, което се отнася до биомаркерите на метаболитния синдром. Чрез намаляване на повишаването на инсулина, липидите се освобождават от съхранението и се окисляват. 17 Като такава, кетозата може да се използва като индикатор за липолиза. По този начин, когато се разглеждат проучвания, сравняващи диети с „ниско съдържание на въглехидрати“, е важно да се оцени дали диетата е кетогенна. Тази литература за храненето варира широко в дефиницията си за това какво представлява „нисък“ прием на въглехидрати, като някои от тях разглеждат 35% калории от въглехидрати или по-малко от 140g/d като показател. Поради това е важно, когато се оценява въздействието на VLCKD, изследването да се извършва с помощта на 18
Този преглед ще подчертае сегашното разбиране за ролята на кетогенните диети за управление на теглото и метаболизма, диабет, коронарна съдова болест и неалкохолна мастна чернодробна болест (NAFLD).
ОТСЛАБВАНЕ
В мета-анализ, сравняващ интервенции с ниско съдържание на въглехидрати и LFD за възрастни с наднормено тегло и затлъстяване, Sackner-Bernstein и колеги са прегледали 17 RCT (общо 1797 пациенти). Изходните демографски данни, приема на калории и степента на завършеност са сходни между различните групи. За нисковъглехидратната група средният дневен прием на макронутриенти е 60 g въглехидрати (95% CI: 44, 76), 90 g мазнини (95% CI: 77, 104) и 106 g протеин (95% CI: 77, 104). Групата с ниско съдържание на мазнини се състои от 205 g въглехидрати (95% CI: 186, 225), 37 g мазнини (95% CI: 32, 42) и 70 g протеин (95% CI: 64, 76). Всяка диета е свързана със значителна загуба на тегло и намаляване на прогнозирания риск от коронарни събития, но групата с ниско съдържание на въглехидрати има статистически значително по-голямо подобрение и при двете. 28
МЕТАБОЛИТЕН СИНДРОМ
Липиден профил и ССЗ
Гликемичен контрол, инсулинова чувствителност и диабет
Управлението на плазмената глюкоза и модулацията на ефектите на инсулина върху липидния метаболизъм са важни цели при лечението на диабет и превенцията на коморбидни състояния, включително системни микроваскуларни усложнения. Инсулиновата резистентност е свързана с повишено чернодробно натрупване на липиди, производство на VLDL и глюконеогенеза. 57,62 Инсулиновата резистентност е сложно метаболитно състояние, което влияе върху усвояването на енергия и стимулира „извънматочното“ отлагане на мазнини в не-мастните органи, особено скелетните мускули, сърцето и панкреаса. 52,61,63 На нивото на скелетната мускулатура пречи на способността да поема глюкозата в плазмата, което води до отклоняване на глюкозата към черния дроб, където тя се превръща и съхранява като мазнина. 15,62 За разлика от тях, хранителната кетоза намалява нивата на инсулин, като по този начин потиска липогенезата. 15
При пациенти с диабет тип 2, VLCKD са свързани с намалена нужда от екзогенен инсулин; нарастващите нива на кетони са обратно свързани с нивата на генериране на чернодробна глюкоза, което предполага, че по-високите нива на кетони са свързани с подобрен гликемичен контрол. Accurso et al. показа, че пациенти с диабет тип 2 на VLCKD (67 По подобен начин McKenzie et al. са включили 262 пациенти с диабет в амбулаторна програма с консултации по хранене, модификация на поведението, дигитално обучение и медикаментозно лечение с помощта на лекар. След 10 седмици, повторна оценка се отличава с последователно ограничаване на въглехидратите, което се доказва от средните нива на бета-хидроксибутират, намаляване на хемоглобина А1с и намаляване на дозата и броя на лекарствата за диабет.68 В проспективно, 1-годишно отворено, нерандомизирано, контролирано проучване, Bhanpuri et ал. оценява непрекъсната грижа за диабет, използвайки хранителна кетоза в сравнение с обичайната грижа (съответно 262 и 87 участници). Групата за хранителна кетоза е подобрила биомаркерите за риск от ССЗ на 1 година, включително подобрения в липидния профил и размера на LDL частиците, понижено кръвно налягане и възпаление
Чернодробна стеатоза (NAFLD)
NAFLD - чернодробната проява на метаболитен синдром - се характеризира с чернодробна стеатоза при липса на други добре известни форми на чернодробно увреждане като прекомерна консумация на алкохол, вирусна инфекция, автоимунно заболяване или токсични (например медикаментозни) обиди. 56 NAFLD обхваща широк спектър от състояния на чернодробни заболявания от проста стеатоза до напреднала фиброзна чернодробна болест. 62 Безалкохолният стеатохепатит (NASH) е по-тревожна форма на NAFLD, която се характеризира с балониране на хепатоцити, възпалителен инфилтрат и различни стадии на фиброза, често водещи до напреднало чернодробно заболяване (напр. Цироза и хепатоцелуларен карцином). 56,57,62,74
Смята се, че NAFLD е отрицателна последица от ектопично чернодробно натрупване на липиди в условията на инсулинова резистентност, както беше обсъдено по-горе. 26,57,61 Стеатозата - характеризираща се с отлагане на триглицериди в хепатоцитите - подчертава тясната връзка между висцералното затлъстяване, NAFLD и натоварената с въглехидрати диета с високо съдържание на мазнини на Запад. 62 Висцералното мастно отлагане стимулира освобождаването на цитокини и системната инсулинова резистентност, а диетите с високо съдържание на наситени мазнини и прости въглехидрати водят до доставяне на свободни мастни киселини до черния дроб, стимулирайки de novo липогенеза, оксидативен стрес и липо-токсичност. 57,62
Малко, двуседмично клинично проучване рандомизира 18 пациенти с NAFLD на диета с ограничено съдържание на въглехидрати или диета с ограничено съдържание на калории и стана свидетел на по-голямо намаляване на съдържанието на интрахепатални триглицериди в рамото с въглехидрати. 75 В по-обширен преглед Yki-Jarvinen et al. направи оценка на скорошни проучвания, сравняващи въздействието на различни диети върху чернодробната мазнина и чувствителността към инсулин, като същевременно контролира съдържанието на калории. Резултатите са неубедителни и показват намаляване на обема на черния дроб при хипокалоричната нисковъглехидратна кетогенна диета в сравнение със стандартната диета. Между изокалоричните групи обаче се наблюдава по-голямо намаляване на съдържанието на мазнини в черния дроб при диети с ниско съдържание на мазнини, с високо съдържание на въглехидрати (16–23% мазнини, 57–65% въглехидрати) в сравнение с диети с ниско съдържание на въглехидрати и мазнини (43– 55% мазнини, 27–38% въглехидрати). 57 Важна забележка към тези резултати е, че групата с ниско съдържание на въглехидрати не е спазвала кетогенна диета, така че би било неразумно да се приписва преждевременно този несъответстващ резултат на приема на мазнини с храната, без да се провежда подобен експеримент за оценка на изокалоричната хранителна кетоза.
Повечето от разгледаните проучвания бяха ограничени от малък размер на извадката и кратка продължителност на проследяването, което засилва недостига на литература, изучаваща връзката между диетата и NAFLD и нейните дългосрочни клинични последици. Освен това, различни диетични стратегии показват подобрения в чернодробната стеатоза, но някои едновременно показват неблагоприятни ефекти върху чернодробното възпаление и фиброза. 26,61 По-ранно проучване на пациенти със затлъстяване със затлъстяване, на които е дадена диета с намалено съдържание на калории, последвано от гастропластика, показва намаляване на съдържанието на чернодробни мазнини, придружено от загрижено увеличение на порталното възпаление и фиброза, за което се предполага, че е свързано със скоростта на отслабване. 76 За разлика от това, Weiner et al. наблюдават доказани с биопсия доказателства за подобрение на стеатозата, възпалението и фиброзата при 284 пациенти със затлъстяване с бариатрична хирургия. 77 Остава неясно дали подобренията в чернодробната стеатоза водят до намаляване на фиброзата и напреднало чернодробно заболяване.
ЗАКЛЮЧЕНИЕ
Съществуват убедителни доказателства за използването на хранителна кетоза за управление на теглото и компонентите на метаболитния синдром. Чрез използването на алтернативни източници на гориво, а именно кетони, можем да се възползваме от антагонистичната връзка на висок глюкагон и ниски нива на инсулин, които насърчават разграждането на мазнините за гориво, щаденето на гликоген в мускулите и de novo глюконеогенезата, ако е необходимо. Необходими са допълнителни изследвания за дългосрочно придържане и практичност на VLCKD, но настоящите резултати са обещаващи за управление на теглото, липидни профили и чувствителност към инсулин.
Благодарности:
Авторите биха искали да благодарят на Робин Ноел за нейната техническа помощ при създаването на графиките за фигурата.
Бележки под линия
Спазване на етичните насоки
Конфликт на интереси
Виктория М. Гершуни, Стефани Л. Ян и Валентина Медичи заявяват, че нямат конфликт на интереси.
Права на човека и животните и информирано съгласие
Тази статия не съдържа изследвания с хора или животни, извършени от някой от авторите.
- Безплатни пълноценни атерогенни индекси за намаляване на хранителните вещества и загуба на тегло при пациенти с метаболитен синдром
- Нутригенетика, управление на теглото и хранителни добавки Хранителни перспективи
- Преглед и коментар на хранителните препоръки, Наредби за управление на теглото, Тегло
- На Keto Осигурете бързо отслабване Съвети Магазин - Управление на HazMat
- На Keto Secret Хапчета за отслабване Хапчета за отслабване - Управление на HazMat